黄芪多糖对大鼠缺血再灌注急性肾损伤的保护作用及机制研究①
2019-09-03尹显华胡水清
王 虹 尹显华 胡水清
(遵义医科大学附属医院泌尿内科,遵义563000)
急性肾损伤(Acute kidney injury,AKI)是危重患者常见并发症,统计数据显示住院患者AKI发病率为5.0%~22.7%,死亡率高达10.8%,且死亡风险是非AKI患者的4倍[1,2],因此一直倍受重视。约47%的AKI是由缺血再灌注损伤(Ischemical reperfusion injury,IRI)引起的[3]。炎症反应在IRI过程中发挥重要作用。转录因子NF-κB(Nuclear factor kappa B)是Toll 样受体(Toll-like receptor,TLR)下游的关键因子,TLR-4/NF-κB信号通路可调节炎症因子的表达进而调控炎症反应。研究发现,在IRI模型AKI大鼠的肾组织中TLR-4及NF-κB蛋白高表达,提示TLR-4/NF-κB信号通路参与了AKI的发生[4]。
黄芪多糖(Astragalus polysaccharide,APS)是中药黄芪的主要生物活性物质。研究发现,APS对脂多糖诱导的心肌细胞炎症损害具有保护作用[5],且在体内外证实其对IRI亦具有保护作用[6]。研究还发现,APS可抑制骨髓间充质干细胞及心肌细胞中TLR-4及NF-κB蛋白的表达[5,7]。本课题拟研究APS对IRI大鼠AKI是否具有保护作用,及其机制是否与抑制TLR-4/NF-κB信号通路有关。
1 材料与方法
1.1 材料 APS购自天津赛诺制药有限公司;TRIzol试剂购自美国 Invitrogen公司;dNTP Mixture、RNA酶抑制剂、SYBR®Premix Ex TaqTM购自宝生物工程(大连)有限公司;MMLV逆转录酶购自普洛麦格(北京)生物技术有限公司;兔抗鼠TLR-4、NF-κB(p65)一抗购自美国Eptomics公司;兔抗鼠GAPDH一抗、山羊抗兔二抗、免疫组化试剂盒购自北京中杉金桥公司;引物设计合成由上海生工生物工程有限公司完成;实验用SD雄性大鼠购自遵义医学院实验动物中心。
1.2 方法
1.2.1 动物模型建立 SD大鼠共96只,8~10周龄,体重250~300 g,随机分为假手术组(对照组)、模型组、APS低剂量治疗组和APS高剂量治疗组,每组24只。根据参考文献[3]建立动物模型:大鼠俯卧位,7%水合氯醛按0.3 g/kg腹腔注射麻醉。于背部正中偏右1 cm、近第12肋向下纵行切开皮肤,切开腰背筋膜暴露肾周脂肪组织。钝性游离脂肪组织显露右肾及肾蒂,锐性分离双侧肾动脉。辨认与腹主动脉关系后,动脉夹阻断双侧肾动脉45 min 后松开,观察肾灌注良好后逐层关闭切口。假手术组游离双侧肾动脉后不夹闭。
APS低剂量治疗组与高剂量治疗组在术前2 h及术后24 h分别在腹腔注射200 mg/kg及400 mg/kg的APS,模型对照组腹腔注射等量生理盐水。
术前2 h给药组在术后24 h进行取样,术后24 h 给药组在术后48 h进行取样(每组两时间点取各12只):大鼠同法麻醉后采集尾静脉血送生化检测,并切取右侧肾脏,生理盐水漂洗后,一部分肾组织在-80℃冰箱中保存以备提取mRNA,一部分用10%中性福尔马林溶液固定。常规方法制备切片,用于免疫组织化学染色。
1.2.2 AKI传统指标检测 全自动生化检测仪检测各组术后24 h、48 h血肌酐(Creatinine,Cr)、血尿素氮(Blood urea nitrogen,BUN)表达水平。
1.2.3 荧光定量PCR(RT-qPCR)检测mRNA相对表达 各组切除后的肾组织采用液氮研磨、Trizol法提取Total RNA,运用M-MLV逆转录酶及相关试剂进行逆转录反应,反应体系为20 μl,具体如下:RNA 2 μg+RT引物1 μl+DEPC水8 μl,65℃ 10 min,立刻冰浴2 min;随后补加:5×buffer 4 μl、0.1 mol/L DTT 2 μl、dNTPs(10 mmol/L)1 μl、RNase Inhibitor 1 μl、M-MLV 1 μl,42℃ 30 min、70℃ 10 min。取0.5 μl逆转录产物运用SYBR®Premix Ex TaqTM进行RT-qPCR。以GAPDH为内参,反应条件如下:94℃ 4 min;94℃ 30 s、56℃ 60 s、72C 40 s,进行40个循环。引物序列见表1。
1.2.4 Western blot检测蛋白表达 各组切除后新鲜肾组织中加入适量冷组织蛋白裂解液后,将标本剪碎,置入超声波细胞粉碎机匀浆超声破碎。破碎后的样本冰浴静止裂解30 min,于4℃ 13 500 r/min离心10 min,取上清,放至新的EP管中于-80℃保存。配制5%与10%SDS-PAGE变性胶对目的蛋白进行电泳、湿法转至PVDF膜、1×Blotto中封闭、加入一抗4℃摇床过夜、TBST液洗膜后加入二抗(HRP标记山羊抗兔IgG抗体)、ECL法发光拍照。最后采用Image-Pro Plus软件对条带的吸光度值进行分析,目的蛋白相对量用目的条带吸光度值/内参GAPDH蛋白条带吸光度值表示。
1.2.5 免疫组化检测 组织石蜡切片后二甲苯中浸泡脱蜡;梯度乙醇浸泡脱水;3%H2O237℃孵育10 min灭活内源性过氧化物酶。接着在0.01 mol/L枸橼酸钠缓冲溶液(pH6.0)中95℃左右对抗原进行热修复;正常山羊血清封闭液封闭,按顺序滴入一抗、二抗孵育。按DAB显色试剂盒操作说明显色,镜下掌握显色程度。自来水充分冲洗后,苏木素复染、常规梯度酒精脱水、二甲苯透明、中性树胶封片,晾干后显微镜下观察棕褐色着色为阳性细胞。
表1 引物序列
Tab.1 Primer sequence
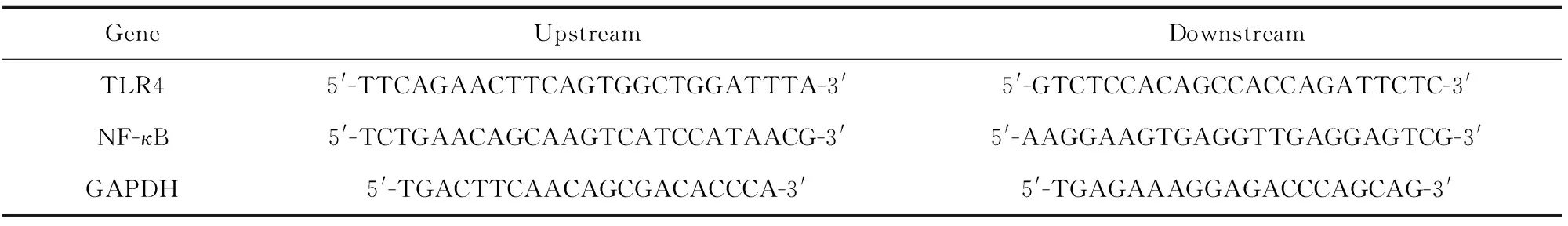
GeneUpstreamDownstreamTLR45'-TTCAGAACTTCAGTGGCTGGATTTA-3'5'-GTCTCCACAGCCACCAGATTCTC-3'NF-κB5'-TCTGAACAGCAAGTCATCCATAACG-3'5'-AAGGAAGTGAGGTTGAGGAGTCG-3'GAPDH5'-TGACTTCAACAGCGACACCCA-3'5'-TGAGAAAGGAGACCCAGCAG-3'
2 结果
2.1 APS对大鼠模型血BUN、Cr指标的影响 与假手术组比较,术后24 h及48 h,模型组血BUN、Cr指标明显升高,差异具有统计学意义(P<0.05,见图1),提示大鼠模型建立成功。与模型组比较,术后24 h及48 h,低剂量APS治疗组及高剂量治疗组血BUN、Cr均下降,低剂量治疗组差异无统计学意义(P>0.05),而高剂量治疗组明显降低(P<0.05),见图1。
2.2 肾组织中TLR-4、NF-κB mRNA表达 RT-qPCR检测各组两指标相对量,与假手术组比较,术后24 h及48 h,模型组TLR-4、NF-κB mRNA均显著增高(P<0.05)。与模型组比较,术后24 h及48 h,APS处理后TLR-4、NF-κB mRNA表达均有下降趋势,低剂量组差异无统计学意义(P>0.05),高剂量组显著下降(P<0.05),见图2。
2.3 肾组织中TLR-4、NF-κB蛋白表达 Western blot检测各组两蛋白表达结果,与假手术组比较,术后24 h及48 h,模型组TLR-4、NF-κB 蛋白均明显增高(P<0.05),TLR-4、NF-κB蛋白表达趋势与mRNA水平一致,提示TLR-4/NF-κB通路参与了IRI大鼠AKI的发生。与模型组比较,术后24 h及48 h,APS处理后TLR-4、NF-κB 蛋白表达均有下降趋势,低剂量组差异无统计学意义(P>0.05),高剂量组显著下降(P<0.05),见图3,各组TLR-4、NF-κB蛋白表达趋势与mRNA水平一致。

图1 各组术后24 h、48 h血Cr、BUN检测结果Fig.1 Levels of serum Cr and BUN test at 24 h and 48 h after operation in each groupNote: Model compared with sham operation,*.P<0.05;high dose treatment and low dose treatment compared with model,#.P<0.05.

图2 各组肾组织中TLR-4与NF-κB mRNA相对表达Fig.2 Relative expression levels of TLR-4 and NF-κB mRNA detected by RT-qPCR in renal tissues of each groupNote: Model compared with sham operation,*.P<0.05;high dose treatment and low dose treatment compared with model,#.P<0.05.
2.4 免疫组化检测各组肾组织TLR-4、NF-κB蛋白表达 假手术组中TLR4表达定位于肾小管细胞膜,仅有少量表达,模型组中TLR4表达明显增高,呈棕色着色,与假手术组比较,术后24 h及48 h,模型组TLR4阳性细胞百分率差异具有统计学意义(P<0.05),见图4;与模型组比较,术后24 h及48 h,低剂量组、高剂量组中TLR4阳性细胞百分率下降,差异具有统计学意义(P<0.05),见图4。NF-κB蛋白在肾组织中表达定位于胞浆内,术后24 h及48 h,模型组中NF-κB蛋白表达增强,对比假手术组差异具有统计学意义(P<0.05);与模型组比较,术后 24 h及48 h,低剂量组与高剂量组中NF-κB阳性细胞百分率有下降趋势,低剂量组降低无统计学意义(P>0.05),高剂量组则显著下降(P<0.05),见图5。

图3 Western blot检测各组肾组织TLR-4和NF-κB蛋白表达Fig.3 Proteins expression of TLR-4 and NF-κB detected by Western blot in renal tissues of each groupNote: Model compared with sham operation,*.P<0.05;high dose treatment and low dose treatment compared with model,#.P<0.05.
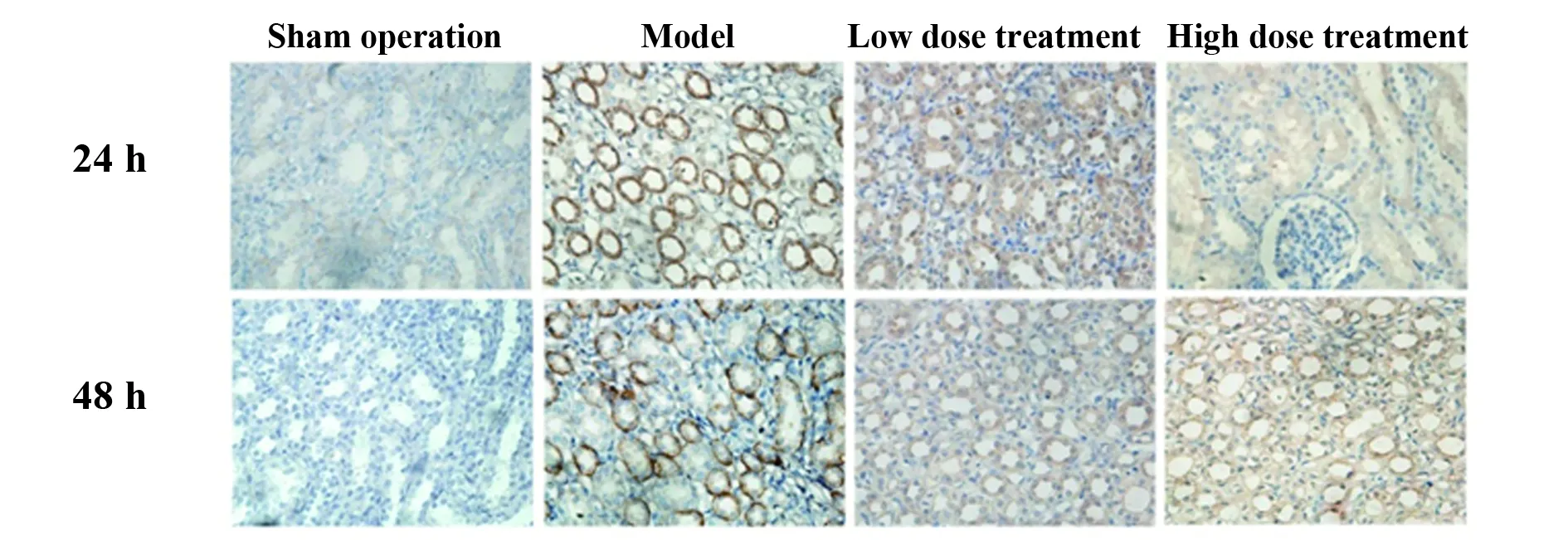

图4 免疫组化检测各组肾组织中TLR-4蛋白表达
Fig.4 TLR-4 protein expression detected by IHC in renal tissues of each group
Note: Model compared with sham operation,*.P<0.05;high dose treatment and low dose treatment compared with model,#.P<0.05.
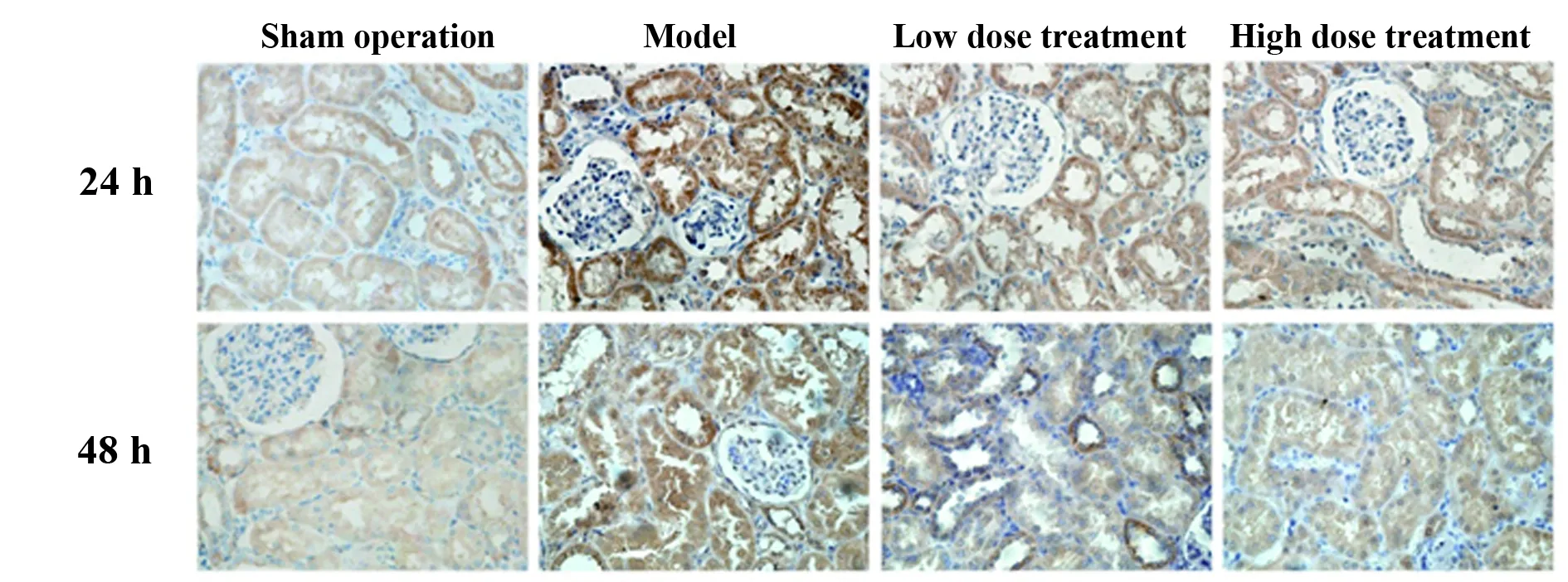
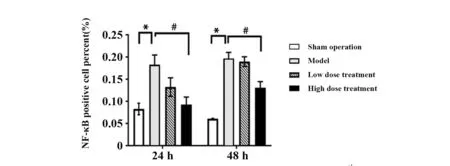
图5 免疫组化检测各组肾组织中NF-κB蛋白表达
Fig.5 NF-κB protein expression detected by IHC in renal tissues of each group
Note: Model compared with sham operation,*.P<0.05;high dose treatment and low dose treatment compared with model,#.P<0.05.
3 讨论
IRI引起AKI后主要病理变化为急性肾小球坏死,并引起相关生理、病理学改变如内皮细胞损伤、血液动力学改变、炎症反应及肾小管上皮细胞损伤与修复,其中炎症反应是其最重要的病理生理改变,但相关作用机制及调控网络尚未完全研究清楚。
研究发现,TLR-4调控其下游因子NF-κB参与免疫与炎症反应[8]。TLR-4是Toll家族成员之一,在多种组织中表达,主要参与固有免疫。当肾脏组织发生感染或损伤时,TLR-4表达增加,通过识别相应的内外源配体介导机体免疫及炎症反应[9]。NF-κB又称核转录因子,几乎存在于所有的细胞中,与其他细胞因子构成NF-κB信号通路在炎症反应、免疫反应和凋亡等方面发挥重要作用。其信号通路的激活分为两种途径:经典途径以及非经典途径。非经典途径主要参与细胞分化、活化;经典途径主要参与炎症反应,其激活方式依靠抑制蛋白(IKBs)降解[10]。TLR-4可通过MyD88-IRAK-TRAF6-TAK1 NIK/MKK-IKK复合物途径激活NF-κB经典信号通路[11]。Gao等[4]研究发现,TLR-4与NF-κB两者在IRI大鼠AKI模型中高表达,提示TLR-4/NF-κB信号通路参与了AKI的发生。本研究也有相同的发现,本实验采用双侧肾动脉夹闭的方式成功建立IRI大鼠AKI模型,与实施假手术的对照组比较,手术后24 h及48 h,模型组肾组织TLR-4、NF-κB在mRNA水平及蛋白水平均明显增高。
研究发现,APS具有增强免疫功能、抗肿瘤活性、保肝、降血糖、抗病毒等功效[12],此外在慢性肾衰动物模型实验中发现,APS通过改善脂类过氧化导致的应激状态,发挥抗氧化作用从而保护肾功能[13]。APS是否对AKI也具有保护作用,目前鲜见文献报道。在本研究中,我们在手术前2h及术后24 h对造模大鼠分别给予腹腔注射低剂量及高剂量APS,结果发现,在术后24 h及48 h,与造模组比较,血BUN、Cr均下降,低剂量组差异无统计学意义,高剂量组则显著降低,表明APS对IRI大鼠AKI具有保护作用,且高剂量的APS保护作用更明显。进一步研究发现,术后24 h及48 h,高剂量组肾组织TLR-4、NF-κB的mRNA及蛋白水平均显著低于模型组,提示APS对IRI大鼠AKI具有保护作用可能与抑制TLR-4/NF-κB信号通路有关。
综上所述,我们通过成功建立IRI大鼠AKI模型,一方面验证TLR-4/NF-κB信号通路参与AKI的发生,另一方面发现APS对IRI大鼠AKI具有保护作用,且其作用机制可能与抑制TLR-4/NF-κB信号通路有关。
