紫草素对心肌缺血再灌注损伤的保护作用研究①
2019-09-03白文伟刘小永黄晶晶
白文伟 杨 华 刘小永 黄晶晶
(昆明医科大学第二附属医院心内科,昆明650101)
缺血性心脏病是造成死亡和残疾的主要原因之一。对于急性心肌梗死患者,限制心肌梗死最有效的治疗方法是及时再灌注。但是,除了急性心肌缺血引起的损伤外,再灌注过程本身也可引起心肌损伤,即缺血再灌注(Ischemia reperfusion,I/R)损伤。然而,目前还没有有效的治疗方法来预防这种损伤,因此寻找新的治疗方法来保护心脏不受缺血再灌注损伤的影响对于人类的医疗健康事业的发展具有重要意义[1]。越来越多的研究表明许多植物提取物在治疗心肌缺血再灌注损伤方面发挥着积极作用,如黄芪多糖,罗布麻叶提取物,淫羊藿苷等[2-4]。紫草是一种传统草药,主要用于治疗HIV-1感染。紫草素(Shikonin,Shi)是从紫草中分离出来的活性成分。大量数据显示紫草素具有抗血管生成、抗炎症、抗糖酵解等活性[5]。紫草素在癌症、骨关节炎、肥厚性疤痕和子宫内膜异位等疾病治疗中发挥着积极作用[6-9]。但紫草素在缺血再灌注损伤中的作用还尚不清楚。本研究的主要目的是探索紫草素对心肌缺血再灌注损伤的保护作用及其分子机制。
1 材料与方法
1.1 材料 10~12周龄的小鼠购自成都达硕实验动物有限公司。紫草素(HPLC≥98%)和PI3K/AKT信号通路抑制剂LY294002购自Sigma公司,溶解于DMSO中。苏木素-伊红(Hematoxylin-eosin,HE)染色液购自Solarbio。天冬氨酸转氨酶(Aspart-ate transaminase,AST)和乳酸盐脱氢酶(Lactate dehydrogenase,LDH)检测试剂盒购自中生北控生物科技股份有限公司。肌酸激酶(Creatine kinase-MB,CK-MB)和心肌肌钙蛋白Ⅰ(Cardiac troponinⅠ,cTnⅠ)检测试剂盒购自默沙克公司。脱氧核糖核苷酸末端转移酶介导的缺口末端标记(Terminal deoxynucleotidyl transferase-mediated dUTP nick labeling,TUNEL)细胞凋亡检测试剂盒购自碧云天生物技术公司。超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽(Glutathione,GSH)和丙二醛(Malonaldehyde,MDA)含量检测试剂盒购自南京建成生物工程研究院。白细胞介素(Interleukin,IL)-6、IL-1β和肿瘤坏死因子α (Tumor necrosis factor alpha,TNF-α)的酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)检测试剂盒来自默沙克公司。抗Bax抗体、抗Bcl-2抗体、抗caspase-3抗体、抗caspase-9抗体、抗PI3K抗体、抗p-AKT抗体、抗AKT抗体、抗p-mTOR抗体和抗mTOR抗体购自Abcam公司。
1.2 方法
1.2.1 动物分组及处理 随机将小鼠分为5组:对照组(Ctrl);I/R模型组(I/R);紫草素处理组(I/R+Shi)(12.5、25、50 mg/kg)。紫草素处理组在进行手术前3 d每天灌胃紫草素(12.5、25、50 mg/kg),第4天时进行阻断左冠状动脉分支30 min,然后开放左冠状动脉以实现24 h的再灌注。I/R模型组进行手术前3 d则用生理盐水代替紫草素进行处理,第4天时进行阻断左冠状动脉分支30 min,然后开放左冠状动脉以实现24 h的再灌注。对照组进行手术前3 d则用生理盐水代替紫草素进行处理,第4天时进行手术但不阻断左冠状动脉分支。为分析PI3K/AKT信号通路在紫草素影响心肌缺血再灌注损伤小鼠中的作用,用PI3K/AKT信号通路抑制剂LY294002(5 mg/kg)和紫草素(50 mg/kg)单独或同时处理心肌缺血再灌注损伤小鼠。再灌注后检测心肌梗死面积。
1.2.2 心肌损伤标记物检测 再灌注后采集颈动脉血液,室温放置30 min,离心3 000 r/min,15 min,收集血清。按照AST、LDH、CK-MB和cTnⅠ检测试剂盒说明书对血清中AST、LDH、CK-MB和cTnⅠ的含量进行检测。
1.2.3 HE染色观察心肌组织病变 再灌注后取出心肌组织,首先PBS漂洗后于4%多聚甲醛、4℃固定24 h。再PBS清洗3次,30%、50%和70%的酒精依次脱水,每次10 min。然后于脱水机中进行脱水,石蜡包埋后再切片。最后按照HE染色液操作说明进行染色,显微镜下观察心肌组织病变情况。
1.2.4 TUNEL检测心肌组织细胞凋亡 石蜡切片首先进行二甲苯脱蜡、梯度乙醇水化,再用蛋白酶K于20~37℃孵育15~30 min。PBS漂洗3次后,3%的H2O2于室温孵育20 min。然后依照试剂盒说明书进行生物素标记、显色、苏木素复染,再用自来水冲洗、梯度乙醇脱水、二甲苯透明、中性树胶封片。最后显微镜下观察拍照。
1.2.5 蛋白印迹检测Bax、Bcl-2、caspase-3、casp-ase-9、PI3K、p-AKT、AKT、p-mTOR的蛋白水平 心肌组织冰上匀浆后,4℃、4 200 r/min离心10 min,取上清。等量蛋白进行SDS-PAGE凝胶电泳分离,再转至PVDF膜,5%的BSA封闭1 h后加入相应的一抗,4℃过夜孵育。然后再加入HRP标记的二抗,室温孵育1.5 h。最后加入发光液后于凝胶成像仪进行曝光拍照,并统计灰度值计算相对表达量。
1.2.6 氧化应激指标检测 首先心肌组织冰上匀浆后,4℃、4 200 r/min离心10 min,收集上清,按照SOD、GSH和MDA检测试剂盒说明书检测心肌组织匀浆液的上清中SOD、GSH和MDA水平。
1.2.7 ELISA检测炎症因子 收集小鼠血清,按照ELISA试剂盒说明书进行检测。首先样品加入反应孔,37℃孵育45 min,再用洗涤液洗涤4次,然后加入生物素标记的抗体,37℃孵育30 min,洗涤后加链霉亲和素-HRP,混匀,37℃孵育30 min。最后加入显色剂避光显色15 min,再加终止液终止反应,450 nm处检测吸光值。
1.3 统计学分析 用SPSS16.0软件对实验数据进行统计学分析,各组间进行单因素方差分析后再进行Duncan′s multiple range检验。P<0.01表示差异具有统计学意义。
2 结果
2.1 紫草素对心肌缺血再灌注损伤小鼠心肌梗死及心肌损伤标志物的影响 图1A显示,I/R组小鼠心肌梗死面积大于Ctrl组(P<0.01)。与I/R组相比,I/R+Shi(12.5、25、50 mg/kg)组小鼠心肌梗死面积下降(P<0.01)。通过HE染色观察心肌缺血再灌注损伤小鼠心肌组织病变,发现Ctrl组小鼠心肌组织细胞排列规则有序,肌纤维连续无断裂,未见炎症细胞浸润;I/R组小鼠出现心肌组织结构紊乱,横纹不清,出现断裂,大量炎症细胞浸润等病变;上述心肌组织病变在I/R+Shi(12.5、25、50 mg/kg)组小鼠中得到逐步缓解(图1B)。另一方面,图1C显示,I/R组小鼠AST、cTnⅠ、CK-MB和LDH水平高于Ctrl组(P<0.01)。与I/R组相比,I/R+Shi(12.5、25、50 mg/kg)组小鼠AST、cTnⅠ、CK-MB和LDH水平下降(P<0.01)。以上结果表明,紫草素可改善心肌缺血再灌注损伤小鼠心肌组织病变,降低心肌损伤标志物水平。
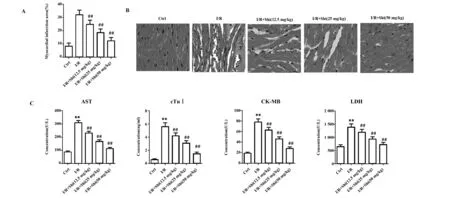
图1 紫草素对心肌缺血再灌注损伤小鼠心肌梗死及心肌损伤标志物的影响Fig.1 Effect of shikonin on myocardial infarction and myocardial injury markers in myocardial ischemia reperfusion injury miceNote: A.The size of myocardial infarct;B.The pathological changes of myocardial tissues were observed by HE staining(×200);C.The levels of myocardial injury markers.**.P<0.01 vs Ctrl group,##.P<0.01 vs I/R group.
2.2 紫草素对心肌缺血再灌注损伤小鼠细胞凋亡的影响 为分析紫草素对心肌缺血再灌注损伤小鼠细胞凋亡的影响,利用TUNEL检测细胞凋亡,蛋白印迹检测细胞凋亡相关蛋白Bax、Bcl-2、caspase-3和caspase-9表达。由图2A可知,I/R组小鼠心肌组织细胞凋亡高于Ctrl组(P<0.01)。I/R+Shi(12.5、25、50 mg/kg)组小鼠心肌组织细胞凋亡低于I/R组(P<0.01)。图2B显示,与Ctrl组相比,I/R组小鼠心肌组织Bax、caspase-3和caspase-9表达增强,Bcl-2表达减弱(P<0.01)。与I/R组相比,I/R+Shi(25、50 mg/kg)组小鼠心肌组织Bax、caspase-3和caspase-9表达下降,Bcl-2表达升高(P<0.01)。由此可见,紫草素可减弱心肌缺血再灌注损伤小鼠细胞凋亡,降低Bax、caspase-3和caspase-9表达,增强Bcl-2表达。
2.3 紫草素对心肌缺血再灌注损伤小鼠氧化应激的影响 通过检测SOD、GSH和MDA水平,分析紫草素对心肌缺血再灌注损伤小鼠氧化应激的影响。如图3所示,I/R组小鼠SOD和 GSH水平低于Ctrl组,MDA水平高于Ctrl组(P<0.01)。与I/R组相比,I/R+Shi(12.5、25、50 mg/kg)组小鼠SOD和 GSH水平升高,MDA水平下降(P<0.01)。以上结果说明,紫草素可减轻心肌缺血再灌注损伤小鼠氧化应激。

图2 紫草素对心肌缺血再灌注损伤小鼠细胞凋亡的影响Fig.2 Effect of shikonin on apoptosis in myocardial ischemia reperfusion injury miceNote: A.The apoptosis of myocardial tissues were detected by TUNEL staining;B.The expression of Bax,Bcl-2,caspase-3 and caspase-9 were measured by Western blot.**.P<0.01 vs Ctrl group;##.P<0.01 vs I/R group.

图3 紫草素对心肌缺血再灌注损伤小鼠氧化应激的影响Fig.3 Effect of shikonin on oxidative stress in myocardial ischemia reperfusion injury miceNote: **.P<0.01 vs Ctrl group;##.P<0.01 vs I/R group.

图4 紫草素对心肌缺血再灌注损伤小鼠炎症反应的影响Fig.4 Effect of shikonin on inflammatory response in myocardial ischemia reperfusion injury miceNote: **.P<0.01 vs Ctrl group;##.P<0.01 vs I/R group.

图5 紫草素对心肌缺血再灌注损伤小鼠PI3K/AKT信号通路的影响Fig.5 Effect of shikonin on PI3K/AKT pathway in myoc-ardial ischemia reperfusion injury miceNote: **.P<0.01 vs Ctrl group;##.P<0.01 vs I/R group.

图6 PI3K/AKT信号通路抑制剂可逆转紫草素对心肌缺血再灌注损伤小鼠的影响Fig.6 Effects of shikonin on myocardial ischemia reperfu-sion injury mice reversed by PI3K/AKT pathw-ay inhibitorNote: A.The expression of PI3K/AKT related proteins was detected by Western blot;B.The levels of myocardial injury markers;C.The expression of apoptosis related proteins was tested by Western blot;D.The levels of oxidative stress;E.The levels of inflammatory factors were detected by ELISA.**.P<0.01 vs I/R group;##.P<0.01 vs I/R+Shi(50 mg/kg)group.
2.4 紫草素对心肌缺血再灌注损伤小鼠炎症反应的影响 为分析紫草素对心肌缺血再灌注损伤小鼠炎症反应的影响,利用ELISA检测炎症因子IL-6、IL-1β和TNF-α水平。由图4可知,I/R组小鼠IL-6、IL-1β和TNF-α水平高于Ctrl组(P<0.01)。与I/R组相比,I/R+Shi(12.5、25、50 mg/kg)组小鼠IL-6、IL-1β和TNF-α水平降低(P<0.01)。上述结果表明,紫草素可抑制心肌缺血再灌注损伤小鼠炎症反应。
2.5 紫草素对心肌缺血再灌注损伤小鼠PI3K/AKT信号通路的影响 通过检测PI3K/AKT信号通路相关蛋白表达,分析紫草素对心肌缺血再灌注损伤小鼠PI3K/AKT信号通路的影响。图5显示,I/R组小鼠PI3K表达及p-AKT/AKT和p-mTOR/mTOR低于Ctrl组(P<0.01)。与I/R组相比,I/R+Shi(25、50 mg/kg)组小鼠PI3K表达及p-AKT/AKT和p-mTOR/mTOR上升(P<0.01)。由此可见,紫草素可激活心肌缺血再灌注损伤小鼠PI3K/AKT信号通路。
2.6 PI3K/AKT信号通路抑制剂可逆转紫草素对心肌缺血再灌注损伤小鼠的影响 为进一步验证紫草素是通过PI3K/AKT信号通路发挥保护心肌缺血再灌注损伤小鼠的功效,用PI3K/AKT信号通路抑制剂LY294002和紫草素单独或同时处理心肌缺血再灌注损伤小鼠。如图6所示,LY294002可逆转紫草素对心肌缺血再灌注损伤小鼠PI3K/AKT信号通路相关蛋白表达、心肌损伤标记物、细胞凋亡相关蛋白、氧化应激指标及炎症因子的影响。上述结果表明,紫草素可通过激活PI3K/AKT信号通路减轻心肌缺血再灌注损伤小鼠病变、细胞凋亡、氧化应激和炎症反应。
3 讨论
大量文献报道细胞凋亡、氧化应激及炎症反应在心肌缺血再灌注损伤中起着重要作用[10]。越来越多的研究表明许多植物提取物具有调控细胞凋亡、氧化应激及炎症反应的功效,在各类疾病的治疗中发挥着积极作用。
许多疾病中都会出现组织损伤病变及细胞凋亡增加的现象,大量数据显示植物提取物具有改善各种组织病变及细胞凋亡的作用。据报道红景天苷可改善心肌缺血再灌注损伤大鼠心肌细胞排列紊乱无序、坏死、炎症细胞浸润等病变,降低CK-MB和LDH水平;减弱细胞凋亡,上调Bcl-2/Bax比值,抑制caspase-3和caspase-9 活性[11]。Liu等[12]发现紫草素可减轻伴刀豆球蛋白A诱导的急性肝损伤小鼠肝脏组织水肿及坏死等病变,降低AST和ALT水平,降低Bax表达,提高Bcl-2表达。有研究表明在LPS诱导的急性肺损伤小鼠中,紫草素可减轻肺泡出血、炎症细胞浸润、间质水肿及肺泡壁增厚等病变[13]。另外,紫草素可改善脊髓受伤大鼠脊髓组织结构疏松、中性粒细胞浸润的症状;降低脊髓细胞凋亡,减弱caspase-3表达[14]。本研究结果表明,在心肌缺血再灌注损伤小鼠中,紫草素可改善心肌组织结构紊乱、横纹不清、出现断裂、大量炎症细胞浸润等病变,降低心肌损伤标志物AST、cTnⅠ、CK-MB和LDH水平;并减弱细胞凋亡,降低Bax、caspase-3和caspase-9表达,增强Bcl-2表达。
氧化应激在许多病变中都十分重要,越来越多的文献报道植物提取物在抗氧化应激方面起着积极作用。丹酚酸B可提高心肌缺血-再灌注损伤大鼠SOD水平,降低MDA水平[15]。据报道紫草素可提高脑缺血再灌注损伤小鼠过氧化氢酶(Catalase,CAT)和SOD水平[16]。Lin等[17]研究发现在D-半乳糖胺联合LPS诱导的急性肝损伤中,紫草素可降低MDA水平,提高GSH水平。此外,在碳离子束辐射诱导的脑损伤小鼠中,紫草素可提高SOD和CAT水平,降低MDA水平[18]。本文结果显示,在心肌缺血再灌注损伤小鼠中,紫草素可提高SOD和GSH水平,降低MDA水平,减轻氧化应激。
各种疾病中都会出现炎症反应增强的现象,大量研究表明许多植物提取物具有抗炎的功效。Tang等[19]发现在心肌缺血再灌注损伤大鼠中,原儿茶酸可降低TNF-α水平,抑制炎症反应。据报道在LPS诱导的急性肺损伤小鼠中,紫草素可降低IL-6、TNF-α和IL-1β水平[20]。有研究显示,紫草素还可降低骨关节炎大鼠IL-1β和TNF-α水平[21]。另外,在肺炎链球菌诱导的肺炎小鼠中,紫草素可降低IFN-γ 和IL-6水平[22]。本研究结果显示,在心肌缺血再灌注损伤小鼠中,紫草素可降低IL-6、IL-1β和TNF-α水平,抑制炎症反应。
PI3K/AKT信号通路在各种生物学进程中具有重要的调控作用,越来越多的研究表明许多植物提取物可影响PI3K/AKT信号通路。Jian等[23]研究发现龙须藤黄酮可提高心肌缺血再灌注大鼠PI3K表达及AKT磷酸化水平。据报道在心肌缺血再灌注大鼠中,丹参酮(Tanshinone,IIA)也可提高PI3K表达及AKT、mTOR磷酸化水平[24]。有数据显示在缺血再灌注肝损伤小鼠中,紫草素处理可提高PI3K表达及AKT磷酸化水平[25]。本文结果显示,在心肌缺血再灌注损伤小鼠中,紫草素可提高PI3K表达及p-AKT/AKT和p-mTOR/mTOR比值,且PI3K/AKT信号通路抑制剂可逆转紫草素对心肌缺血再灌注损伤小鼠的影响。
本研究表明,在心肌缺血再灌注损伤小鼠中,紫草素可改善心肌组织病变,降低心肌损伤标记物AST、cTnⅠ、CK-MB和LDH水平;减弱细胞凋亡,抑制Bax、caspase-3和caspase-9表达,增强Bcl-2表达;提高SOD和GSH水平,降低MDA水平;降低IL-6、IL-1β和TNF-α水平;提高PI3K表达及p-AKT/AKT和p-mTOR/mTOR比值,且PI3K/AKT信号通路抑制剂可逆转紫草素对心肌缺血再灌注损伤小鼠的影响。综上所述,紫草素可通过激活PI3K/AKT信号通路减轻心肌缺血再灌注损伤小鼠组织病变、细胞凋亡、氧化应激及炎症反应。
