猪小肠黏膜下层作为组织修复材料的研究进展
2019-09-03葛良鹏李前勇
粟 香,葛良鹏,3*,李前勇
(1.重庆市畜牧科学院,重庆 402460; 2.西南大学动物科学学院,重庆 402460; 3.重庆市医用动物资源开发与利用工程技术研究中心,重庆 402460)
机体是由细胞和细胞外基质(extracellular matrix, ECM)构成的共同体,细胞和ECM相互作用维持组织和器官正常形态并保持其动态平衡,ECM为细胞提供适宜其生长、增殖的微环境[1]。组织修复材料的重要研究方向是对天然的ECM进行模拟构建。猪SIS由于来源广泛,经济易得,加工方便,且脱细胞处理后的SIS具有优异的生物相容性,富含胶原蛋白和生长因子,能够诱导细胞向内扩散、粘附、生长、增殖,促进组织缺损处自身组织的修复和再生,因此在临床上得到了极大的发展应用。自40年前SIS首次作为血管替代材料用于再生修复研究以来,目前多个猪的SIS材料已获得批准进入临床应用。如美国Cook Biotech公司先后开发了以猪SIS为基本原料的生物医疗器械产品20多种,这些产品主要应用于疝修补片、软组织疝修补片、软组织/皮肤切口、创面敷料、心包补片、心脏起搏器封装套、神经保护膜等,年销售额超过10亿美金。国内北京大清生物技术股份有限公司、北京博辉瑞进生物科技有限公司、上海白衣缘生物工程有限公司等也均有猪SIS的产品开发和上市销售。猪SIS已广泛应用于临床和再生修复研究的各个领域,成为目前应用最为广泛的再生修复材料之一。本文在收集分析相关文献的基础上,重点就SIS的组成结构,特性、加工方式及应用进行综述。
1 SIS的组成结构
SIS以干重计,胶原蛋白含量占90%以上,主要由I型胶原以及少量的III、IV、V、VI型胶原组成[2],还包含有多种糖胺聚糖,如肝素、乙酰肝素、透明质酸、硫酸软骨素A、硫酸皮肤素[3]等,但不含有其他ECM含有的较多成分如硫酸角蛋白、硫酸软骨素C。SIS含有粘附分子如纤维连接蛋白、层粘连蛋白,还含有一些生长因子如转化生长因子-β(TGF-β)、碱性成纤维细胞生长因子(bFGF)、血管内皮生长因子(VEGF),这些生长因子在乙酸/乙醇灭菌以及4℃长期储存也能保持生物活性[4-5]。
SIS具有典型胶原纤维组织结构,其沿着小肠天然纵轴优选排列,并且这种排列似乎是两种胶原纤维的复合物,它们的质心偏离肠纵轴约30°;胶原纤维及其相邻平滑肌细胞层的这种螺旋排列有利于小肠以有效促进食糜向前推进(即蠕动)方式收缩[2]。猪SIS经受双轴机械测试时,这种优选纤维取向会产生各向异性的生物力学行为,沿着优选纤维方向及小肠纵轴具有更大的强度和弹性模量[2]。
2 SIS的特性
2.1 SIS的力学特性
SIS的缝合强度适合修复软组织缺损,但对于高应力环境还是不够[6]。SIS的机械性能取决于供体年龄,3周龄动物SIS的强度和弹性模量小于26周龄动物SIS,而52周龄以上动物SIS的弹性模量下降[7]。相关研究认为增加SIS的层数可以提高SIS的力学性能,将1层、2层、3层和4层干燥SIS的机械性能进行比较,发现机械强度与缝合强度随层数增加而增加;但是,随着层数的增加,SIS材料的弹性模量差别不大,表明其具有相似的材料应力应变特性[8]。与干法测试相比,湿法所测机械强度、弹性模量的峰值都较低,尤其一层SIS显著低于多层SIS,而多层SIS之间没有显著差异[8]。在湿润状态下,伸长率与层数成反比,单层SIS伸长率最大,约达130%,而多层SIS伸长率为30%~40%;随着层数增加,弹性模量也不断增加[8]。缝合强度,湿润状态比干燥状态更高,但都随着层数的增加而不断增加[8]。此外,也有相关学者提出将SIS进行交联改性,可以增加SIS的力学性能。
2.2 免疫原性
SIS已经在许多模型中成功地用作异种支架材料,而不产生免疫介导的炎症反应。Palmer等[9]使用体外产生人辅助性T细胞1(Th1)和Th2细胞的模型来研究SIS的影响,发现SIS以TGF -β依赖性的方式同时部分抑制了Th1细胞的扩增、白细胞介素12(IL -12)和干扰素γ(IFN-γ)的分泌,但是通过添加重组IL-12可以完全消除对Th1细胞扩增和IFN-γ分泌的抑制。SIS抑制Th细胞活化也包括诱导Th细胞凋亡。此外,SIS在体外完全抑制了Th2细胞的产生,但是SIS的这种作用并没有通过中和TGF -β抗体而消除。所以,在SIS中存在通过抑制IL-12分泌和诱导Th细胞凋亡来抑制Th细胞活化的因子,如TGF-β。
除此之外,SIS支架还可以诱导促再生反应,其主要机制在于mTOR / Rictor依赖的Th2细胞途径,该途径引导IL-4依赖的巨噬细胞极化,这对功能性肌肉恢复至关重要[10]。使用SIS支架激活适应性免疫系统可能会促进系统和局部再生免疫反应疗法的发生,最终刺激组织修复。而且,Sicari等[11]也曾提出受损骨骼肌的再生愈合反应取决于巨噬细胞的异质性细胞群体,这显示为从M1型巨噬细胞到激活并构建M2型巨噬细胞的表型转变。 SIS支架已经与M2型巨噬细胞以及建设性和功能性组织反应相关联。在体内使用SIS支架时,骨骼肌中巨噬细胞表型发生转变,同时相关的M2: M1比率提高。研究表明,在体外,来自ECM生物支架的降解产物促进巨噬细胞表型的交替激活和M2型巨噬细胞的极化,这反过来又促进骨骼肌祖细胞的迁移和骨骼肌的生成。此外,Keane 等[12]也指出ECM生物支架能够促进许多软组织的功能修复,其机制包括减少促炎巨噬细胞表型即M1型巨噬细胞并诱导激活内源性干细胞/祖细胞。
2.3 抗菌活性
SIS移植后观察到的感染现象,比其它移植材料更少[6]。SIS由于内含抗菌肽,而对革兰氏阳性和革兰氏阴性细菌具有抗菌活性[13]。将生物移植物与合成聚合物分别接种金黄色葡萄球菌后,植入大鼠慢性疝模型中进行修复治疗,结果显示生物支架能够以不同的速率清除细菌,而合成材料没有表现出这种特性[14]。而在另一项研究中虽然没有证实SIS和其他生物基质的抗微生物活性,但是观察到生物材料对生物膜形成的抗性比合成基质涤纶更强[15]。人类的一系列小植入手术显示,接受基于SIS的产品Surgisis进行手术治疗的患者,在术后两年的随访期内,没有一位患者发生手术创伤感染、移植排斥反应或其他并发症,甚至在感染或污染的疝修补或复杂腹壁创伤的部位都已经成功植入了Surgisis[16-17]。
3 SIS的加工方式
3.1 膜状材料
常见的SIS薄膜形式有两种,一种为水合状态,其商品如CuffPatchTM(见表1)。水合状态的ECM可以避免组织结构的改变,例如胶原纤维的相互塌陷,以及 ECM分子之间形成物理键[2]。所以,水合状态的SIS能够保持其原有的厚度,而冻干的SIS则厚度变薄。在整个脱细胞和灭菌过程中始终保持水合状态的生物支架,与经过脱水处理再水合的支架相比,前者体外支持细胞附着和细胞浸润的效果更好[18]。然而,水合材料的主要缺点是,可溶性生长因子(如VEGF和bFGF)在包装和贮存期间从材料中持续浸出[5]。
另一种为脱水SIS薄片,其商品如Durasis®、Oasis®、RestoreTM、Stratasis®、Surgisis®等(见表1)。生物支架通常在终端消毒前通过冻干(冷冻干燥)或真空压制脱水。脱水使支架更容易处理,同时限制储存过程中生长因子的损失。冻干是一种使水在低温低压下升华进而从材料中除去的方法。尽管冻干在不引起强度值显著变化的情况下可以延长ECM支架的保存期限,但它可能改变胶原纤维形态与体外细胞在材料上的生长[18]。冻干可以显著降低支架的厚度(通常约为30%),导致纤维形态更加致密,与冻干前相比,重新吸收相同量的水的能力更弱,可能是因为组织内糖胺聚糖受到了破坏[2,19-20]。
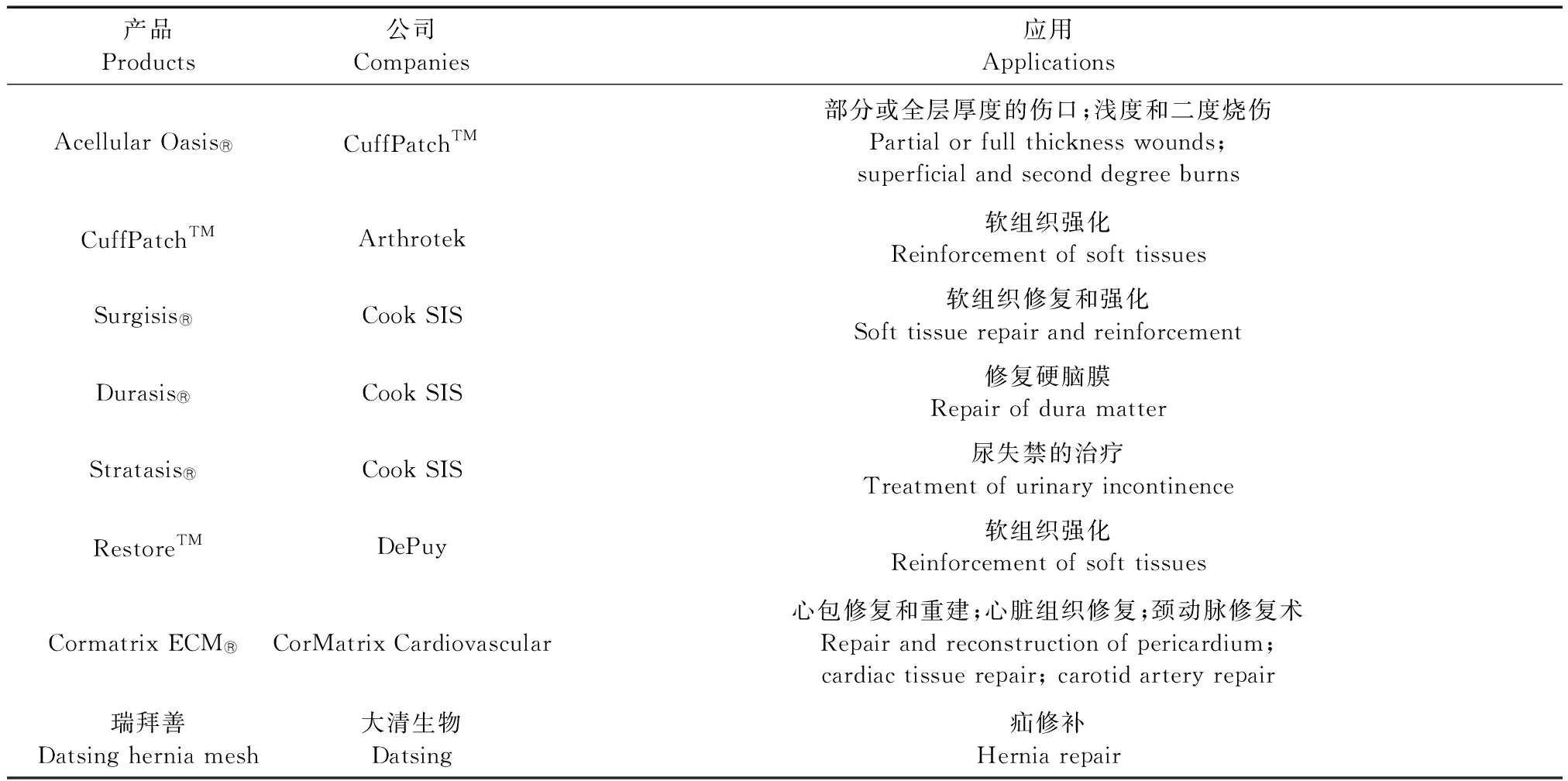
表1 目前可用的猪SIS产品的部分列表
3.2 粉末材料
冻干的SIS可以粉碎成SIS粉末或颗粒形式,这种形式可以通过微创技术(例如针头注射)将SIS作为混悬液递送到手术部位,或通过压实法制作三维支架[21]。粉碎的SIS保留了SIS原有的超微三维表面特性,颗粒直径大小为50 ~200 μm,可以反复粉碎[2]。粉末形式的SIS支架也可以用于局部递送,或可与合成聚合物组合创建混合支架。由于这种颗粒形式,不期望SIS材料起到承重作用。所以,SIS的物理特性,例如颗粒尺寸、表面积和载体液体的类型,是影响材料输送到预定部位简便性的因素。
3.3 凝胶材料
将 SIS 制备成粉末,再进一步交联改性制备成凝胶形式,使其具有三维多孔结构,这种形式的SIS便于临床使用,经过微创手术将SIS注射到手术部位。凝胶的粘度要确保能够通过小口径的针头进行注射,同时在加工处理过程中需要保留SIS的生物导电特性[2]。ECM的液体或凝胶形式通过微创方法将材料递送至手术部位,从而进一步扩大ECM支架的临床应用。换句话说,凝胶形式与凝胶前液态的颗粒悬浮液相比,凝胶更容易输送到手术部位。溶解的ECM可以通过导管或基于针管的外科技术来递送到形状不规则的解剖部位,凝胶形式也可以作为细胞递送载体,凝胶的流变特性也可以设计成与修复组织相似[2]。理想的凝胶处理方法将尽量减少或避免一些纯化步骤,这些步骤可能会移除或破坏天然ECM中具有活性的生长因子和小分子肽,因此,凝胶形式将保留原ECM支架的天然生物活性。相关研究显示,SIS凝胶进行体外培养各种细胞都能够支持它们的生长和分化,但这种凝胶形式的制备需要严格的胶原蛋白纯化过程,这可能导致生物活性分子丧失[22]。
3.4 复合材料
通过有机材料对SIS的修饰,提升了SIS的一致性并降低了其异质性。Mondalek等[23]在SIS中负载聚(乳酸-共-乙醇酸)纳米颗粒,使SIS微观结构天然存在的不均匀性及孔隙率得到了改善。这种修饰不仅没有改变SIS的机械性能,还促进了人乳腺内皮细胞的生长。由PLGA和SIS组成的混合支架显示出优于单独使用SIS海绵的机械性能,并促进了比纯PGLA支架更好的细胞粘附和更高的ECM产生[24]。与未修饰的SIS相比,透明质酸-聚(乳酸-共-乙醇酸)修饰的SIS在鸡胚绒毛尿囊膜分析中显示新生血管形成增强,随后在犬的半膀胱切除模型中显示更高的血管向内生长[25-26]。
3.5 SIS加工的病毒灭活方式
SIS来源于哺乳动物的肠道组织,肠道内含有大量细菌、病毒等微生物,SIS经过机械处理以及一系列化学、酶处理后,再经过病毒灭活处理可确保SIS的应用安全性。Hodde等[27]将大约1×107猪细小病毒、猪呼肠孤病毒、鼠白血病逆转录病毒和猪伪狂犬病病毒等病毒接种小肠样品,然后将其暴露于0.18%过乙酸/ 4.8%含水乙醇混合物中5 min至2 h。结果发现处理30 min后所有病毒均被灭活,表明用过氧乙酸/乙醇溶液处理后的猪小肠用于人体异种移植是一种无病毒且安全的生物材料。
4 SIS的应用
4.1 心血管系统
由SIS制备出的商品CorMatrix®,已经成为心血管手术中应用最广泛的生物医疗产品[28]。SIS用作培养新生大鼠心脏细胞的基质,附着在SIS表面的心肌细胞表现出定向收缩[6],有学者通过将来源于新生大鼠心肌细胞堆叠到心肌细胞种植的SIS上,成功构建出800 μm厚的心脏。Crapo等[29]用SIS凝胶和基质凝胶分别与新生大鼠心脏细胞结合来构建心脏结构,观察到由SIS凝胶制成的构建体与基质凝胶相比具有更高的收缩率和更高的心脏表型蛋白表达。除此之外,Sündermann等[30]在广泛的左心房粘液瘤、右心房平滑肌肉瘤或恶性黑色素瘤右心房转移的治疗中,也对脱细胞SIS生物材料在肿瘤切除引起的心肌损伤修复中的功效进行了研究,结果显示SIS对于心脏组织的治疗效果显著,重建容易成功,且利于止血。同时,Peng等[31]通过在SIS上培养来源于毛囊间充质干细胞的平滑肌细胞并结合机械刺激,也构建出了一种机械性能强且具有生物学功能的血管介质。
4.2 被皮系统
Lindberg等[32]在SIS的相对两侧同时培养成纤维细胞和人原代角质细胞或人表皮细胞,形成两种细胞类型的独特空间环境。当复合物培养上浮到气液界面时,成纤维细胞迁入SIS,而角质细胞或表皮细胞则形成了表皮结构,同时还检测到了基底膜蛋白沉积,所以,这种复合物可用作真皮替代物。尽管上述方法在体外和部分动物模型中非常成功,但这些体外工程构建体都没有被移植到人体内。这些方法的另一个局限是多层三维结构超过了特定的尺寸,会导致细胞营养不足。目前,组织工程扩散过程的成功应用仅限于厚度小于2 mm的组织[6],因为氧气和葡萄糖在细胞这种实心球体中的扩散距离仅限于100 ~150 μm。除此之外,在对120例慢性腿部溃疡患者使用Oasis®进行的临床试验中,12周内,标准治疗组治愈率为35%,而用这种产品的治疗组显示出完全治愈率为60%[33]。而且,六个月的随访结果显示,在接受SIS治疗的患者中没有复发溃疡,说明SIS产品在治疗慢性伤口时可以独立使用。
4.3 消化系统
Lopes等[34]早期使用啮齿动物模型进行的研究显示,SIS 生物支架植入食管缺损处,观察到有复层鳞状上皮和完全再生肌肉纤维形成,没有观察到瘘管或明显狭窄的迹象。而且Badylak等[35]对5名食管损伤患者进行内窥镜下食管的长段、环行粘膜和黏膜下层套管切除,并在切除组织部位放置管状SIS移植物进行治疗,随访15至35个月观察发现食管黏膜恢复正常,没有顽固性狭窄形成,更重要的是,没有发生肿瘤复发。以上两项研究说明使用SIS进行食管缺损治疗是可能的,且效果良好。临床前研究表明,SIS生物补片可用于修补胃壁缺损[36-37]。将SIS生物补片植入啮齿动物胃中修补全厚缺损,植入12个月后,可见平滑肌细胞、周围神经细胞和胃壁细胞出现,这表明SIS支架有促进胃部肌肉组织的生理和位点特异性再生的潜力,同时伴随内在神经细胞的迁移[35,38]。
2017年,Keane等[11]通过灌肠方式递送SIS水凝胶粘附于结肠组织,结果显示疾病的临床和组织学体征显著减少,同时应用SIS水凝胶还显示结肠上皮屏障功能的恢复和促炎巨噬细胞表型的减轻。不仅如此,植入SIS还有助于新肠的形成。2013年,Patil等[39]报道了通过灌注反应器将人骨髓干细胞种植在SIS支架上,结果形成了完整的黏膜、绒毛和含有杯状细胞的隐窝,以及衬有内皮细胞的血管。2016年,Schweinlin等[40]也报道了来自健康人小肠含有上皮细胞和祖细胞的肠隐窝作为肠道器官样物质被扩大,并在标准化迁移小室样环境下作为单细胞接种在SIS上,与成纤维细胞共培养7 d后,细胞形成完整稳定的上皮组织,一些细胞分化为杯状细胞、潘氏细胞、肠内分泌细胞和肠细胞。随后,Hussey等[41]也报道了将管状SIS移植物以隔离回肠袢式进行双侧吻合插入手术,12周时观察显示移植物的腔表面完全被黏膜层覆盖,24周时形成了由黏膜层、黏膜下层、外部肌肉层和浆膜层组成的新肠。新肠表现出典型的具有柱状细胞层的小肠形态,与Schweinlin等[40]报道一致,但是没有检查新肠的吸收和代谢功能。以上实验研究表明,在体外构建组织工程小肠是有望成功的。
4.4 泌尿生殖系统
早期对猪输尿管的研究显示,在切除左输尿管上三分之二的边缘后,用SIS替代7 cm的输尿管段,7周后解剖的8只猪模型中发现了由胶原蛋白和平滑肌组成的血管,没有出现吻合口狭窄、输尿管狭窄或炎症的现象[42]。对照组为对侧输尿管,行输尿管切开术,在7周时没有上皮再生的现象,且所有对照组都有输尿管狭窄的现象。体外工程使用SIS替代膀胱也已经在各种物种中进行了研究。SIS表面可建立由人、猪或狗组织衍生的原代膀胱平滑肌细胞(BSMC)和尿路上皮细胞组成的双层细胞系统,同时提供体内机械支持[43-45]。通过补充生长因子并机械刺激BSMC种植的SIS产生膀胱壁替代物,如bFGF-2和VEGF的加入能够促进BSMC在SIS的向内生长,随后的机械拉伸能增加BSMC沉积弹性蛋白的量[46]。此外,在其天然脱细胞状态下,SIS支架可以修复小的尿道缺陷,当在体内植入前用各种细胞类型接种SIS时,可以修复较大的尿道缺陷。
5 结语
SIS由于其优越的生物相容性,用于修复组织时既无瘢痕组织形成,也不会出现钙化现象,因此在临床应用中得到了广泛的应用,是目前应用最为成功的动物来源的生物材料之一。未来对于SIS的研究和应用,以下几个方面需要重点关注:一是SIS来自具有高生物变异性的哺乳动物,为保证SIS的产品质量和稳定性,需要建立关于SIS供体猪质量标准,进行生产制备和功能质量控制的标准化研究,二是重视SIS的仿生研究及其与其他材料的复合研究,以克服SIS在体内降解较快,难以适应某些需要长时间植入修复的临床需求问题;三是加强和新兴研究领域的结合,如在细胞治疗方面,开展SIS这种天然ECM作为细胞递送和培养的载体的研究,有望为细胞提供更理想的微环境,发挥更好的作用。
