妊娠糖尿病母鼠胎儿心脏组织CD4+T细胞水平表达及相关机制研究
2019-09-03万雪超卢秋芬何玉玲
万雪超,卢秋芬,何玉玲,方 艳
(贵州省铜仁市人民医院,贵州 铜仁 554300)
妊娠糖尿病(gestational diabetes mellitus,GDM)发病率呈逐年上升的趋势,研究发现妊娠期高血糖可导致胎儿各种先天畸形,如导致心血管畸形和神经系统畸形的几率是正常妊娠的3~5倍[1]。GDM引起子代心肌微结构异常的比例明显增多[2]。CD4+CD25+T细胞作为部分高表达IL-2受体α链分子的CD4+T细胞,其表达水平降低与病毒性心肌炎、心力衰竭、冠心病等多种心脏疾病的发生发展密切相关,Tregs的激活具有抑制CD4+T细胞介导的炎症反应以及免疫细胞杀伤功能[3-5];炎症状态下, CD4+细胞亚群中Th2细胞(分泌IL-4)及Th17细胞(分泌IL-17)表达失衡。研究发现[6],程序性凋亡分子-1(PD-1)及免疫球蛋白黏蛋白结构域相关分子3(Tim-3)对CD4+CD25+Treg 细胞具有调节作用,且介导CD4+T细胞所产生的炎症反应。2型糖尿病存在明显的免疫功能下降,而CD4+CD25+T细胞水平下降参与了2型糖尿病的发生发展, CD4+CD25+Treg细胞及IL-4高表达有助于机体胰岛功能的保护[7]。需要指出的是,在妊娠高血糖状态下CD4+T细胞水平表达是否存在差异,妊娠糖尿病母鼠胎鼠心脏功能异常是否与CD4+T细胞水平有关,值得研究报道。
miRNAs是真核生物钟较为常见的一类内源性具有基因或蛋白调控作用的非编码RNA,其具有调控糖尿病及其并发症发生发展的作用。通过现有文献以及课题组前期研究显示,糖尿病患者存在多种miRNAs表达差异。其中,miR-223-3p在2型糖尿病及其并发症中呈显著低表达[8];miR-223-3p除了参与血糖代谢以外,还参与动脉粥样硬化病变,其在冠心病机体表达量显著降低[9];在烟曲霉诱导的CD4+细胞中,miR-223-3p低表达致多种炎性因子呈高表达状态[10]。但需要指出的是,miR-223-3p是否参与GDM的发生以及其对GDM子代心脏功能是否有影响,miR-223-3p是否具有调节CD4+T细胞及其介导的炎症反应,进而导致GDM子代心脏功能异常是值得进一步深入研究的。
本研究目的主要在于探讨GDM胎鼠心脏组织中miR-223-3p表达情况,以及其对CD4+T细胞表达水平与其介导的炎症因子释放的影响,以期为临床有效预防及治疗GDM子代心脏功能异常提供理论依据。
1 材料和方法
1.1 实验动物
清洁级SD大鼠(采购于广东省实验动物中心,[SCXK(粤)2018-0027],雌、雄性分别为100只、50只(雌性250~290 g,雄性270~300 g)。动物饲养于恒温(25℃左右)、相对湿度在40%~70%、安静的动物房中。实验期间所有动物均正常进食、饮水,不给予胰岛素以及其他任何降糖药物。所有动物实验均经伦理委员会审查(动物伦理审查号:201803033)。
1.2 实验方法
1.2.1 模型建立
实验前大鼠自由进食饲料,每天维持12 h灯光照明,每隔一天更换垫料一次,记录体质量以及血糖含量(血糖含量在7 mmol/L者剔除)。参照国外Rees等[11]的造模方法复制GDM模型,具体方法为:受试动物按照雌雄2∶1的比例进行合笼,次日早晨5:00检查阴栓,查到有阴栓则定为交配成功,并记为妊娠0 d。将妊娠成功的84只母鼠进行编号,随机分为模型组(链脲佐菌素streptozotocin, STZ组,n=42只)和正常对照组(NC组,n=42只)。其中STZ组孕鼠于确定受精后的12 h后,注射含量为45 mg/kg的STZ(溶于柠檬酸-柠檬酸钠缓冲液中),NC组注射相应体积的柠檬酸-柠檬酸钠缓冲液。注射72 h后即妊娠第4天,经眼眶取血,离心分离血清测定空腹血糖含量在11.1 mmol/L,随机血糖在17.9 mmol/L,尿糖 >++,表明为妊娠糖尿病,即造模成功。
1.2.2 心脏标本组织收集及处理
所有孕鼠均于妊娠第20天麻醉,剖腹取出子宫,观察胎鼠的个数(是否存在死胎、吸收胎等),将胎鼠置于天平上称重并观察是否存在其他畸形情况。取出每只孕鼠中所有子鼠心脏组织一并称重,洗净后按照心脏组织每5.00 mg置于液氮中保存,用于RT-PCR检测以及相关蛋白检测用。剩余心脏组织用于HE染色及免疫组化病理学检查。
1.2.3 免疫组化检测胎鼠心脏组织中CD4+CD25+Treg 细胞表达
采用福州迈新生物技术开发有限公司提供的两步法检测CD4+CD25+Treg细胞表达情况。具体操作步骤为:将切好的标本置于60℃烤箱中1 h,石蜡切片经常规脱蜡、水化、蒸馏水冲洗3次,每次冲3 min,取800 mL柠檬酸缓冲液于压力锅中,加热至沸腾,将经水化后的组织放置于耐高温塑料架上,并置于沸腾的柠檬酸缓冲液中1.5 min,取出后自然冷却至室温,采用PBS冲洗3次,每次冲洗3 min;将切片浸入3% H2O2溶液中,室温放置20 min后取出,采用PBS冲洗3次,每次3 min,加入一抗(兔抗人CD4+CD25+Treg多克隆抗体,体积比1∶500,购自美国Stana公司)室温孵育1.5 h;收集一抗后,采用PBS冲洗3次,每次3 min,用滤纸轻轻吸干PBS后加入二抗(过氧化物酶标记的山羊抗兔IgG,体积比为1∶1000)室温孵育1 h,PBS冲洗3次,每次3 min;加入DAB显色剂,苏木素复染,切片经梯度酒精脱水干燥,二甲苯透明,中性胶固定,显微镜下观察。以细胞膜以及细胞浆中出现棕黄色信号为阳性细胞。
1.2.4 胎鼠心脏组织中miR-233-3p表达
采用实时荧光定量PCE法,以NAPDH作为内参,检测胎鼠心脏组织中miR-233-3p表达情况。采用Trizol法提取胎鼠心脏组织中总RNA,逆转录为cDNA,取2 μL用于PCR反应,反应体系为25 μL,miR-233-3p正向引物:5’-GTCATTGTTGA GTGCTCGTAACGC-3’,反向引物:5’-CGTGGT CGGTCGGTAAACGCGTCG-3’;NAPDH正向引物:5’-CAGGAGGTTAGTGCTACGTATGCTTGC-3’,反向引物:5’-CAAGGCTGCGTGCGGTCTCGA-3’。反应条件为95℃预变性 1 min,94℃变性15 s,延伸72℃ 25 s,退火65℃ 30 s,共40个循环;NAPDH退火条件为60℃ 20 s,其他同上。采用2-ΔΔCT法进行数据的相对定量分析。
1.2.5 Western blotting检测组织中IL-17、IL-4、Tim-3及PD-1表达
取胎鼠心脏组织约100 mg置于匀浆器中,并加入蛋白酶抑制剂的裂解液 500 μL在冰上进行裂解。按照试剂盒说明要求提取蛋白,加入5× SDS上样缓冲液煮沸7~8 min,经电泳、转膜,脱脂奶粉封闭、洗膜加入一抗、室温孵育4℃封闭过夜;TBST洗膜3次,加入二抗。将化学荧光发光底物均匀地加到膜的表面,置于曝光试剂盒中曝光,显影、定影等,采用凝胶图像处理系统分析条带灰度值。
1.3 统计学方法

2 结果
2.1 一般情况分析
GDM组母鼠平均血糖值(17.36±0.62)mmol/L高于NC组母鼠(5.81±0.57)mmol/L且差异有统计学意义(P<0.01)。GDM组子鼠吸收胎、死胎、畸形胎例数高于NC组,差异有统计学意义。(表1)
2.2 各组胎鼠心脏组织病理变化
通过HE染色显示,GDM组与NC组比较,心肌组织增厚明显,高倍镜下可见GDM组心肌纤维排列稀疏,心肌显微断裂,心肌细胞肿胀,细胞核肥大或固缩,而NC组袭击细胞排列整齐、致密,心肌显微无断裂,细胞核染色清晰。(图1)
2.3 免疫组化检测CD4+CD25+Treg细胞表达情况
采用免疫组化检测显示,GDM组CD4+CD25+Treg CD4+CD25+Treg阳性细胞表达数量[(46.41±10.94)%]低于NC组[(21.63±10.94)%],差异有统计学意义(P<0.05)。(图2)
2.4 RT-PCR检测组织中miR-233-3p表达
采用RT-PCR检测组织中miR-233-3p表达,结果显示,GDM组miR-233-3p相对表达量(0.682±0.104)低于NC组(0.466±0.117),差异有统计学意义(P<0.01)。(图3)

表1 两组胎鼠畸形胎比率比较(n=42,%)
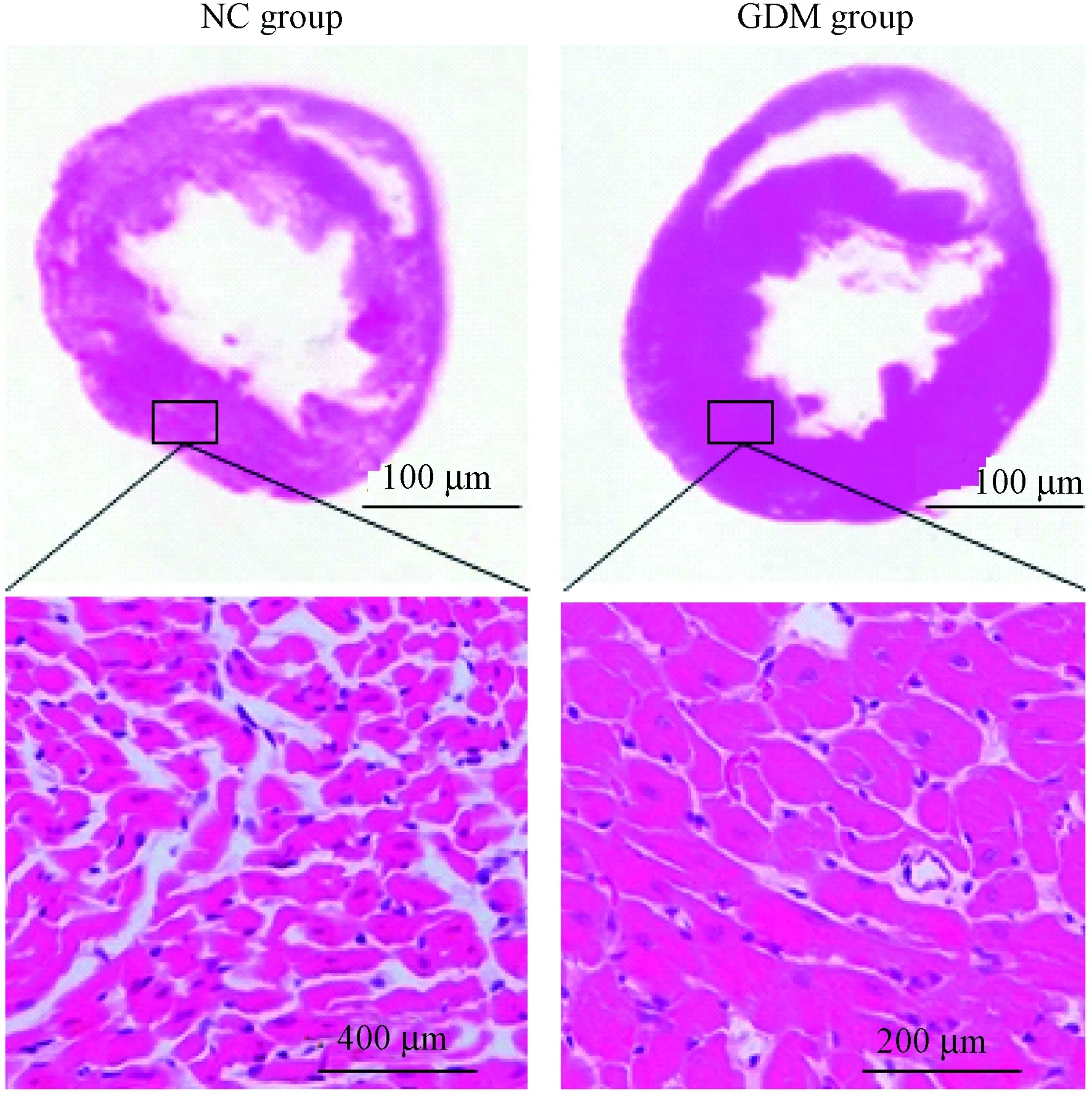
图1 心脏组织的病理学改变。HE染色。Figure 1 Histological changes in the heart tissues of fetal rats. HE staining.

图2 免疫组化检测胎鼠心脏组织中CD4+ T细胞表达Figure 2 CD4+ T cells in the fetal rat heart tissues. Immunohistochemical staining.
2.5 Western blotting检测IL-17、IL-4、Tim-3及PD-1表达

图3 RT-PCR检测胎鼠心脏组织中miR-233-3p表达Figure 3 Detection of miR-233-3p expression in fetal rat heart tissues by RT-PCR
采用Western blotting检测分析显示,GDM组IL-17、Tim-3及PD-1表达量均高于NC组,而IL-4显著低于NC组,差异有统计学意义(P<0.05或P<0.01)(图4)。
3 讨论
GDM可导致胎儿发育异常,尤其是导致胎儿心脏畸形的发生率明显增高。研究显示[12],GDM孕妇中胎儿心血管畸形发生率是正常孕妇的3~5倍,但高血糖或糖尿病导致胚胎发育畸形的机制研究尚不明确。有研究认为[13],高血糖或GDM与细胞免疫功能失衡有关,高血糖与CD4+细胞表达降低显著相关,研究发现[14],糖尿病患者CD4+CD25+Treg细胞比例显著低于健康人员,且与糖化血红蛋白呈负相关;通过胰岛素治疗或降血糖药物治疗,患者血清中CD4+CD25+Treg细胞水平及IL-4等显著升高。CD4+CD25+Treg作为CD4+T细胞特有的一个亚群,其表达量降低导致多种心脏疾病,如冠心病,病毒性心肌炎、慢性心力衰竭等疾病的发生发展;以上表明血糖升高与机体免疫功能紊乱存在显著相关性,而免疫功能紊乱是诱发多种心脏疾病的重要原因。通过本研究,发现GDM组胎鼠心脏组织中CD4+CD25+Treg表达量显著低于NC组,提示妊娠高血糖引起的免疫功能紊乱,可能导致胎儿心脏发育不良。

图4 Western blotting检测两组胎鼠心脏组织中PD-1、Tim-3、IL-4、IL-17表达情况Figure 4 Western blotting detection of PD-1, Tim-3, IL-4, IL-17 expressions in the fetal rat heart tissues
CD4+T细胞介导多种炎性因子参与糖尿病、心肌重构、心肌炎等疾病的发生发展。不同的CD4+T细胞亚群发挥不同的作用,促炎性Th细胞亚群包括Thl、Thl7等比例上调或功能亢进,而抗炎性的Th2、Treg等比例下降或功能受损是促发慢性炎症状态的直接因素[15]。血糖增高可导致巨噬细胞吞噬功能下降、Th1/Th2比例失调、细胞因子表达异常等。研究发现[16],在血管紧张素Ⅱ诱导的高血压大鼠模型中,当灌注血管紧张素Ⅱ后Th2型细胞因子IL-4的数量明显下降,而Th1型细胞因子IFN-γ明显增高,表明Th1/Th2失衡参与了临床心血管事件的发生。Th17细胞主要参与介导慢性炎症、自身免疫性疾病以及肿瘤等疾病的发生,其特异性的分泌IL-17细胞因子,能够发挥较强的促炎症作用,参与诱导炎性细胞因子、趋化因子的表达[17]。那么, CD4+T细胞介导的炎症反应是否参与GDM子代心肌结构与功能异常,研究报道较少。通过本研究,相关人员发现GDM组胎儿心脏组织中IL-17表达量显著增高,而IL-4表达量显著降低,提示GDM胎儿存在明显的CD4+T细胞表达差异。
PD-1在多种疾病中发挥重要作用,其与程序性细胞死亡分子受体1(PD-L1)结合后组成PD-1/PD-L1信号通路,具有诱导T淋巴哦细胞的凋亡,抑制T细胞的活化与增殖。研究显示[18],在2型糖尿病患者血清中CD4+PD-1+细胞占比显著增高,而CD4+CD25+Treg细胞比例下降,提示在高血糖下, CD4+CD25+Treg细胞水平与PD-1表达呈负相关。在心房颤动、动脉粥样硬化等疾病中也显示[19-20],PD-1在CD4+细胞中呈高表达,且具有促进炎性细胞因子的释放作用。Tim3被研究证实特异性表达于Th1细胞,具有活化Th1细胞的作用。研究发现,在糖尿病肾病、先天性心脏病患者血清中Tim3呈高表达。但CD4+细胞中PD-1、Tim3表达是否与GDM胎鼠心脏结构和功能异常有关,是值得研究的。通过本研究,相关人员发现GDM胎鼠心脏组织中PD-1、Tim3均显著高于NC组,提示PD-1、Tim3高表达参与了GDM子代心脏组织结构功能异常的发生发展。
多项研究显示[21-22], microRNAs参与调解T淋巴细胞亚群表达,调控糖尿病及其并发症、心脏疾病的发生发展,对于GDM胎儿心脏组织存在哪些microRNAs表达差异值得研究。研究发现[23-24],miR-233-3p在缺血性心肌微血管内皮细胞中呈低表达,而且与糖尿病肾病严重程度呈负相关,糖尿病肾病严重程度越高,miR-233-3p表达量越低,以上提示miR-233-3p表达可能参与了糖尿病、心脏疾病的发生发展。另有研究发现,miR-CD4+T细胞中miR-233-3p低表达促进了Th17分化以及IL-17表达,进而诱导炎症级联反应。目前,miR-233-3p在GDM胎鼠中表达如何研究较少。通过本研究发现,GDM组胎儿心脏组织中miR-233-3p表达量显著低于NC组,提示GDM胎鼠心脏功能异常可能是与miR-233-3p表达小调,进而介导CD4+T细胞表达下降,导致多种炎性因子表达异常有关。
综上, GDM子鼠心脏结构与功能异常可能与CD4+T细胞表达下降有关,而这一作用机制可能与胎鼠心脏组织中miR-233-3p表达下调及其介导的炎症因子表达异常有关。
