葛根素对急性肝衰竭小鼠的治疗作用及其作用机制
2019-09-03刘英辉周东方金国华闫文昭
刘英辉,周东方,金国华,闫文昭,程 欣
(河北医科大学第三医院,石家庄 050000)
急性肝衰竭(acute liver failure, ALF)是可由多种原因引起的危重疾病,主要临床表现多为同时出现凝血机制障碍、黄疸、腹水等症候[1]。ALF具有隐匿性强、发病迅速等特点,虽然发病率较低,然而目前尚缺乏特异性的治疗措施,致死率很高,引起医学界的广泛关注[2]。ALF发病机制复杂,其病理基础是肝脏细胞在短时间内大量死亡,导致肝脏合成、解毒、转化等能力发生功能性障碍或失代偿[3]。研究表明,在细胞凋亡过程中,磷脂酰肌醇3激酶蛋白激酶B(PI3K/Akt)信号通路对相关蛋白的调节发挥关键作用,可将膜受体信号传递至细胞内,来实现维持细胞增殖和抑制细胞凋亡过程[4]。作为Akt的底物,糖原合成酶激酶-3β(GSK-3β)是调节细胞凋亡的关键元件[5]。葛根作为我国传统名贵的中草药,具有多种活性成分,其中葛根素除具有提高免疫、增强心肌收缩力,保护心肌细胞,降血压等作用外,对肝损伤的保护作用也已广泛报道[6]。但葛根素(puerarin,Pue)对D-氨基半乳糖所致的急性肝衰竭小鼠肝脏的保护作用机制,目前尚鲜见报道。因此本研究采用D-氨基半乳糖诱导急性肝衰竭小鼠模型,探讨葛根素对肝脏的保护作用,同时分析其对PI3K/Akt/GSK-3β信号通路的调控作用,为进一步研究相关机制提供相应的实验基础。
1.1 实验动物
SPF级成年雄性昆明小鼠50只,体重在(20±5)g,购自北京维通利华实验动物技术有限公司 [SCXK(京)2011-0011],所有动物均在本实验室SPF级动物房饲养[SYXK(冀)2015-0042]。动物的使用及操作按照本院动物管理委员会(IACUC2017-002) 的规定执行。实验过程中遵守3R原则。
1.2 主要试剂与仪器
葛根素(批号:070319812,纯度> 98%)购自昆明制药厂,用前以生理盐水稀释(pH 7.0),根据体重计算给药体积,4℃保存;丙二醛(malondialdehyde,MDA)(批号:SGA103),超氧化物歧化酶(superoxide dismutase,SOD)(批号:SE103)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)(批号:SA625)试剂盒购自北京索莱宝科技有限公司;丙氨酸氨基转移酶(alanine aminotransfease,,ALT)(批号:2017030928),天门冬氨酸基转移酶(aspartate aminotransferase,AST)(批号:2017110812),总胆红素(total bilirubin,TBil)(批号:2017210612),试剂盒购自上海瀚鸿化工科技有限公司;TUNEL试剂盒(批号:C503028)购自德国罗氏公司;LY294002(批号:BE28491)购自瀚香生物科技有限公司;D-氨基半乳糖(批号:AP1062)购自美国 Sigma 公司,BCA蛋白浓度检测试剂盒(20170212)、DAB化学发光试剂盒(批号:D29183874)、P-Akt(批号:E289180)、P-GSK-3β (批号:A1209300)、cleaved caspase-3 (批号:A1805603) 抗体均购自上海仁捷生物科技有限公司。万濠VTM-4030光学显微镜,上海长岛生物技术有限公司AVDIA2400全自动生化反应仪检。
1.3 实验方法
1.3.1 动物分组及模型制备
将50只昆明小鼠适应性饲养7 d后随机分为5组,每组10只:(1)正常对照组;(2)模型组;(3)Pue组(300 mg/kg);(4)P13 K特异性抑制剂LY294002组(LY,10 mg/kg);(5)Pue(300 mg/kg)联合LY294002(10 mg/kg)组(Pue+LY组)。Pue组、LY组及Pue+LY组造模前根据实验设计需要给予相应药物,每日1次,连续给药两周,给药方式为尾部静脉注射,正常对照组和模型对照组均以同样方式注射等量无菌生理盐水。末次给药后禁食24 h,除正常组外,其他组腹腔注射10% D-氨基半乳糖(1.2 mL /100 g)造模,正常对照组注射等量生理盐水。
1.3.2 血清及肝脏生化指标检测
建模后8 h,采集各组小鼠静脉血,引颈处死小鼠后固定,沿腹中线切开腹壁,暴露腹腔组织,小心分离肝脏。常规分离静脉血血清,4 h内采用全自动生化反应仪检测小鼠ALT、AST、TBil、Alb肝功能指标。准确称量部分肝脏组织,加入预冷的PBS缓冲液制成 10% 匀浆,4℃下4000 r/min离心10 min,取上清依据SOD、GSH-Px和MDA检测试剂盒说明书所示的操作方法进行测定,并计算每克肝组织中的活性或含量。
1.3.3 HE染色观察小鼠肝脏组织形态变化
切取部分肝脏右叶,采用4%的甲醛固定24 h后进行常规脱水和石蜡包埋,将小鼠肝脏组织石蜡块切成5 μm厚度的切片,进行HE 染色,光学显微镜下观察组织学改变。
1.3.4 TUNEL 法检测肝脏细胞凋亡
取小鼠部分肝脏组织切片按试剂盒步骤进行TUNEL染色。主要步骤为切片脱蜡水化后,蛋白酶 K(10 mmol/L)处理 20 min,PBS 清洗 5 min×3 次,将载玻片浸入 TUNEL 反应混合物在37℃下避光温育60 min,PBS 清洗5 min×3 次;在 37℃ 下,用 POD 反应液避光温育30 min;PBS 清洗 5 min×3 次;滴加 DAB 底物溶液显色,室温孵育 10 min,乙醇梯度脱水,二甲苯透明,中性树脂封片,光学显微镜下观察肝细胞凋亡情况。以显示蓝色的核染色为正常细胞,细胞核中有棕黄色颗粒为阳性细胞(凋亡细胞)。凋亡细胞所占百分比(凋亡率):每只小鼠取 4 张切片,每张切片在200 倍视野下随机选取 3 个不重叠视野,每个视野计数阳性细胞占总细胞的比例,取平均值即为细胞凋亡率。
1.3.5 Western blot法检测肝脏组织中P-Akt、P-GSK-3β、cleaved caspase-3表达的影响
取小鼠部分肝脏组织加入RIPA组织裂解液中匀浆器打碎,冰浴5 min后离心,离心条件:13000 r/min,4℃,时间10 min,获得上清,BCA蛋白定量试剂盒进行上清中蛋白浓度的定量检测,用2×电泳缓冲液稀释蛋白至相同浓度。10%的聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,用Tris/甘氨酸缓冲液将蛋白转移至PVDF膜上,5% TBST液中室温封闭2 h,将PVDF膜放入相应一抗稀释液(均为1∶1000)中孵育,4℃过夜。次日,将膜取出,TBST液洗涤10 min,加入辣根过氧化物酶标记的山羊抗兔IgG二抗稀释液(均为1∶10 000),室温孵育2 h,加入DAB发光液,凝胶成像仪下读取读取灰度值,以GAPDH作为内参,计算目的蛋白相对表达水平。
1.4 统计学方法

2 结果
2.1 葛根素对ALF小鼠肝功能的影响
血清 ALT、AST、Tbil水平是临床反映肝细胞损伤和坏死程度的敏感指标,与正常对照组相比,模型组小鼠ALT、AST、Tbil指标明显升高,差异有统计学意义(P< 0.05),经Pue预处理后,与模型组相比,Pue组肝功能指标出现明显下降,差异有统计学意义(P< 0.05),LY组、Pue+LY组与模型组相比组间差异无统计学意义(P>0.05),结果见表1。
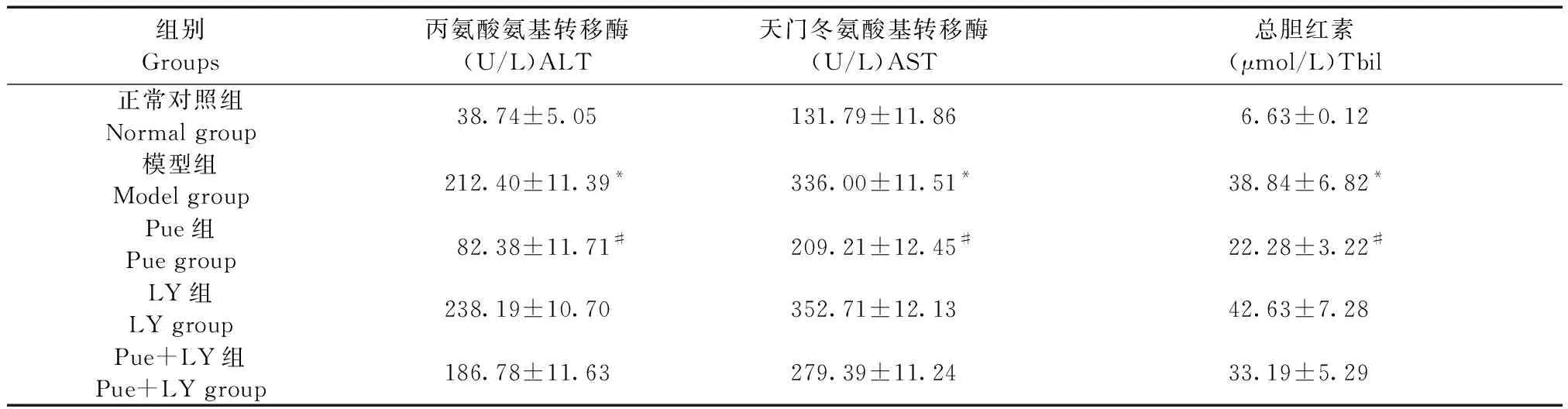
表1 葛根素对ALF小鼠肝功能的影响
注:与正常对照组相比,*P<0.05;与模型组相比,#P<0.05。
Note. Compared with the normal group,*P< 0.05. Compared with the model group,#P< 0.05.
2.2 葛根素对ALF小鼠肝脏病理的影响
HE 染色结果显示,正常对照组小鼠肝脏细胞结构完整,排列有序,细胞核体积较大,具有明确的核染色和正常的形态,并没有发生损伤坏死现象;模型组小鼠肝脏细胞变小、变圆,有小的、质密不规则的固缩核为死亡的肝脏细胞;Pue可明显减少肝脏细胞丢失,改善细胞异常形态;LY组、LY+Pue组小鼠肝脏病理结构与模型组相似。见图1。
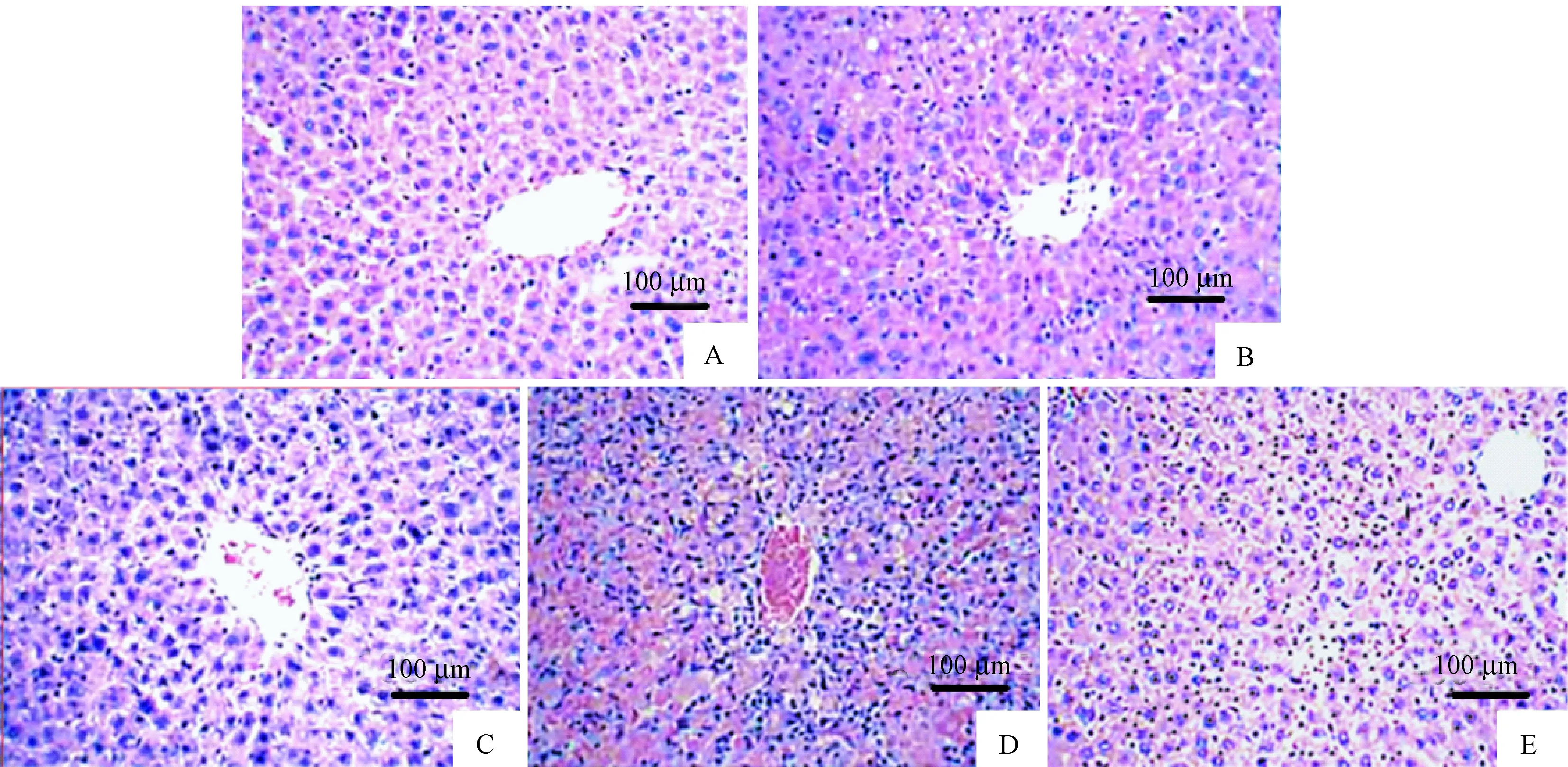
注:A:正常对照组,B:模型组,C:Pue组,D:LY组,E:Pue+LY组。图1 葛根素对ALF小鼠肝脏病理的影响(×200)Note. A, Normal group. B, model group. C, Pue group. D, LY group. E, Pue+LY group.Figure 1 Effects of puerarin on liver pathology of the ALF mice
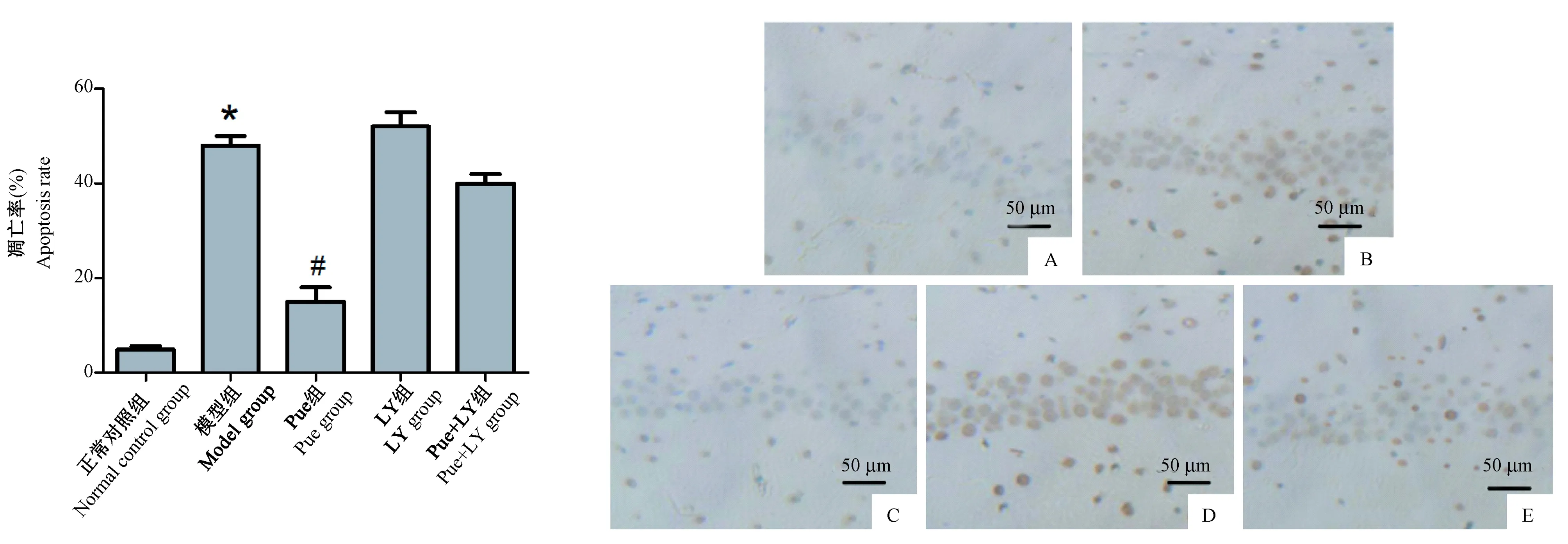
注:A:正常对照组,B:模型组,C:Pue组,D:LY组,E:Pue+LY组。与正常对照组相比,*P<0.05,与模型组相比,#P<0.05。图2 葛根素对ALF小鼠肝脏细胞凋亡的影响(TUNEL染色)Note. A, Normal group. B, Model group. C, Pue group. D, LY group. E, Pue+LY group. Compaed with the normal control group, *P< 0.05. Compared with the model group, # P< 0.05.Figure 2 Effect of puerarin on the hepatocyte apoptosis in ALF mice. TUNEL staining
2.3 葛根素ALF小鼠肝脏细胞凋亡的影响
ALF小鼠肝脏经过TUNEL法染色在光镜下观察呈棕色,如图2所示,正常对照组肝脏细胞并未出现明显凋亡现象,与正常对照组相比,模型组小鼠肝脏细胞出现严重凋亡,差异具有统计学意义(P<0.05);与模型组相比,Pue组小鼠肝脏细胞凋亡明显降低,差异具有统计学意义(P<0.05);LY组、Pue+LY组与模型组相比组间差异无统计学意义(P>0.05)。
2.4 葛根素对ALF小鼠肝脏组织中氧化应激的影响
SOD、GSH-Px和MDA作为机体氧化应激反应的代表物质,本研究检测了ALF小鼠肝脏组织中SOD、GSH-Px和MDA 的水平,结果显示和正常对照组相比,模型组中SOD、GSH-Px水平出现明显的降低,MDA水平明显的升高(P<0.05);与模型组相比,Pue组中SOD、GSH-Px水平出现明显的升高,MDA水平明显的降低(P<0.05);LY组、Pue+LY组小鼠肝脏组织SOD、GSH-Px和MDA 的水平与模型组相比,差异无具统计学意义(P>0.05)。见图3。
2.5 葛根素对ALF小鼠肝脏组织中P-Akt、P-GSK-3β及cleaved caspase-3表达的影响
为了进一步观察Pue对ALF小鼠模型肝脏的保护作用机制,本研究采用蛋白免疫印迹法检测了肝脏组织中Akt、GSK-3β和cleaved caspase-3蛋白磷酸化水平,结果显示与正常对照组相比,模型组中Akt、GSK-3β磷酸化水平明显下降(P<0.05),cleaved caspase-3明显升高(P<0.05);与模型组相比,Pue组小鼠肝组织中Akt、GSK-3β磷酸化明显升高,差异具有统计学意义(P<0.05),cleaved caspase-3明显下降(P<0.05),LY组、Pue+LY组与模型组相比组间差异无统计学意义(P>0.05)。见图4。
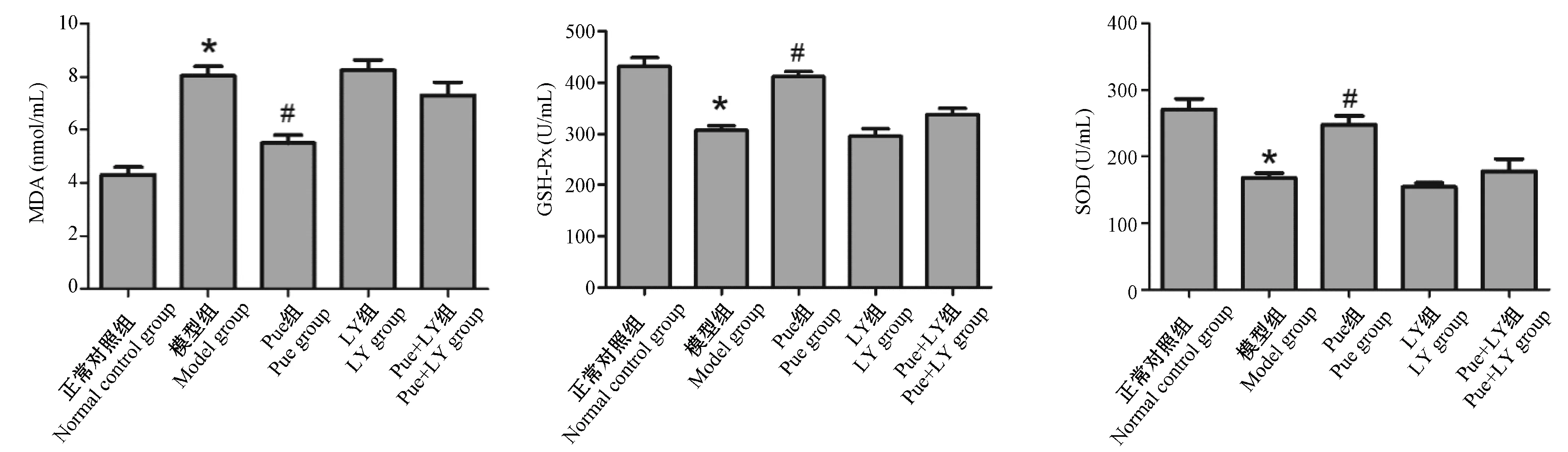
注:与正常对照组相比,*P<0.05,与模型组相比,#P<0.05。图3 葛根素对ALF小鼠肝脏组织中氧化应激的影响Note. Compared with the normal control group, *P< 0.05. Compared with the model group, #P < 0.05.Figure 3 Effect of puerarin on oxidative stress in the liver tissues of ALF mice
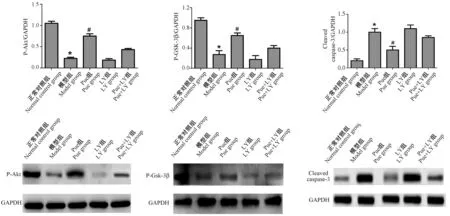
注:与正常对照组相比,*P<0.05,与模型组相比,#P<0.05。图4 Pue对ALF小鼠肝脏组织中P-Akt、P-GSK-3β、cleaved caspase-3表达的影响Note. Compared with the normal control group, *P < 0.05. Compared with the model group, #P < 0.05.Figure 4 Effects of Pue on the expression of p-akt, p-gsk-3 and cleaved caspase-3 in the liver tissues of ALF mice
3 讨论
ALF是以肝功能迅速恶化为临床特点的急性综合征[7]。患有慢性肝炎、肝纤维化等慢性肝病的患者可在劳累、饮酒、病毒感染等诱因下出现肝脏大面积死亡直至衰竭,其中以感染最为多见[8],治疗困难,给患者家庭造成沉重的负担。研究ALF疾病的发展规律、促进临床治疗及肝脏组织修复一直以来是科学界研究的热点之一。
现代药理学认为,Pue可以提高自身免疫力,降血脂等多种生物学功能[9],随着研究的深入,Pue对肝脏细胞损伤方面的研究逐渐增多。金若天等[10]采用透射电镜发现Pue预处理可以显著降低肝脏缺血再灌注损伤后大鼠肝细胞凋亡率。另有报道,通过研究Pue对葛根素对四氯化碳所诱导肝纤维化大鼠的肝脏的影响,发现Pue对于肝脏组织中caspase-9蛋白的表达具有显著的抑制作用,且通过TUNEL染色法发现肝脏细胞凋亡率明显减少,提示Pue对于多种原因引起的肝细胞凋亡起到保护作用[11]。本研究通过D-氨基半乳糖诱导ALF小鼠模型研究Pue的药理作用,发现模型组小鼠肝功能指标明显降低,且肝脏组织细胞凋亡数目增多。本研究根据预实验结果选择Pue给药浓度,结果表明,经过Pue预处理的小鼠与模型组相比,减轻D-氨基半乳糖对肝功能的损伤程度,肝细胞凋亡受到抑制,与既往研究结果一致。
细胞内经过一系类复杂的信号传递实现了机体生物学行为,PI3K/Akt信号通路通过胞内信号传递在细胞迁移、动员、分化和抗凋亡等细胞生存调节过程中发挥重要的作用,在近年来的研究中越来越受到重视[12]。LY294002是公认的PI3K抑制剂,可特异性抑制PI3K110亚基单元的活性,阻断PI3K介导的信号通路[13]。本研究中使用LY294002验证Pue对PI3K/Akt/GSK3β信号通路的调节保护D-氨基半乳糖诱导的ALF的作用机制,结果显示,Akt和GSK-3β磷酸化水平在Pue组与模型组相比大幅增加,而Pue+LY组较Pue组下降明显,LY294002逆转了Pue介导的Akt和GSK3β磷酸化水平,提示Pue可通过PI3K来实现Akt和GSK3β磷酸化进程。有研究表明[14],PI3K/Akt/GSK-3β信号通路抑制肝脏细胞的凋亡,同时在后期参与了其修复过程,从而对肝脏生理功能起到保护作用。与Pue组相比,Pue+LY组小鼠肝功能明显降低,且肝细胞凋亡的数量增加,提示Pue可能是通过调控PI3K/Akt/GSK-3β信号通路实现对肝细胞的保护作用。
天冬氨酸特异性半胱氨酸蛋白激酶家族(caspases) 在细胞凋亡过程中发挥重要作用,caspase可将自身底物水解传递至凋亡通路,引起蛋白酶级联反应导致细胞程序性死亡[15]。cleaved caspase-3是caspases 级联反应中下行的最关键蛋白酶,在凋亡程序中起到中枢作用[16]。本研究ALF小鼠经Pue预处理后检测cleaved caspase-3的表达,结果显示,cleaved caspase-3出现下调,提示Pue抑制D-氨基半乳糖诱导所致ALF小鼠肝细胞凋亡可能是通过下调cleaved caspase-3来实现的。与Pue组相比,Pue+LY组cleaved caspase-3表达明显增加,说明该作用机制与PI3K/Akt通路有关。
文献报道称[17],PI3K/Akt/GSK-3β信号通路可介导细胞发生氧化应激反应。Lee等[18]研究发现,随着GSK-3β磷酸化水平的升高,血清中SOD活性和 GSH/GSSG 的比值随之增高,同时MDA含量下降,通过GSK-3β抑制剂(TDZD-8) 处理后,抗氧化作用被明显逆转。而氧化应激在ALF的发生发展中发挥着关键作用[19]。肝脏组织在自由基的作用下发生脂质过氧化,生成MDA等物质,严重者会造成肝组织细胞的DNA损伤[20]。本研究中,模型组昆明小鼠肝脏组织因注射D-氨基半乳糖,其肝组织中SOD活性和 GSH-Px 含量明显降低,而MDA的含量明显上升,说明D-氨基半乳糖诱导的ALF模型小鼠机体内发生氧化应激反应,并对小鼠肝组织造成氧化性损伤。Pue组可以明显改善小鼠肝组织中SOD、GSH-Px和MDA水平,而LY组、Pue+LY组氧化应激指标与模型组相比差异无统计学意义(P>0.05),提示Pue会减轻D-氨基半乳糖诱导的ALF小鼠氧化应激状态而对肝脏起到保护作用,可能与GSK-3β信号通路有关。
综上所述,Pue可能通过激活PI3K/Akt信号通路,从而减轻肝功能的损伤程度,抑制肝脏细胞凋亡的发生,减轻机体氧化应激状态,发挥对D-氨基半乳糖诱导的ALF小鼠肝脏的保护作用。但Pue是否还能通过调节其他通路来影响疾病进程,仍需进一步的研究。
