金龙胶囊及其多糖、蛋白组分对人类脑胶质瘤小鼠原位模型的干预作用
2019-09-03解一舟李玉珍史英翔李宏强
解一舟,李玉珍,朱 慧,史英翔,金 剑,李宏强*
(1.北京建生药业有限公司,北京 100039; 2.郑州大学第三附属医院,郑州 450052)
脑胶质瘤是中枢神经系统最常见的恶性肿瘤之一,大量统计数据或研究资料表明,其发病率占全部颅内肿瘤的70%以上[1],其恶性程度高,患者的生存率极低[2],目前的常规治疗模式有手术切除、放疗及化疗[3],然而由于其浸润性生长的生物学特点[4],手术难以彻底清除,常规放、化疗的毒副反应也一直是困扰医疗界的难题[5],目前国内外还没有真正意义上的可以有效控制或治疗脑胶质瘤的方法[6],开发出高效低毒的创新型药物,无疑将会打破脑胶质瘤治疗的僵局[7]。中药具有多成分、多靶点、低毒性的特点[8],采用新鲜的中药治愈疾病作为一种独特的中医治疗方法在中国具有悠久的历史,随着科学技术的发展,新鲜的传统医药相继问世,这种鲜中药又称为现代鲜药,现代鲜药以传统中医理论为基础,采用鲜活动、植物体为原料,运用低温冷冻现代生化分离提取技术,研制出保持鲜药特色的创新鲜药制剂,其质量稳定、可控[9]。金龙胶囊,即是以鲜动物药为原料的现代鲜药制剂,药品上市以来对于金龙胶囊的临床观察已表明其对脑胶质瘤生长具有明显的抑制作用[10],在此基础上,本课题组进行了此项实验,以明确金龙胶囊提取物及其所制备的粗多糖、粗蛋白对脑胶质瘤的抗肿瘤作用,为后续探索金龙胶囊抗脑胶质瘤作用的药效物质基础提供了事实依据。
1 材料和方法
1.1 实验动物
SPF级BALB/c-nu 裸鼠100只,雌雄各半,体重(13.5±2.5)g,3~4周龄,购自北京华阜康生物科技股份有限公司[SCXK(京)2014-0004],动物饲养及无菌手术于在安泰康生物技术(北京)有限公司SPF级动物房[SYXK(京)2014-0034]中进行,饲养环境定期清洁消毒,实验过程符合伦理委员会要求[伦理审查证编号:ACB20180020],并按实验动物使用的 3R 原则给予人道主义关怀。
1.2 主要试剂与仪器
神经胶质瘤细胞U87-RFP由安泰康生物技术(北京)有限公司提供。
金龙胶囊提取物(多糖含量:9.04%,蛋白含量:15.39%,批号:20180423)、金龙粗多糖(多糖含量:19.40%,批号:20180605)、金龙粗蛋白(蛋白含量:74.86%,批号:20180703)均由北京建生药业有限公司提供。金龙胶囊提取物是按照金龙胶囊成药工艺制备而成的不含辅料的冻干粉,金龙粗多糖是由金龙提取物经醇沉、酶解、透析的方法制备,金龙粗蛋白是由金龙提取物经盐析、透析的方法制备;替莫唑胺胶囊(蒂清,江苏天士力帝益药业有限公司,批号:201804082)。
FluorVivo Model 100荧光小动物活体成像仪(INDEC BioSystems, CA, USA)。
1.3 实验方法
1.3.1 模型建立
3~4周龄的BALB/c-nu小鼠,100只,雌雄各半,其中按照随机数字表随机选出10只用作空白对照,雌雄各半。剩余小鼠应用外科原位移植方法,取源自同系小鼠皮下的U87-RFP肿瘤组织,在解剖显微镜下切除坏死的组织并将肿瘤组织切成1 mm3大小均一的组织块,戊巴比妥钠腹腔注射麻醉后,将麻醉的裸鼠固定在小鼠脑立体定向仪上,酒精消毒后延矢状缝剪开头皮1 cm,在矢状缝和冠状缝焦点(前囟)偏右3 mm,靠上1 mm处(定位于尾状核)钻骨窗,直径约0.5 mm,无菌手术条件下,运用外科原位接种(surgical orthotopic implantation)技术,将切好的肿瘤组织块种植到实验小鼠颅内,并用6-0外科缝合线缝合小鼠皮肤,建立红色荧光蛋白标记的人类脑胶质瘤(U87-RFP)小鼠原位模型[11]。U87-RFP细胞是用逆转录病毒方法进行转染,具体方法如下:逆转录表达载体pLNCX2(购自Clontech Laboratories, Inc.,G418抗性)连接pDsRed2片段(购自Clontech Laboratories, Inc.),用PT67细胞(购自Clontech Laboratories, Inc.)进行包装。U87细胞培养至对数期,加入预先过滤(0.22 μm)的PT-67 RFP细胞上清,共培养48 h,荧光显微镜下观察红色荧光,200~1000 μg/mL G418筛选1周,进行单克隆培养,筛选荧光明亮的克隆进行培养。逆转录病毒转染是一种稳定转染,直接将外源基因整合到宿主的基因组中,具有稳定遗传性,筛出表达荧光的细胞株后,荧光强度不会衰减[12]。
1.3.2 小鼠原位模型评价
模型建立后第3天,用FluorVivo Model 100荧光成像仪对所有模型小鼠的脑肿瘤进行非侵袭性的实时成像观察,观察到红色荧光蛋白标记的肿瘤的模型即为建模成功。
1.3.3 分组及给药
通过FluorVivo Model 100成像仪观察成像情况,读取肿瘤荧光面积并记录,剔除模型中肿瘤荧光面积偏离均值较大的荷瘤小鼠后,将挑选出的70只小鼠按照随机数字表随机分为7组(10只/组),雌雄各半。阳性对照组每天灌胃给与替莫唑胺胶囊内容物,给药剂量为32 mg/kg;金龙胶囊粗多糖组、金龙胶囊粗蛋白组每天灌胃给予粗多糖、粗蛋白,给药剂量均为100 mg/kg;金龙胶囊提取物低、中、高剂量组每天灌胃给予金龙胶囊提取物,给药剂量分别为750 mg/kg、1200 mg/kg、1500 mg/kg;空白对照组及阴性对照组每天给予同体积的溶媒(纯净水),给药时间为25 d。
1.3.4 定期观察实验动物
在实验过程中,每天观察动物的状况,动物体重每周称量2次,每周两次通过FluorVivo Model 100成像仪观察实验小鼠的肿瘤荧光成像情况并读取成像面积,具体方法为在开机状态下打开成像小室的门,实验员用左手抓住小鼠耳朵,右手抓住小鼠双脚,置于成像小室的特定位置,通过FluorVivo Model 100成像仪拍照,然后将小鼠放回笼内。系统拍摄的照片通过系统自带软件FluorVivoTM成像与分析软件自动计算肿瘤荧光面积。
给药25 d后,所有的裸鼠均通过注射常规麻醉药4倍剂量处死,通过FluorVivo Model 100成像仪和Leica MZ16荧光显微镜观察实验小鼠的肿瘤负荷情况和肿瘤的转移情况,采集所有荷瘤小鼠的肿瘤均分成3份,一份福尔马林固定,2份存于液氮中并对肿瘤进行称重和记录。
1.4 统计学方法

2 结果
2.1 实验动物的一般状况

注:与空白对照组比较,*P< 0.05,**P< 0.01;与阴性对照组比较,##P< 0.01。图1 小鼠体重生长曲线Note. Compared with the blank control group, *P< 0.05, **P< 0.01. Compared with the negative control group, ##P< 0.01.Figure 1 Body weight curves of the mice
小鼠经灌胃投予药物后,无卧伏,自主活动减少等现象。如图1所示,与空白对照组比较,阴性对照组和各治疗组小鼠体重均有不同程度的降低,差异具有显著性;替莫唑胺治疗组体重增长幅度最小,与空白对照组、阴性对照组相比有极其显著的差异;金龙胶囊各治疗组体重虽略低于阴性对照组,但与阴性对照组相比,差异均无显著性。
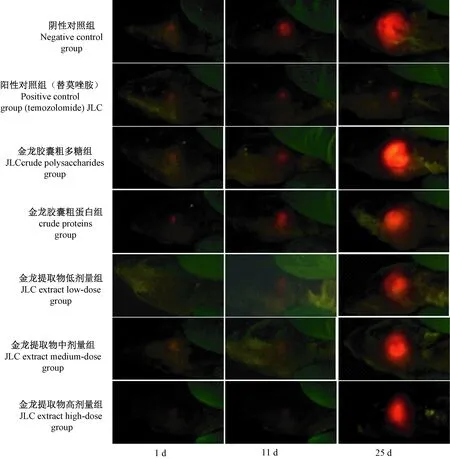
图2 各实验组1 d、11 d、25 d 的在体肿瘤整体原位荧光成像图Figure 2 Whole-body fluorescence images of the tumors in each test group on the 1st day, 11th day and 25th day

组别Groups1 d平均肿瘤面积(mm2)Average tumor-size on 1st day25 d平均肿瘤面积(mm2)Average tumor-size on 25th day阴性对照组(溶媒)Negative control group (solvent)0.74±0.4149.52±20.65阳性对照组(替莫唑胺)Positive control group(temozolomide)0.90±0.181.55±1.08**金龙胶囊粗多糖组JLC crude polysaccharides group1.01±0.3943.05±8.16金龙胶囊粗蛋白组JLC crude proteins group0.79±0.4234.32±6.56金龙胶囊提取物低剂量组JLC extract low-dose group0.81±0.3838.48±10.23金龙胶囊提取物中剂量组JLC extract medium-dose group0.74±0.3037.11±11.59金龙胶囊提取物高剂量JLC extract high-dose group0.69±0.3833.60±10.34*
注:与阴性对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the negative control group,*P< 0.05,**P< 0.01.
2.2 金龙胶囊对小鼠原位脑肿瘤的作用
如图3和表1所示,实验结束时,替莫唑胺组肿瘤荧光面积读数明显小于阴性对照组,差异有显著性;金龙胶囊粗多糖组、粗蛋白组肿瘤荧光面积读数与阴性对照组相较略有缩小(减少13.06%,30.69%),差异无显著性;金龙胶囊提取物低、中、高剂量组肿瘤荧光面积读数较分别较阴性对照组减少22.30%,25.06%和32.15%。但低、中剂量组与阴性对照组之间差异均无显著性,高剂量金龙提取物对小鼠原位模型肿瘤抑制作用差异有显著性。
2.3 各组实验验动物的肿瘤负荷
如表2示,实验结束后,替莫唑胺组肿瘤平均重量仅为阴性对照组的0.43%,并具有统计学意义上的显著差异;金龙胶囊粗多糖组、金龙胶囊粗蛋白组肿瘤平均重量约为阴性对照组的77.06%、62.34%,但与阴性对照组比较均不具有统计学意义上的显著差异;金龙胶囊提取物低、中剂量组的平均瘤重分别约为阴性对照组平均瘤重的65.37%和65.37%,但与阴性对照组之间均无统计学差异;金龙胶囊提取物高剂量组的平均瘤重约为阴性对照组的38.10%,而且与阴性对照组组平均瘤重之间具有统计学意义上的显著差异,如图4(P< 0.05)。

注:与阴性对照组比较,*P< 0.05,**P< 0.01。图3 各组小鼠脑肿瘤荧光面积随时间变化示意图Note. Compared with the negative control group, *P< 0.05, **P< 0.01.Figure 3 Schematic diagram of fluorescence area of the brain tumors in each group over time

注:与阴性对照组比较,*P< 0.05,**P< 0.01。图4 金龙提取物及其多糖、蛋白对小鼠脑肿瘤的影响Note. Compared with the negative control group, *P< 0.05, **P< 0.01.Figure 4 Inhibiting effects of extracts of JLC and polysaccharides and proteins prepared from JLC extracts on brain tumors in the mice

表2 实验各组脑肿瘤重量及肿瘤抑制率的比较
注:与阴性对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the negative control group,*P< 0.05,**P< 0.01.
3 讨论
本实验中,不同剂量的金龙胶囊提取物均可抑制原位脑胶质瘤的生长,以高剂量组(1500 mg/kg)肿瘤抑制率最为显著。未发现金龙胶囊及其制备的粗多糖、粗蛋白有明显的急性毒性反应。
脑胶质瘤恶性度高,不易手术切除和放化疗治疗[13],目前已有的治疗药物中,除替莫唑胺胶囊等化药外,尚无作用明确的治疗脑胶质瘤的中成药,临床用药费用昂贵,患者多采用姑息治疗方式。脑胶质瘤的动物模型[14]并不多,大多采用移植瘤的方法在小鼠腋下或皮下种植移植瘤细胞,观察药物对移植瘤的抑制作用。这种方法尚无法观察药物透过血脑屏障的作用,导致很多对移植瘤有效的药物,由于无法或不易透过血脑屏障而无效或效果不显著[9]。目前,有很多方法可以追踪某一成分透过血脑屏障[15]的效果,中成药具有多成分、多靶点的特点,故无法通过追踪特定成分观察透过血脑屏障的作用。因此,建立原位脑肿瘤动物模型,比较药物作用后的原位脑肿瘤的荧光面积的大小,可以间接反映药物透过血脑屏障作用于中枢神经系统的效果。活体成像技术可以有效解决颅内肿瘤因被头盖骨遮挡无法直接观察及测量的难题,通过红色荧光蛋白标记的质粒转染U87-RFP细胞,再将转染后的U87-RFP细胞注入颅内建立原位脑肿瘤模型,利用活体成像技术可以直接观察到红色荧光标记的肿瘤的大小并通过相应的软件计算荧光面积。本研究通过该方法,可以观察到替莫唑胺胶囊具有良好的抗肿瘤效果,但同时也具有极其显著的毒副作用,小鼠体重增长率显著降低。金龙胶囊提取物对小鼠脑胶质瘤的抑制作用,也在一定程度上吻合了临床上金龙胶囊对脑胶质瘤患者的治疗作用[16]。同时实验中,尚未发现及其制备的粗多糖、粗蛋白有明显的急性毒性反应,说明金龙胶囊的安全性良好。上述研究也初步证实了金龙提取物多糖、金龙提取物蛋白在抗脑胶质瘤方面的积极作用,从药效学动物模型的角度证实了金龙提取物多糖及蛋白均可跨血脑屏障转运并作用于中枢神经系统,为后续金龙胶囊抗脑肿瘤药效物质基础的研究奠定了实验基础,也为以后将多糖含量测定纳入金龙胶囊质量标准提供了依据。口服制剂由于胃肠道的消化作用、肝脏的消除作用等,有效物质能被吸收入血并经多种途径跨血脑屏障作用于中枢神经系统的量往往较少[17],但也可以起到一定的积极作用,基于本次研究,发现金龙胶囊中的多糖及蛋白组份在抗脑胶质瘤方面有很大的潜力和研究意义,如能进一步揭示多糖及蛋白组分的作用机制,一方面能更好的解释金龙胶囊抗脑胶质瘤的作用特点,初步确认金龙胶囊抗脑胶质瘤作用的物质基础,另一方面也可以为开发高效、低毒的新型药物制剂提供理论、实验基础及事实依据。
