人胃癌SGC-7901细胞内新藤黄酸含量测定HPLC法的建立及应用
2019-09-02刘世娟侯甲福王春妍李雪梅
刘世娟 侯甲福 王春妍 李雪梅
[摘要] 目的 建立高效液相色谱法测定人胃癌SGC-7901细胞内新藤黄酸含量的方法。 方法 采用高效液相色谱法,选取人胃癌SGC-7901细胞(贴壁细胞),色谱条件:色谱柱采用COSMOSIL C18,检测波长为360 nm,流动相为乙腈-0.1%乙酸水溶液(9:1),流速1 mL/min,柱温30℃。并对线性、稳定性、精密度、加样回收率和SGC-7901细胞内样品进行考察。 结果 新藤黄酸在(0.5~16)μg/mL浓度范围内线性关系良好,回归方程Y=3256X+517(r2=0.9995,n=6),稳定性实验5 d、10 d后RSD分别为1.73%、1.42%,精密度实验0.5、1.0、2.0、4.0 μg/mL浓度的RSD分别为1.33%、1.75%、0.76%、1.28%,平均加样回收率为100.11%(RSD=0.57%,n=4)。每毫克蛋白含药量为1.22、1.17、1.24、1.19、1.21 μg/mg,RSD=2.24%。 结论 本实验方法简便可靠、精密度高、重复性好,适用于人胃癌SGC-7901细胞内新藤黄酸含量的测定。
[关键词] 新藤黄酸;高效液相色谱法;SGC-7901;含量
[中图分类号] R285.5 [文献标识码] B [文章编号] 1673-9701(2019)19-0048-03
[Abstract] Objective To establish a high performance liquid chromatography(HPLC) method for the content determination of neogambogic acid in human gastric cancer SGC-7901 cells. Methods Human gastric cancer SGC-7901 cells(adherent cells) were selected by high performance liquid chromatography(HPLC). Chromatographic conditions: COSMOSIL C18 was for chromatographic column and the detection wavelength was 360 nm. The mobile phase was acetonitrile-0.1% aqueous acetic acid(9:1), the flow rate was 1 mL/min, and the column temperature was 30℃. Linearity, stability, precision, sample recovery rate and intracellular sample of SGC-7901 were investigated. Results The neogambogic acid had a good linear relationship within the concentration range of(0.5-16)μg/mL. The regression equation was Y=3256X+517(r2=0.9995, n=6). The RSD of the stability experiment was 1.73% and 1.42% after 5 d and 10 d, respectively. The RSD of the precision experiments at 0.5, 1.0, 2.0, and 4.0 μg/mL were 1.33%, 1.75%, 0.76%, and 1.28%, respectively. The average sample recovery rate was 100.11%(RSD=0.57%, n=4). The amount of protein per mg was 1.22, 1.17, 1.24, 1.19, 1.21 μg/mg, RSD=2.24%. Conclusion This experimental method is simple, reliable, and with high precision and good repeatability. It is suitable for the content determination of neogambogic acid in human gastric cancer SGC-7901 cells.
[Key words] Neogambogic acid; High performance liquid chromatography; SGC-7901; Content
新藤黃酸是藤黄科植物藤黄(Garcinia hanburyi Hook.f.)分泌的干燥树脂中的抗肿瘤活性成分[1],具有毒性低、抗瘤谱广的特点,对人胃癌SGC-7901细胞、肺腺癌A-549细胞、人胃癌MGC-803细胞增殖均有一定的抑制作用[2]。新藤黄酸本身理化性质较差,在新剂型方面的研究也较多,所以精确测定细胞内药物含量就变得尤为重要,而目前多采用荧光标记的方法常常会有荧光丢失等因素的影响,导致含量的测定不够准确。本实验采用高效液相色谱法直接测定肿瘤细胞内新藤黄酸的含量,能准确定量药物含量,为定量研究肿瘤细胞内药物含量的方法提供思路[3-5]。
1 材料与方法
1.1 仪器与设备
高效液相色谱仪(美国安捷伦公司Agilent 1260),二氧化碳培养箱(日本三洋公司MCO-18AC),倒置显微镜(日本OLYMPUS公司CKX41),调速多用振荡器(常州国华有限公司HY-4)。
1.2 药品与试剂
新藤黄酸(牡丹江医学院药学研究所提供,纯度>98%),藤黄酸(牡丹江医学院药学研究所提供,纯度>98%),RPMI-1640培养基(美国GIBCO公司,批号:1790007),无支原体新生牛血清(杭州四季青生物工程材料有限公司,批号:180503),RIPA裂解液(碧云天生物技术),人胃癌SGC-7901细胞(牡丹江医学院药学研究所提供)。
1.3 溶液的制备[6,7]
1.3.1 储备液的配制 电子分析天平称取新藤黄酸(NGA)、藤黄酸(GA)各10.0 mg,用甲醇10 mL容量瓶内定容,混匀溶解得1 mg/mL溶液,4℃储存。
1.3.2 细胞裂解液的制备 将SGC-7901于六孔板培养,保持贴壁状态下用磷酸盐缓冲液(PBS)小心冲洗3次,每孔加入200 μL的RIPA裂解液,裂解1 min后收集裂解液。
1.3.3 细胞内液的制备 空白细胞液的制备:未给药的SGC-7901细胞用RIPA裂解液裂解,得空白细胞液。样品的制备:取90 μL空白细胞液,分别加入一定浓度的样品溶液与GA内标液各10 μL,混匀后加入1 mL乙酸乙酯,旋涡萃取3 min后,3500 r/min离心8 min,取上清液0.9 mL,N2濃缩吹干,滴入100 μL甲醇溶解,1000 r/min离心15 min,取20 μL测定NGA含量。
1.4 含量测定
1.4.1 色谱条件 色谱柱:COSMOSIL C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%乙酸水溶液(9:1);流速1 mL/min;检测波长:360 nm;柱温:30℃;进样量:20 μL。
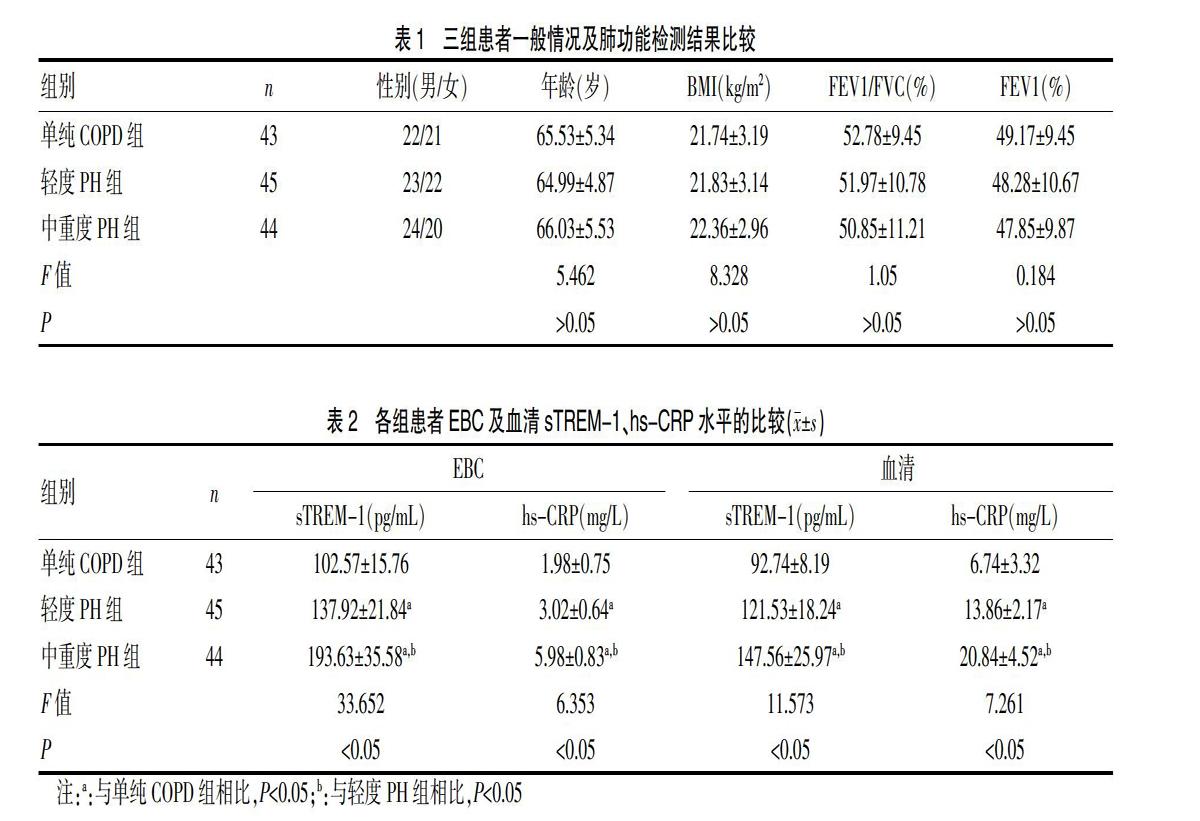
1.4.2 专属性实验 “按1.3.2”项下方法,分别制备细胞空白基质、NGA+GA+细胞空白基质、NGA+细胞空白基质、GA+细胞空白基质、NGA+GA甲醇溶液,按“1.4.1”项下条件进行专属性实验。
1.4.3 标准曲线的绘制 用甲醇稀释NGA储备液浓度依次为5、10、20、40、80、160 μg/mL;精密量取“1.3.1”项下方法的GA样品溶液并稀释至浓度40 μg/mL,按照“1.3.2”项下方法制备不同浓度样品,绘制标准曲线。
1.4.4 精密度 精密量取NGA,按照“1.3.2”项下方法配制成样品浓度至0.5、1.0、2.0、4.0 μg/mL,测量批内精密度(n=6),再连续进样3 d测量批间精密度(n=6)。
1.4.5 稳定性 精密量取NGA,按照“1.3.2”项下方法配制成2批样品,浓度为0.5、1.0、2.0、4.0 μg/mL,两批样品不复溶(n=6),分别放置5 d、10 d后,加入100 μL甲醇复溶后测定。
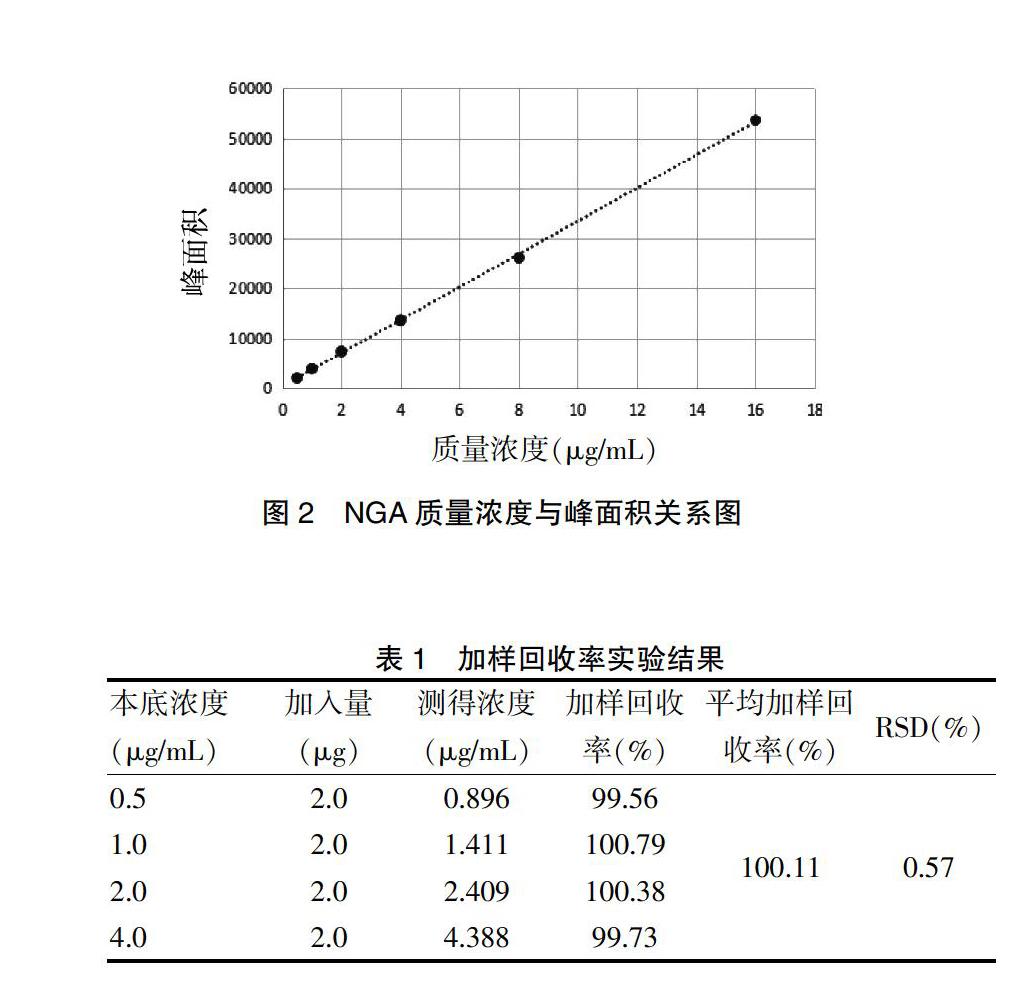
1.4.6 加样回收率 按照“1.3.2”项下方法制备浓度为0.5、1.0、2.0、4.0 μg/mL的标准溶液,分别置于5 mL容量瓶内,分别加入NGA 2.0 μg于容量瓶,用相应标准液定容。按照“1.3.3”项下方法处理,进入HPLC进行测定,记录峰面积,计算回收率。
1.4.7 人胃癌SGC-7901细胞内样品测定 培养SGC-7901细胞于六孔板,铺满单层细胞后加入20 μg/mL的NGA,2 h后终止(n=5),PBS小心冲洗3次,加入裂解液,1 min后取100 μL含药裂解液,加入内标按照“1.3.2”项下处理,测定含量。另取20 μL测定蛋白浓度,以每毫克蛋白所含药物量为计量单位,测定每毫克蛋白含药量。
2 结果
2.1 专属性结果
通过实验排除是否有内源性物质在360 nm波长处有所吸收,通过实验结果未发现在该波长处有其他吸收峰,专属性结果显示,细胞基质内源性物质对NGA与GA的测定不存在干扰,并且峰形良好,可以进行实验(图1)。
2.2 标准曲线
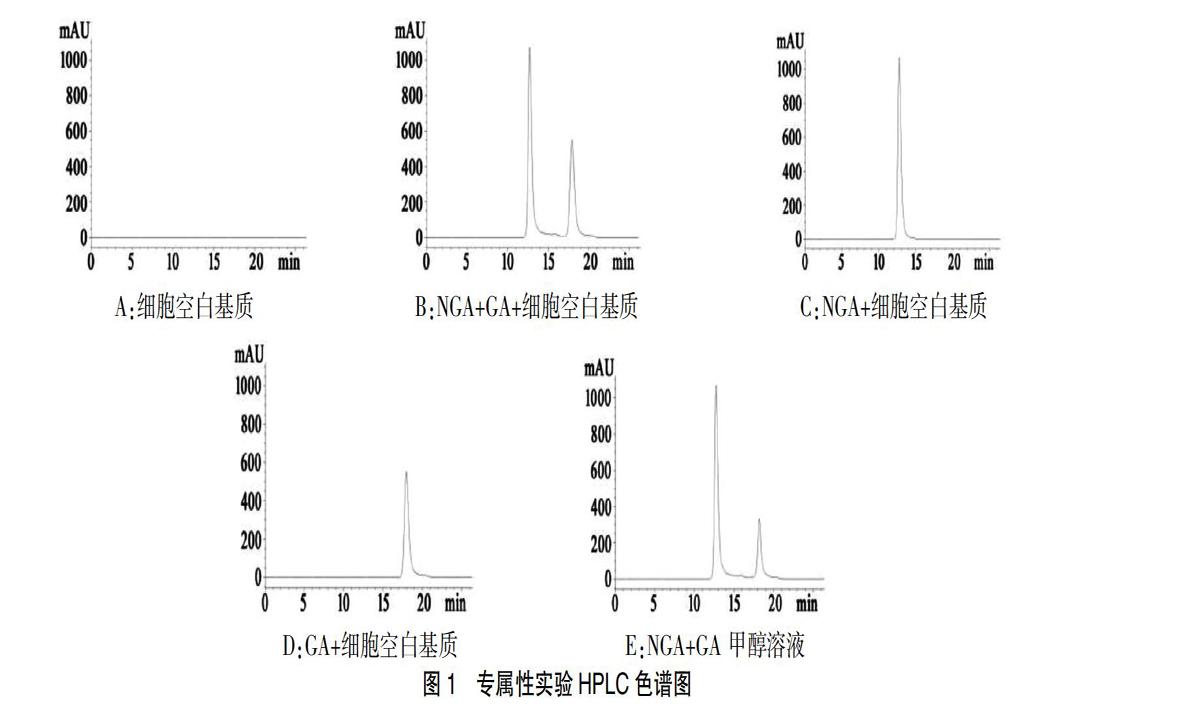
以质量浓度为横坐标(X,μg/mL)、峰面积为纵坐标(Y),进行线性回归,回归方程Y=3256X+517(r2=0.9995,n=6)。结果表明NGA在(0.5~16)μg/mL浓度范围内线性关系良好(图2)。
2.3 精密度结果
样品的定量下限、低、中、高浓度RSD分别为1.33%、1.75%、0.76%、1.28%,RSD值均<10%,表明本方法精密度良好。
2.4 稳定性结果
为保证实验可靠,采用2个时间点来检查样品稳定性,两批样品分别放置5 d、10 d后RSD分别为1.73%和1.42%,RSD值均<10%,说明本法处理样品在10 d内稳定,测定NGA细胞内含量稳定性良好。 2.5 加样回收率结加样回收率实验结果显示平均加样回收率为100.11%,RSD=0.57%(n=4),表明加样回收率良好,实验方法可行。见表1。
2.6 SGC-7901细胞内样品测定
每毫克蛋白含药量为1.22、1.17、1.24、1.19、1.21 μg/mg,RSD=2.24%,结果表明可以通过本方法测定细胞内NGA的含量。
3 讨论
藤黄其主要活性成分为GA、NGA,国内外对GA与NGA的抗肿瘤活性报道也较多,王云龙等[8]研究NGA干预肺腺癌血管生成,苏婧婧等[9]发现NGA可对人胃癌SGC-7901细胞增殖进行抑制并产生诱导凋亡作用,谈永进等[10]研究发现NGA可诱导黑色素瘤B16细胞凋亡,戴婷婷等[11]发现NGA可通过内质网应激诱导人结肠癌HCT116细胞凋亡。
NGA在新剂型的方面研究也有许多报道,如mPEG修饰的NGA介孔硅纳米粒的制备与研究[12]、NGA的羟丙基-β-环糊精包合物冻干粉[13]、磁性纳米Fe3O4载NGA复合物的制备与研究[14]等,同时也有学者通过对NGA结构进行改造提高其理化性质,如胡钟[15]研究NGA衍生物的设计、合成与抗肿瘤作用,但是NGA在癌细胞内的含量测定方法与实践鲜有报道,本实验旨在通过简单易行的方法测定NGA在癌细胞中的含量。
实验中对NGA与GA分别进行紫外光谱扫描,结果显示GA在217 nm、290 nm、362 nm有最大吸收,NGA在214 nm、358 nm最大吸收,因此综合考虑选用360 nm波长进行检测,实验研究表明该波长处无干扰。流动相曾试用甲醇-0.1%乙酸水進行洗脱,但保留时间过长且目标峰与杂质峰不能达到基线分离,选用乙腈-0.1%乙酸水,保留时间适中,峰形对称,目标峰与杂质峰能达到基线分离。柱温选择时,在相同条件下对比20℃、25℃、30℃及35℃共4个温度,结果显示,30℃时比20℃、25℃时保留时间短,同时又比35℃时分离度高,因此柱温选择30℃。样品进行处理时尝试过超声裂解物理裂解法提取待测样品,发现用时较长且裂解不完全,采用RIPA裂解简单方便,裂解完全,所以采用RIPA裂解液进行处理。
本实验仅采用一种癌细胞作为实验对象,因此不排除因为细胞株的不同而引起的误差,因此还需要进一步测定细胞蛋白浓度,以精确测定细胞内的药物含量,因此本实验通过测定每毫克蛋白含量来判定SGC-7901细胞中含有NGA的量,保证了实验方法和数据的可靠性。本实验方法的建立为定量研究细胞内的药物含量提供了一定的思路,为今后NGA的药物动力学研究提供实验依据与理论基础。
[参考文献]
[1] 薛恒燕. 浅议中药藤黄的炮制[J]. 中医临床研究,2013,5(18):41-43.
[2] 陈润哲,陈宝安. 新藤黄酸的抗肿瘤作用研究进展[J]. 转化医学电子杂志,2016,3(3):48-50.
[3] 张变,常佳丽,余琼芳,等. 高效液相色谱法测定A549细胞内新藤黄酸含量方法的建立[J]. 蚌埠医学院学报,2017,42(11):1439-1442.
[4] 范哲贤,胡悦,赖宏强,等. 中药复方制剂整体复杂成分体内外含量测定的方法学研究[J]. 中医临床研究,2016,8(13):11-15.
[5] 胡华钟,王仲萍,陈亦清,等. 人单核细胞THP-1源性泡沫细胞内雷帕霉素含量测定的HPLC法的建立及应用[J]. 中国药房,2017,28(1):43-45.
[6] 龙玉琼. HPLC法同时测定胃康灵胶囊中芍药苷和甘草次酸含量[J]. 中国中医药现代远程教育,2018,16(16):78-80.
[7] 张松涛. HPLC法测定活血通络片中人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1的含量[J]. 中医临床研究,2016,8(32):134-136.
[8] 王云龙,程卉,李庆林. 新藤黄酸干预肺腺癌血管生成的细胞学研究[J]. 安徽医药,2017,21(1):27-31.
[9] 苏婧婧,侯梅,李庆林,等. 新藤黄酸对人胃癌SGC-7901细胞增殖抑制和诱导凋亡作用的研究[J]. 安徽中医药大学学报,2018,37(4):77-80.
[10] 谈永进,张璇,程卉,等. 新藤黄酸诱导黑色素瘤B16细胞凋亡的研究[J]. 中药材,2014,37(3):469-473.
[11] 戴婷婷,程卉,苏婧婧,等. 新藤黄酸通过内质网应激诱导人结肠癌HCT116细胞凋亡的研究[J]. 安徽中医药大学学报,2014,33(1):63-66.
[12] 李囡囡,费伟东,张燕,等. mPEG修饰的新藤黄酸介孔硅纳米粒的制备及体外评价[J]. 中国医院药学杂志,2018,38(14):1451-1457.
[13] 见玉娟,王效山,黄鹏,等. 新藤黄酸-羟丙基-β-环糊精包合物的制备及质量控制[J]. 中国新药杂志,2010, 19(7):628-631.
[14] 戴雅吉,王芳,黄鹏. 磁性纳米Fe3O4载新藤黄酸复合物的制备和表征[J]. 广州化工, 2016,44(2):71-73.
[15] 胡钟. 新藤黄酸衍生物的设计、合成及抗肿瘤活性初步研究[D]. 合肥:安徽中医药大学,2013.
(收稿日期:2019-03-15)
