血清IL-35在评估核苷(酸)类似物治疗慢性乙型肝炎中的临床应用
2019-09-02冯霞刘贵章赵登蕴李声方
冯霞 刘贵章 赵登蕴 李声方
我国是乙型肝炎病毒感染的高发地区,每年大约100万人口死于HBV感染相关疾病,同时用于防治乙型肝炎的费用也是国家财政支出的重要组成部分[1-2]。可见乙型肝炎病毒感染已然成为威胁我国公共卫生健康的主要疾病种类。
目前慢性乙型肝炎抗病毒药物包括核苷(酸)类似物(NAs)及干扰素,核苷(酸)类似物可提高HBV-DNA转阴率, 且人均成本远低于干扰素。本研究从血清炎症因子及免疫系统方面出发,评价两者指标在NAs治疗慢性乙型肝炎方面的实用性,从而为临床治疗慢性乙型肝炎肝炎的诊疗提供理论基础。
资料与方法
一、 一般资料
选取2016 年1月至2017年12月我院感染科收治的慢性乙型肝炎患者60例, 核苷酸类似物治疗后是否复发分为复发组和未复发者,同时抽取门诊健康体检者30例作为对照组。慢性乙型肝炎患者的诊断符合《慢性乙型肝炎防治指南》(2015年更新版)。纳入标准:(1)年龄>18周岁者;(2)无肝硬化者;(3)无合并其他器官功能不全者(心、脑、肺);(4)自愿参加本项研究并配合随访;(5)核苷(酸)类似物治疗;排除标准:(1)合并其他肝炎病毒感染者;(2)合并梅毒、HIV等病毒感染者;(3)合并其他部位肿瘤者;(4)合并免疫系统疾病者;(5)住院前两周无感染者;(6)住院前使用免疫抑制剂者。两组患者均对此研究知情同意并签署同意书,本研究经本院伦理委员会批准通过。
二、方法
(一)临床治疗方法 我院感染科对患者采取恩替卡韦对乙肝患者进行治疗,剂量为0.5 mg,1次/d,空腹口服。停药标准:HBeAg阳性者连续治疗至HBeAg血清学转换、ALT复常、HBV DNA低于检测下限即100 IU/mL后继续给予3年的维持治疗;HBeAg阴性者连续治疗至HBsAg消失且HBV DNA检测不到后继续给予1年的维持治疗。复发标准:达治疗结束时应答,但停药后定期随访复查HBV DNA >1×103IU /mL。
(二)炎症因子检测方法 记录乙肝患者治疗前后的及对照组研究对象血清IL-35、TNF-α及IL-10变化,具体检测方法:获取患者治疗前及治疗后外周静脉血,量约6~8 mL,加入抗凝管,然后放入离心机,3 000 r/分的速度离心,分离上清液,放入-80℃保存备用,应用酶联免疫吸附法试剂盒检测IL-6、TNF-α及IL-10的血清含量,具体操作方法按照试剂盒的方法操作。
(三)CD4+/CD8+比值 抽取外周静脉血3~5 mL, 采用EDTA-K2抗凝, 常规采用淋巴细胞分离液常规分离血细胞及淋巴细胞,分离成功后待检。然后按照操作说明书进行T细胞亚群的测定。CD4+/CD8+比值正常值在1.2~1.7之间,低于最低下限认为机体免疫功能受到了影响。
三、统计方法
所有数据均使用SPSS 20.0统计学分析软件对其进行分析,计量资料采用平均数±标准差(Mean±s)表示,组间计量比较方差分析,组间率的比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一、乙型肝炎患者与对照组对象基线资料比较
本研究结果显示,慢性乙型肝炎组男性患者为40例,女性患者为20例,平均年龄(42.63±11.48)岁,对照组研究对象男性20例,女性10例,平均年龄(41.95±10.97)岁,两组研究对象在年龄、性别、高血压(10 vs 7)、糖尿病(9 vs 6)等方面无统计学意义(P>0.05),具有可比性。详见表1。
二、各研究对象血清TNF-α及IL-10以及CD4+/CD8+比值变化
本研究结果显示慢性乙型肝炎患者感染者患者血清TNF-α(7.65±1.22 ng/L vs 4.48±2.33 ng/L)及IL-10(9.92±1.45 ng/L vs 5.64±1.59 ng/L)水平显著高于研究对照组(allP<0.05),同时CD4+/CD8+比值低于对照组(0.69±0.11 vs 1.22±0.38,P<0.05),可见乙肝病毒会引起机体的炎性反应并影响患者的免疫系统。
三、各研究对象血清IL-35水平变化
本研究结果显示,慢性乙型肝炎患者血清IL-35水平高于正常健康者(8.59±0.21 vs 5.38±0.18,P<0.05),此外,复发者血清IL-35水平高于未复发者(10.37±1.97 vs 8.46±1.35,P<0.05),可见IL-35可以作为动态监测慢性乙型肝炎患者预后的指标。
四、复发组患者于未复发组患者相关资料比较
本研究结果显示本组共有16例患者复发,44例患者未复发病情控制尚好,其中复发组年龄及病程均与未复发组之间存在差异,说明年龄及病程因素是慢性乙型肝炎病毒感染患者复发的危险因素。详见表1。
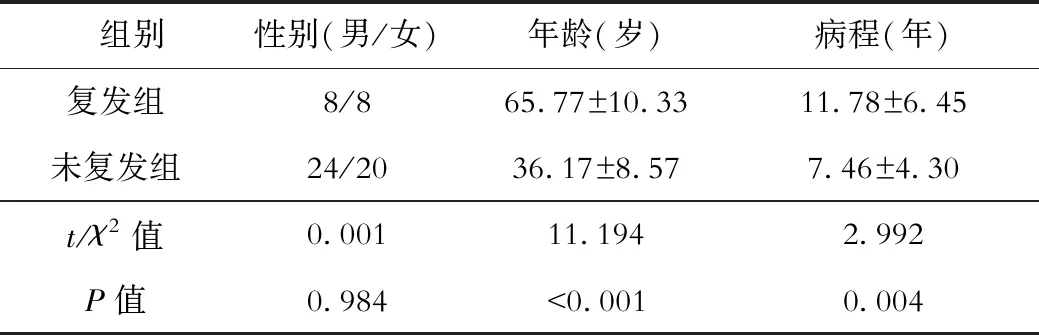
表1 复发组与未复发组患者资料比较
讨 论
乙肝病毒侵入机体后,会刺激机体炎性细胞产生诸如白细胞介素-10,TNF-α及IL-35[3]。而IL-35作为一种新发现的趋化因子,在乙肝病毒的发生发展过程中作用也逐渐研究明了。IL-35作为IL-12的家族成员,但其不是由巨噬细胞分泌,而是由其T淋巴细胞分泌,可见IL-35可作为乙肝病毒感染的第一反应因子。而本研究结果显示了乙肝病毒感染者血清IL-35的含量明显高于健康体检者,同时复发者的血清IL-35的水平也高于未复发者,可见IL-35在监测乙肝病毒感染方面具有重要应用意义,与之前的研究结果类似[4]。
IL-35入血后,通过机体特定的信号通路,与T细胞表面的受体结合,从而产生新型的免疫细胞,从而起到了强烈的免疫抑制作用[5]。在乙型肝炎免疫方面,IL-35抑制CD4+T细胞分化成为Th17细胞,从而减弱了机体清除乙肝病毒的能力,此外,IL-35诱导T淋巴细胞分化为CD8+T,从而使CD4+/CD8+比值下降[6]。而本研究结果显示乙肝感染患者的CD4+/CD8+比值低于健康对照组,证实了乙肝病毒对免疫系统的影响,可能与IL-35的作用相关,既往的研究也得出了类似的结论[7]。
体外实验证明了IL-35可显著增加用PCR-Elase 技术检测体外CD4+T 细胞培养液IL-10的含量[8]。而本研究结果也证实了慢性乙型肝炎病毒的患者的血清IL-10水平明显高于对照组,佐证了既往的研究结果[9]。而有研究证实了乙肝病毒可诱导单核细胞产生TNF-α,可见TNF-α是机体早期应答的主要表现[10]。而IL-35也可促进单核细胞分泌TNF-α,从而提高机体的应答,而本研究结果也显示乙肝病毒感染者的血清TNF-α水平高于健康对照组,证实了国内王玉泽的研究结果[11]。在慢性乙型肝炎感染者复发方面,由于年龄及病程因素,机体的免疫系统能力逐渐下降,从而增加了乙肝病毒复发的几率,而本研究也证实了复发组患者的年龄与病程均较未复发者长,证实了两者在乙肝病毒复发方面的影响,和国内王传敏发现的结论一致[12]。
总而言之,IL-35在诊疗慢性乙型肝炎方面具有良好的临床效果,但具体机制未知。此外,本研究两组患者的远期的随访结果及样本量的进一步补充则需要更长时间的随访以及多中心合作来完成,最后,慢性乙型肝炎病毒的复发的相关风险因素的完善也有待我们下一步研究的方向。