不同pH环境下二价离子对聚电解质链的影响
2019-09-02李树行祝泽栋徐紫颜杨光参
李树行,祝泽栋,徐紫颜,杨光参
(温州大学数理与电子信息工程学院,浙江 温州 325035)
DNA是一种高度带电的聚电解质,可以紧密包装在细胞核、细菌细胞质和病毒衣壳中。因此,DNA缩合不仅对于生物系统中遗传物质的包装过程起着重要作用,而且在人工基因递送中具有潜在的治疗应用价值。对DNA等聚电解质性质的研究,有助于我们更清晰地了解DNA构型变化的电动力学机理。通常在细胞中发现的多价阳离子是多胺,例如三价亚精胺和四价精胺,都受到高度调节,在细胞增殖和生长中发挥重要作用[1]。但是多胺代表的是具有阳离子基团(氨基)的化合物,而不是金属离子。
在生物细胞中最常见的抗衡离子是金属抗衡离子,如Na+、K+、Ca2+和Mg2+。并且通常情况下,一价与二价阳离子在温和条件以及一般的摩尔浓度下不能导致DNA缩合,尽管其对DNA骨架具有高亲和力以中和大部分DNA电荷。近几年对DNA包装和细胞骨架组织等各种生物现象的研究变得热门起来,这使得对抗衡离子介导下的聚电解质构型变化的研究变得非常重要[2-3]。在早期的Oosawa-Manning凝聚理论中将抗衡离子分为“游离离子”和“聚集离子”[4-6],游离的抗衡离子充斥在溶液里,聚集的抗衡离子位于聚合物主链附近的小体积内。这个理论系统给出了反离子与聚电解质的作用机制,并且指出只有三价以上的多价离子才能诱导聚电解质缩合。随后,Katchalsky模型[7]对抗衡离子分布给出了更严格的描述,该模型能够使反离子和聚合物的自由度解耦合,从而可以提供平衡离子密度分布固定的理想聚合物构象。Ou 等[8]采用郎之万动力学方法研究了均匀带电半柔性聚电解质链上反离子凝聚的性质及其伴随构型,考察了链刚度、链长、反离子价态和静电相互作用强度对反离子凝聚的影响。在近期,Hofzumahaus等[9]采用蒙特卡罗方法对弱聚电解质微凝胶的构象与pH的依赖关系进行了模拟的,这对我们改变模拟pH环境提供了理论基础。尽管到目前为止关于抗衡离子对DNA的凝聚的理论模拟和实验研究已经很多[10-14],但是关于非特异性结合的二价抗衡离子导致DNA凝聚的现象研究很少。
我们分别运用理论模拟和实验的方法,通过改变溶液的pH环境,清楚地证明了由二价抗衡离子介导的聚电解质(DNA)的构象变化,主要工作是对实验的结果进行模拟研究。事实上,严格调节细胞内pH以优化许多酶的活性,对于控制细胞周期和细胞的增殖能力是重要的。另一方面,pH调节的基于DNA的纳米材料和纳米器件在体内成像、临床诊断和药物递送方面都有一些应用[15-18]。
1 模拟方法
1.1 模型创建
我们在隐性溶剂条件下利用粗粒化模型来研究含有聚电解质和带+2价反离子的水溶液体系。聚电解质被模型化为一个由Lennard-Jones(LJ)粒子组成的弹簧链,聚电解质链上每个珠子随机带有1或0个单位的负电荷,反离子为带两个正电荷的球体,聚电解质分子和反离子置于均匀介电常数为εr的介质中,模拟区域为L×L×L的立方体盒子,模型简单示意图可参见图1。

图1 聚电解质链与反离子作用模型简图Fig.1 Schematic of the polyelectrolyte chain and anti-ion interaction model
单体间的相互作用势选用排斥性的LJ势:
(1)
其中,dαβ(α,β=1,2,3表示单体的类别,α=β表示同一种单体)是力为零的距离,两个聚合物珠子排斥距离设定为dαβ=1σ,其中σ为模拟系统中长度基本单位,这里珠子与抗衡离子、抗衡离子与抗衡离子之间的排斥分别取为0.8σ和0.6σ。rij表示两个珠子之间的距离,在这项工作中,能量单位参数ε=kBT,其中kB是Bolztmann常数,T是绝对温度。
采用标准简谐弹性势对聚电解质链连通性进行建模:
(2)
其中,k是弹性参数,为了限制聚电解质珠子在链的方向保持小范围振动,设置k=10 000kBT/σ2,其中,l0为平衡距离,大小为σ。
聚电解质链的弯曲能选用简谐角的形式:
(3)
其中,θ0为角度平衡时的值,取为1800,k'是体现链刚性的参数。
任意两个单体之间的库仑相互作用,我们用以下形式描述:
(4)
其中,Bjerrum长度定义为lB=e2/4πε0εrkBT,其中ε0和εr分别是真空的介电常数和溶剂的相对介电常数,库仑作用强度用A=lB/σ描述,本研究我们选取的A为4.0,库仑相互作用的计算采用ewald求和法。所有的模拟都是从随机生成的初始配置开始的。每个模拟总的时间步数都在5×107以上,以保证系统达到平衡,每隔1000个模拟步数要保存所有粒子的位置和速度数据。
1.2 模拟细节
我们通过LAMMPS(大规模原子/分子并行仿真器)软件包进行分子动力学(MD)仿真来研究系统的动力学过程,整个模拟环境运用Langevin恒温器在NVT系宗中保持恒温。为了提高计算效率,我们忽略了流体动力学相互作用,这种粗粒度方法,使得我们的模拟涵盖更大的长度和时间尺度。
系统中任何单体的动力学行为满足郎之万方程:
(5)
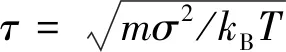
我们通过计算不同pH-pK值来研究不同pH对聚电解质缩合的影响,所有的值都是系统的平均值。对于聚电解质满足以下方程:
HMH++M-,
(6)
其中,M代表高分子电解质。上述反应可以用一个解离常数来描述,即:
(7)
其中,x(H+),x(HM)和x(M-)表示离解质子、相关酸及碱的浓度。同时我们可以定义电离度α:
(8)
电离度α和pH满足以下关系[19]:
(9)
当pK固定时(pK=-lgK),通过调节α的值,可以得到不同的pH环境。而α的调节可以通过改变聚电解质链的带电比率来实现。
2 实验材料与方法
2.1 实验材料
AFM型号是NanoWizard III,购自于 JPK公司,其分辨率大约为纳米级,比光学衍射极限高出1000倍以上,通过用机械探针“感觉”或“触摸”表面来收集信息。压电元件有助于实现微小但精确的(电子)命令运动,从而实现精确扫描,主要应用于单分子DNA的操纵实验。在AFM内部安装有自动化机器人以及一架可操作的控制装置,还包含NanoScience 控温系统。机械探针购自于NanoWorld,型号为NCHR-50的镀铝硅探针。探针参数为:长宽厚度分别是125 μm、30 μm、4 μm,弹性系数为2 N/m,共振频率为320 kHz。在整个实验过程中环境温度保持室温。使用AC mode扫描图像,图像尺寸5 μm×5 μm,扫描频率维持1 Hz。图像处理采用自带的处理软件(4.2版的JPK Data Processing)对所有图片做相同的处理,图片像素为512×512。实验所用的缓冲液为10 mmol/L的Tris溶液,超纯水来自于Milli-Q系统(Millipore,Billerica, MA, USA)。MgCl2·6H2O购于奥里奇西格玛公司,配置的初始浓度为100 mmol/L。本实验所用的Mg2+浓度为 3 mmol/L。
2.2 实验方法
整个实验过程可分为以下5个步骤:
(1)制备云母片,将云母片切割成1 cm×1 cm大小备用;
(2)用双面胶将云母片平铺到载玻片中间位置;
(3)使用磨砂胶带剥离云母片,使其表面光滑完整待用;
(4)云母片处理好后,用移液器取出50 μL实验溶液至云母片中央,用玻璃器皿将其罩上静置5 min;
(5)5 min过后,取出样品,吸取表面多余溶液,并用50 μL去离子水多次(10次左右)清洗,用氮气吹干表面后再置于烘干箱中烘干1 h备用。
简单流程如图2所示。
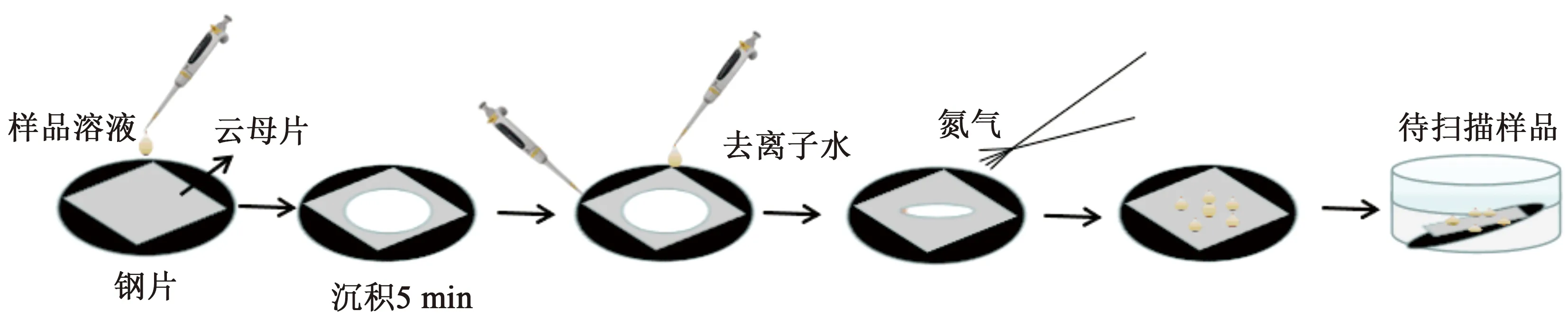
图2 样品制备流程图Fig.2 Sample preparation flow chart
3 实验结果
3.1 理论模拟结果
为了表征pH对聚电解质链的聚集的影响,我们对不同pH-pK下聚电解质的Rg做了统计平均。图3给出了不同链长的聚电解质Rg随pH-pK的变化规律,其中回转半径Rg满足公式:
(10)
其中,rc表示聚电解质质量中心的坐标,ri表示聚电解质中第i个单体的坐标。
由图3中可以看到,在-1.5
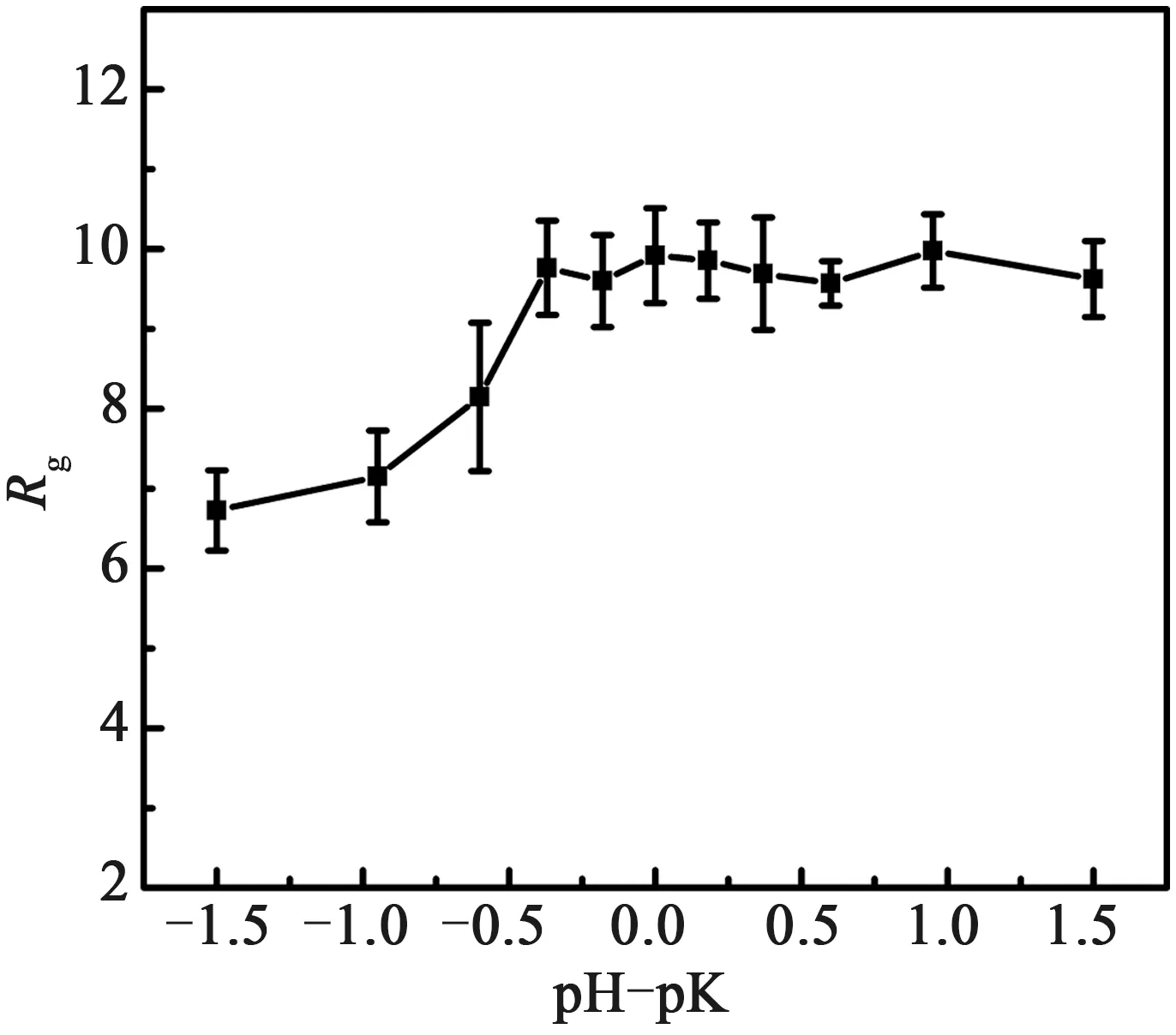
图3 回转半径Rg与pH-pK的关系Fig.3 Radius of gyration Rg for a chain of a particular length and some values of pH-pK
我们在二价离子溶液中研究了多种不同的聚电解质系统,将pH-pK=0时的系统作为参考系统。从参考系出发,研究了另外多组系统,只改变一个参数α(电离度),并保持所有其他参数不变。我们从中选取了4组不同系统(对应的α分别为0.9、0.5、0.3、0.1)做了模拟快照图,如图4所示。随着α的减小,pH是降低的,我们从图4中能明显地看出聚电解质的构型变化。所有的模拟数据均在体系能量达到最小时进行收集,其能量随时间步数的变化结果,如图5所示(图5是许多模拟中的一个普通个例)。

图4 模拟快照图Fig.4 Simulation snapshots
图5 模拟系统总能量随时间的变化Fig.5 The change in the total energy of the simulation system with time
3.2 实验结果
为了证实当前的模拟结果,我们做了pH对二价反离子介导的DNA形态影响的实验研究。本研究使用AFM观察了在不同离子和pH条件下的DNA构象变化,DNA的浓度为1 ng/μL。图6给出了pH=8、5、4、3的3 mmol/L MgCl2溶液中的DNA形态,在pH = 5时,DNA呈现出自由松散的状态,并且形态类似于pH>5的形态。当pH从5变为4时,观察到图6中DNA发生了聚集,中间有个核状结构,周围分布着DNA的线条,我们称为花状形态。而当pH在图6中降至3时,出现球状或环状形态。由此可以看出随着pH的降低,DNA发生了凝聚,这和我们的理论模拟基本保持一致。

图6 不同pH下3 mmol/L Mg2+诱导的DNA形态的AFM图像Fig.6 The AFM images of the DNA morphologies induced by 3 mmol/L Mg2+ at different pH
4 结论
我们通过模拟在各种pH环境下聚电解质链在二价反离子环境中的构象变化,发现当非特异性结合的抗衡离子中溶液的pH-pK降至低于0(即α=0.5)时,聚电解质链开始收缩。当环境pH-pK约为-0.37(即α=0.3)时,聚电解质处于不稳定的过渡状态,相应的实验也证实了模拟工作的正确性。当溶液的pH降低时,DNA的质子化能力变强,DNA链上被中和的磷酸基团变多,使得DNA的负电性变弱,进而更容易导致DNA凝聚。该结果为以后DNA和蛋白质等生物聚电解质链的实验以及理论研究奠定了基础。
