不同的人癌裸鼠移植瘤模型中磷脂酶A2 的表达
2019-09-02周卫民蔡月琴陈民利
屠 珏, 周卫民, 蔡月琴, 凌 云, 陈民利
(1. 动物实验研究中心/中医药科学院, 浙江中医药大学, 杭州 310053;
2. 比较医学研究所, 浙江中医药大学, 杭州 310053)
恶性肿瘤一直以来是威胁人类健康和生命的重大疾病。近年研究[1,2]表明, 肿瘤细胞能破坏维持组织正常生长和功能的生化机制, 促进肿瘤微环境的形成, 肿瘤细胞和微环境之间的相互作用是肿瘤发生发展的重要影响因素, 肿瘤特殊的生理生化通路成为研究的热点。对肿瘤细胞生化通路中酶及产物、相关信号传导蛋白的研究有利于阐明癌症发生的异质性, 发现新的肿瘤标志物, 探寻新的个性化治疗方法。
磷脂酶A2(phospholipase A2, PLA2)是一类具有磷脂分解活性的超家族酶类, 广泛参与细胞内外信号的传递、炎症及炎症相关疾病等病理反应[3,4],主要分为4 大类:胞浆型PLA2(cytosolic PLA2,cPLA2)、分泌型PLA2(secretory PLA2, sPLA2)、钙离子非依赖型PLA2(Ca2+-independent PLA2,iPLA2)和脂蛋白相关PLA2(lipoprotein-associated PLA2, lp-PLA2)。近年来大量临床研究表明,PLA2 家族在结肠癌[5]、卵巢癌[6]、乳腺癌[7]、食管癌[8]、肺癌[9]、前列腺癌[10]等多种肿瘤组织中高表达, 而且PLA2 与肿瘤的发生、浸润和转移均有密切的联系, 有望成为具有高特异性的肿瘤治疗新靶点[11,12]。目前,肿瘤动物模型上有关PLA2表达的研究较少。根据2016 年统计数据显示[13],肺癌作为2015年我国发病率最高的恶性肿瘤,是癌症死亡的主要原因。胃癌、食管癌、肝癌等消化系统肿瘤发病率和死亡率其次。而卵巢癌的死亡率在女性各类生殖器官恶性肿瘤中居首,是妇科肿瘤的最危险因素。因此, 本文构建了肺癌、鼻咽癌、肝癌、胰腺癌、胃癌、结肠癌、食管癌、卵巢癌等8 种人癌细胞株裸小鼠移植瘤模型,观察4 大类PLA2 在移植瘤模型的肿瘤组织、正常组织及荷瘤裸小鼠血清中的蛋白表达水平及表达特征,为裸小鼠移植瘤模型在PLA2 及肿瘤相关研究领域的应用提供实验依据。
1 材料与方法
1.1 细胞和实验动物
人非小细胞肺癌NCI-H1299 细胞、人低分化鼻咽癌CNE-2 细胞、人肝癌HepG2 细胞、人胰腺癌SW1990 细胞、人结肠癌HT-29 细胞、人胃癌SGC7901 细胞、人食管癌CaES-17细胞和人高转移卵巢癌HO8910-PM 细胞,均购自中国科学院上海细胞库。肿瘤细胞均用含体积分数10% 胎牛血清、100 IU/mL 青霉素、100 μg/mL 链霉素的RPMI 1640 或高糖DMEM 培养基,于37 ℃、体积分数5% CO2饱和湿度的培养箱中传代培养。
4~6周龄雌性BALB/c裸小鼠48只, 购自上海斯莱克实验动物有限公司[SCXK(沪)2012-0002]。每个肿瘤模型使用6 只动物,饲养及无菌实验操作均在浙江中医药大学动物实验研究中心屏障系统内进行[SYXK(浙)2013-0184]。
1.2 主要仪器与试剂
Axiovert 200 荧光倒置显微镜购自德国Zeiss公司, Forma 3111 型细胞培养箱、1300 生物安全柜均购自美国Thermo 公司, RPMI 1640、DMEM高糖培养基、青-链霉素、胎牛血清(FBS)和胰蛋白酶均购自美国Gibco 公司,cPLA2、sPLA2、iPLA2、lp-PLA2 酶联免疫试剂盒均购自南京建成生物有限公司。
1.3 方法
1.3.1 模型制备 取对数生长期细胞,经质量分数0.25%胰蛋白酶消化后,用完全培养基配成单个细胞悬液,以台盼蓝拒染法计数后,将细胞悬液浓度调整为(2.5~5)×107个/mL,每鼠颈背皮下接种0.2 mL。细胞悬液放置于冰上,接种过程必须在细胞悬液制备后1 h 内完成。
1.3.2 ELISA检测PLA2表达 移植瘤模型待肿瘤生长至瘤体积达1 cm3后,小鼠颌下静脉取血,分离血清,处死小鼠,剥取瘤组织,选取距离肿瘤组织3 cm外的肩胛骨位置的肌肉组织作为正常组织。采用ELISA 法检测肿瘤组织、正常组织及血清中PLA2 的蛋白表达。同时取正常裸小鼠血清做平行对照。方法简述如下: 按照ELISA试剂盒说明书,向剪碎的肿瘤组织、正常组织中加入冷PBS 充分匀浆,3 500 r/min 离心15 min取上清液。将标准品稀释成系列浓度后各50 μL依次加入, 待测样品孔分别加入待测肿瘤组织、正常组织上清液和血清各10 μL, 再加样本稀释液40 μL。标准品孔和样品孔每孔加入酶标抗体100 μL, 充分混匀, 37 ℃温育60 min; 洗涤后每孔加入底物,37 ℃避光孵育15 min,加入终止液,酶标仪450 nm 波长下检测吸光度(A)值。以标准品的A 值绘制标准曲线,根据标准曲线公式计算样品cPLA2、sPLA2、iPLA2 和lp-PLA2 的含量。
2 结果
2.1 不同移植瘤模型中肿瘤组织PLA2 蛋白表达
2.1.1 肿瘤组织cPLA2 的蛋白表达 8 种不同的裸小鼠移植瘤模型中,cPLA2 在肿瘤组织中的蛋白表达均极显著高于正常组织(P<0.01)(图1)。
2.1.2 肿瘤组织sPLA2 的蛋白表达 8 种不同的裸小鼠移植瘤模型中,sPLA2 在肿瘤组织中的蛋白表达均极显著高于正常组织(P<0.01)(图2)。
2.1.3 肿瘤组织iPLA2 的蛋白表达 NCI-H1299、CNE-2、HepG2、SW1990、SGC-7901、CaES-17和HO-8910PM小鼠移植瘤模型中, 肿瘤组织iPLA2的蛋白表达均极显著高于正常组织(P<0.01),而人结直肠癌细胞HT-29 移植瘤模型中,肿瘤组织iPLA2的蛋白表达与正常组织相比差异无统计学意义(P>0.05)(图3)。
2.1.4 肿瘤组织lp-PLA2 的蛋白表达 HT-29 移植瘤组织lp-PLA2 蛋白表达显著高于正常组织(P<0.05), 其余7 种小鼠移植瘤模型中,肿瘤组织lp-PLA2的蛋白表达均极显著高于正常组织(P<0.01)(图4)。

与正常组织比较, **P<0.01图 1 裸小鼠移植瘤模型中肿瘤组织和正常组织cPLA2 的蛋白表达
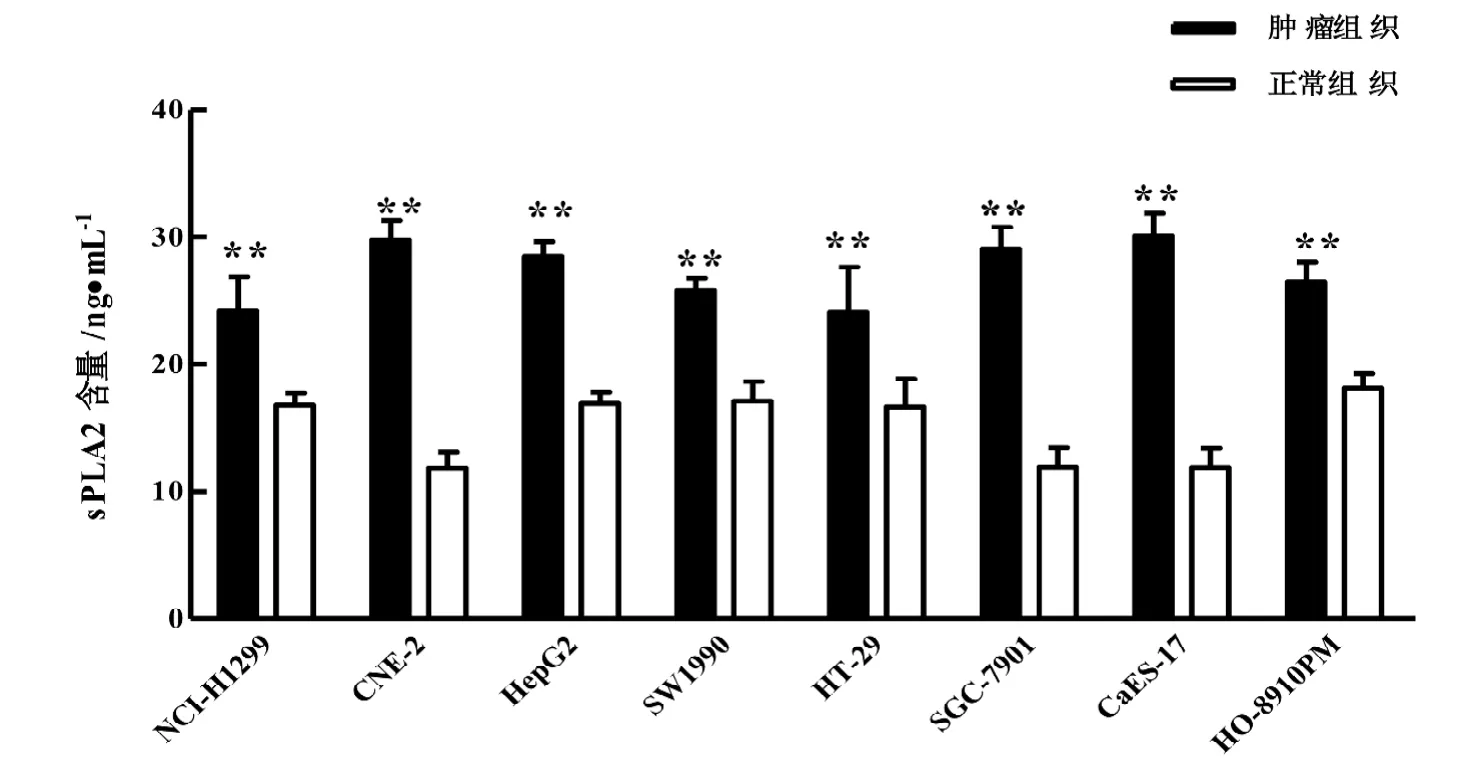
与正常组织比较, **P<0.01图 2 裸小鼠移植瘤模型中肿瘤组织和正常组织sPLA2 的蛋白表达

与正常组织比较, **P<0.01图 3 裸小鼠移植瘤模型中肿瘤组织和正常组织iPLA2 的蛋白表达

与正常组织比较, *P<0.05; **P<0.01图 4 裸小鼠移植瘤模型中肿瘤组织和正常组织lp-PLA2 的蛋白表达

表 1 裸小鼠血清中PLA2 的蛋白含量
2.2 血清中PLA2 的蛋白含量
结果显示,8 种不同的移植瘤模型中,荷瘤裸小鼠血清中4种类型PLA2的蛋白含量均极显著高于正常血清(P<0.01)(表1)。
3 讨论
研究表明[4],PLA2超家族酶类主要通过催化细胞膜的甘油磷酸脂二(sn-2)位酰基水解,产生以花生四烯酸(arachidonic acid, AA)为主的游离脂肪酸及溶血磷脂。这些脂类是细胞内生理生化通路的重要底物, 可进一步通过自分泌或旁分泌产生PG E2、白三烯(leukort iene, LT)和血栓素(thromboxane, TX)等具有生物学活性的分子。这些活性分子具有调节细胞增殖、存活、分化、运动,组织血管分布和几乎所有组织的免疫监督,而机体的这些正常功能在肿瘤发生和转移的时候均会被肿瘤细胞所逆转。因此, PLA2 通路与癌症的发生、发展之间的关系越来越受到研究者的关注。统计数据显示[13], 肺癌仍是我国发病率最高的恶性肿瘤,环境污染导致的空气质量日趋恶化,肺癌发病率每年都在升高。同样,在我国鼻咽癌已经成为呼吸系统的高发肿瘤和主要病死因素, 预后相对较差, 生存率相对较低。其病因可能与遗传、环境和EB 病毒感染等有关。随着我国人口老龄化不断加重,鼻咽癌的发病率和死亡率可能还将不断上升[14]。同时数据显示[15],我国死亡率最高的癌症依次分别是: 肺癌、胃癌、肝癌、食管癌、结直肠癌,约占所有癌症死亡人数的3/4,除了肺癌其他4种均为消化系统恶性肿瘤。并且,不良生活习惯、幽门螺旋杆菌等的感染使消化系统肿瘤的发病率一直居高不下。近年来,生活压力、环境等原因导致女性生殖系统恶性肿瘤的发病率持续升高,其中卵巢上皮癌是女性生殖器官恶性肿瘤中死亡率最高的[16]。因此,研究呼吸、消化和生殖系统肿瘤动物模型中PLA2的表达特征对PLA2与肿瘤的相关性研究具有重要的参考价值。
已知,哺乳动物基因组编码超过30 种PLA2或相关酶,主要包括cPLA2、sPLA2、iPLA2 和lp-PLA2 四大类。其中,cPLA2 共有6 个胞内酶,在结肠、小肠及肺癌组织中观察到cPLA2 高表达,同时在这些组织中检测到高表达的COX-2、LOX-2、AA 和PGE2 等。我们利用人癌细胞株接种裸小鼠诱发的呼吸系统(肺癌、鼻咽癌)、消化系统(肝癌、胰腺癌、胃癌、结肠癌、食管癌)、生殖系统(卵巢癌)的不同移植瘤模型的肿瘤组织和血清中,均观察到cPLA2 高表达,且极显著高于正常组织和正常血清。现已有研究[17,18]证实,cPLA2 通过促进结肠组织PGE2 的产生, 与受体EP2 相互作用促进结肠癌的发展。也有研究表明前列腺癌中cPLA2 的作用是激活sPLA2[19]。
sPLA2是最早发现也是PLA2超家族最大的一个分支。sPLA2 的表达和活性在乳腺癌、胰腺癌、前列腺癌、肝癌和皮肤癌肿瘤组织中均显著升高[20], 并且能通过水解磷脂产生类花生酸类物质,调控非小细胞肺癌(NSCLC)的发展[21]。可见,PLA2家族各类型酶还能通过相互作用共同参与肿瘤的发生发展。在本文构建的裸小鼠移植瘤模型中,处于对数生长期的肿瘤组织中的sPLA2 表达水平极显著高于正常组织, 且荷瘤裸小鼠血清中sPLA2 的表达水平亦极显著高于正常裸小鼠, 与cPLA2 表达特征一致。有研究者[22]还发现, 胃癌、肠癌、胰腺癌、头颈部肿瘤、肺癌等病人血清中sPLA2显著高于健康个体, 并伴随C反应蛋白(CRP)和凝血因子的显著升高,提示sPLA2 可能通过激活炎症信号参与肿瘤发生发展。
同样,多项实验研究[23,24]表明,iPLA2 参与Caspase-3 信号通路,通过启动下游事件包括PGE2 的产生,诱导炎症反应,促进化疗、放疗过程中存活的肿瘤细胞增殖,在肿瘤治疗过程中发挥重要的调控作用。而主要由成熟巨噬细胞和淋巴细胞合成和分泌的lp-PLA2一直被认为是心血管疾病的炎症标志物,研究表明其对肿瘤细胞凋亡、增殖、运动、粘附等均有影响。近来有研究发现[25],鼻咽癌细胞能诱导巨噬细胞分泌lp-PLA2,促进肿瘤细胞迁移。因此,炎症是PLA2参与肿瘤发生发展的可能机制之一。另有研究表明,lp-PLA2 的底物——血小板活化因子(PAF)有抗肿瘤生成的作用,因此lp-PLA2 可能通过酶解PAF 促进肿瘤生成[26]。已有研究报道了癌症病人肿瘤组织和血清中lp-PLA2活性[27]和mRNA水平的升高[28]。本文在裸小鼠移植瘤中同样观察到iPLA2、lp-PLA2 在肿瘤组织和血清中的高表达。
此外, 公共数据库对不同的肿瘤组织、正常组织和细胞中的蛋白表达分析结果表明[29],cPLA2、sPLA2 和iPLA2 在多种癌症的肿瘤组织中均显示高表达,显著高于正常组织。该特点没有肿瘤类型的特异性。这在本文构建的8 种不同癌症的裸小鼠移植瘤模型中得到了较好的验证。此外,分析数据库结果发现,iPLA2 在17 种癌症的肿瘤组织中均有表达且表达量差异不明显。cPLA2α在肺癌和子宫内膜癌中的表达量明显高于其他癌症。sPLA2 在前列腺癌中的表达最高,在其余类别的癌症中表达量相当。而本文构建的8种小鼠移植瘤模型由于选取的癌症类型有限、选择的肿瘤细胞株比较单一,也未对不同性别、不同生长阶段的肿瘤模型进行研究,难以反应不同癌症之间的表达差异,是本文欠缺的地方,有待在今后研究中不断完善和深入。
综上所述,PLA2 在裸小鼠移植瘤模型的肿瘤组织和血清中均呈现高表达,无肿瘤类型特异性,具备癌症临床上PLA2 的表达特点[22]。本文研究结果为在人癌裸小鼠异种移植瘤模型中研究PLA2 与肿瘤的相关性提供理论基础和实验依据。
