板栗CmWRKY基因的克隆、序列分析与原核表达
2019-09-02刘裕峰朱天辉刘应高谯天敏李姝江龙旭梅
刘裕峰,朱天辉,刘应高,谯天敏,李姝江,龙旭梅,韩 珊
(四川农业大学 林学院,四川 成都 611130)
植物已进化出各种防御机制以对抗病原微生物,在被病原体感染后,植物调节大量防御相关基因的转录表达[1]。其中,一些编码具有抗微生物特性的病原体相关蛋白,例如葡聚糖酶和几丁质酶,或参与抗微生物化合物(例如植物抗毒素)的生物合成的酶,从而有助于整体防御反应。其他基因编码在引发植物防御反应的信号转导途径中起作用的蛋白质。
在植物中,对防御相关基因的及时转录调控对于击败病原体至关重要。WRKY家族蛋白是参与植物防御反应途径调节的转录因子[2]。WRKY转录因子构成信号网络的组成部分,调节许多植物过程,如叶子衰老[3]、种子发育[4]和植物对各种胁迫的反应,如生物胁迫和非生物胁迫[5-6]。WRKY转录因子含有1个或2个保守的DNA结合区域,称为WRKY结构域[7]。WRKY结构域长约60个氨基酸残基,其N-末端含有高度保守的氨基酸基序WRKYGQK,C-末端含有非典型的锌指结构基序[8]。锌指结构是C-X4-5C-X22-23-H-X-H或C-X7-C-X23-H-X-C[9]。重要的是这2个基序对于WRKY蛋白特异性结合称为W-box的DNA序列基序(C/T)TGAC(C/T)至关重要[10],其发生在WRKY蛋白质控制下的基因启动子中。许多与防御有关的基因,包括PR基因,在其启动子区域含有W-box[9]。病原体调节和/或水杨酸(SA)调节的拟南芥WRKY基因的启动子基本上富含W-box[11],表明WRKY基因的防御调节表达涉及转录激活和通过自我调节机制介导的抑制。
使用遗传学和分子生物学方法逐渐阐明了各种WRKY转录因子的功能。越来越多的证据表明它们参与调节植物防御反应[12]。例如,病原体感染或用激素处理迅速诱导几种植物物种中的WRKY基因表达。在黄瓜中,有4个WRKY基因的表达在植株遭受镰刀菌酸(FA)处理后受到差异调节[13]。在马铃薯中,过表达StWRKY1的品系显示出对致病疫霉的抗性增强[14]。过量表达西兰花BoWRKY6的突变体表现出对霜霉病(Hyaloperonosporaparasitica)的高度抗性[15]。香蕉MaWRKY18基因可能在香蕉与病原菌(Fusariumoxysporum)互作过程中介导抗病性[16]。除了防御反应,WRKY转录因子也参与调节某些非生物应激反应。例如,在寒冷胁迫下水稻OsWRKY71过表达株系中2种冷应答基因OsTGFR和WSI76的表达升高,表明OsWRKY71是耐寒性的正调节因子[17]。WRKY基因的功能在各种植物中广泛研究。
板栗(CastaneamollissimaBL)属壳斗科(Fagaceae)栗属(Castanea)植物,世界重要的干果之一,具有较高的营养价值。然而,栗疫病(Cryphonectricaparasitica)的出现,严重阻碍了其发展。通过基因工程的手段能够提高板栗的抗病性,而WRKY转录因子在抗病过程中起着重要作用。目前为止,还未见到板栗WRKY基因的相关研究报道。本研究以板栗大红袍为研究对象,从中分离了WRKY转录因子,并对其进行生物信息学和原核表达分析,旨在为该基因表达蛋白的纯化、功能研究以及探讨该基因在板栗抗病过程中的调控作用奠定基础。
1 材料和方法
1.1 试验材料
板栗(大红袍)幼苗来自四川农业大学林学院;pMD19-T载体、反转录试剂盒购于TaKaRa公司(大连);DNA凝胶回收纯化试剂盒购于索莱宝科技有限公司(北京);质粒提取试剂盒购于天根生化科技有限公司(北京);感受态细胞DH5α及BL21(DE3)购于全式金生物技术有限公司(北京);BamH Ⅰ、XhoⅠ限制性内切酶、T4DNA连接酶购于NEB有限公司(北京);pET-28a载体由四川农业大学林木病理实验室提供。
1.2 板栗总RNA提取及cDNA合成
取100 mg健康板栗幼叶,经液氮充分研磨后,使用多糖多酚植物总RNA提取试剂盒提取总RNA,提取的RNA通过紫外分光光度法测定其浓度和纯度;板栗cDNA的合成参照TaKaRa公司反转录试剂盒说明书。
1.3 CmWRKY基因的克隆
参照板栗转录组数据库(http://www.fagaceae.org/)和NCBI中其他树种WRKY基因保守序列设计特异性引物CmWRKY-F1:5′-ATGGATACCAAA GAAGCAGAGAG-3′,CmWRKY-R1:5′-TCATCGTCGC TTGTCTTTACTT-3′。扩增反应程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min, 40个循环。使用DNA胶回收试剂盒纯化回收目的片段,回收片段与pMD19-T载体16 ℃过夜连接,连接产物转化DH5α感受态细胞,于Amp/X-gal/LB平板上进行蓝白斑筛选,随机挑取经PCR鉴定后的阳性克隆菌液,送上海美吉生物医药科技有限公司测序。
1.4 CmWRKY基因的序列生物信息学分析
通过Blast进行基因序列同源性比对分析;分别运用ProtParam和ProtScale分析其编码蛋白的理化性质和疏水性;利用ScanProsite分析编码蛋白的功能位点及功能域;通过SPOMA和SWISS-MODEL对蛋白的二级结构和三级结构进行预测;分别使用TMHMM Server v. 2.0和SignalP 4.1 Server预测编码蛋白的跨膜区和信号肽;利用MEGA 6.05绘制系统进化树。
1.5 原核表达载体的构建及鉴定
根据板栗CmWRKY基因序列设计1对引物CmWRKY-F2:5′-CGGGATCCATGGCTTTCCGGCCTCT AT-3′(下划线为BamHⅠ酶切位点),CmWRKY-R2:5′-CCGCTCGAGTCAAGGGCATTCTTTCTCA-3′(下划线为XhoⅠ酶切位点)。以pMD19T-CmWRKY质粒为模板,进行PCR扩增,反应程序同1.3。PCR产物经1%琼脂糖凝胶电泳检测后,纯化回收目的片段。使用BamH Ⅰ和XhoⅠ内切酶分别酶切目的片段与pET-28a载体,酶切产物回收后16 ℃连接12 h。重组质粒pET28a-CmWRKY转化BL21(DE3)感受态细胞,经卡那抗性筛选后,挑取单菌落于LB液体培养基扩增培养后进行PCR鉴定,提取阳性菌液质粒,经BamH Ⅰ 和XhoⅠ 双酶切鉴定后,送上海美吉生物医药科技有限公司测序。
1.6 CmWRKY蛋白的诱导表达
将pET28a-CmWRKY-BL21(DE3)单菌落接种于LB液体培养基(含Kan,100 μg/mL)中,于37 ℃、180 r/min振荡培养12 h。菌液扩增培养(V/V,1∶100),当菌液OD600值约为0.6~0.8时,进行蛋白的诱导表达。以终浓度为0.2,0.4,0.6,0.8,1.0 mmol/L IPTG诱导6 h,收集1 mL菌液进行SDS-PAGE电泳检测,筛选最优IPTG诱导浓度;以上述最优IPTG浓度分别进行2,4,6,8,10 h不同时间长度的诱导,筛选最优诱导时间长度;最后,分别以25,30,37 ℃进行诱导表达,筛选最优诱导温度。以上述最优条件诱导表达CmWRKY蛋白,吸取1 mL菌液,12 000 r/min室温离心10 min收集菌体,加入60 μL PBS Buffer(pH值7.4)重悬后,再次加入适量溶菌酶,利用液氮反复冻融6~8次,12 000 r/min 4 ℃离心20 min。分别收集上清和沉淀(用8 mol/L尿素4 ℃螯合30 min)。加入20 μL 4×Protein sds-page loading Buffer混匀,煮沸10 min,冷却后12 000 r/min 4 ℃离心10 min,取10 μL上清进行蛋白电泳检测。
2 结果与分析
2.1 板栗CmWRKY基因克隆
以板栗幼苗叶片cDNA为模板进行PCR扩增,核酸电泳检测显示,在约1 500 bp位置处可见1条清晰的条带(图1)。该条带纯化回收后,与pMD19-T载体连接,转化产物经过菌落PCR筛选阳性克隆,将鉴定的阳性克隆进行测序。测序结果通过生物信息学验证,发现获得1 437 bp的CmWRKY基因片段。

M. DL2000;1. 以cDNA为模板的PCR产物。M. DL2000; 1. PCR product of cDNA.
2.2 板栗CmWRKY基因的核苷酸序列分析
DNAMAN序列分析表明,该基因的开放阅读框(ORF)为1 437 bp,编码479个氨基酸(图2),将其核苷酸序列提交GenBank,基因登录号:KY312850.1。BlastN比对结果显示,该序列与巴旦木(Prunuspersica)等植物的WRKY基因一致性均在80%以上,其中与西班牙栓皮栎(Quercussuber)WRKY基因一致性最高,达到97%,表明CmWRKY基因属于板栗WRKY基因家族成员。
2.3 板栗CmWRKY蛋白的氨基酸序列分析
使用在线工具ExPASy ProtParam对CmWRKY蛋白质序列进行相关信息分析,结果表明:CmWRKY蛋白分子式为C2242H3589N675O734S12,分子质量为52.128 96 ku;理论等电点为9.15;在组成CmWRKY蛋白的所有氨基酸中,丙氨酸(Ala)比例最高,占总氨基酸量的7.1%,蛋氨酸(Met)和色氨酸(Trp)比例最低,均为总氨基酸量的0.6%;其含有53个负电性氨基酸残基(Asp+Glu),66个正电性氨基酸残基(Arg+Lys);脂肪族氨基酸指数60.17,总平均疏水指数-0.872,属于亲水性蛋白。在线工具Motif发现,CmWRKY蛋白序列含有2个WRKY保守结构域,2个C2H2锌指结构域(C-X4-C-X22-23-H-X-H),属于WRKY家族的第Ⅰ组(图2),BlastP分析进一步表明其属于WRKY家族(图3)。利用Clustal X1.81和ESPript 3.0软件对CmWRKY及与其具有较高一致性的同源基因进行氨基酸序列上的比对分析,结果如图4所示,CmWRKY与西班牙栓皮栎(Quercussuber)、核桃(Juglansregia)、哥伦比亚锦葵(Herraniaumbratica)及可可树(Theobromacacao)WRKY功能区域的氨基酸序列高度保守,C2H2锌指结构域也较为保守,推测CmWRKY与其高度同源的基因在调控特定的基因中发挥着相似的功能。

灰色区域.WRKY转录因子的特征序列WRKYGQK;下划线.锌指结构域C2H2,其中C和H残基用方框标出;*.终止密码子。The grey region. Characteristic sequence WRKYGQK of the WRKY transcription factor; The underlined portion zinc finger domain C2H2, wherein the C and H residues are indicated by boxes; *.The stop codon.

图3 CmWRKY蛋白保守功能域Fig.3 The conserved domains of WRKY protein

图4 CmWRKY与其他植物WRKY蛋白质序列多重对比Fig.4 Multiple alignment of the deduced protein of CmWRKY with other plant WRKY proteins
2.4 板栗CmWRKY蛋白的结构预测
在线软件SignalP 4.1 Server对CmWRKY蛋白的氨基酸序列进行分析,发现CmWRKY蛋白不含信号肽,不属于分泌型蛋白。通过TMHMM Server v.2.0预测CmWRKY蛋白跨膜区域,结果表明,该蛋白不含跨膜区域。利用SOPMA软件分析,发现CmWRKY蛋白二级结构中,不规则卷曲结构(Random coil)所占比例最大,为73.01%;α-螺旋(Alpha helix)次之,为12.55%;延伸链结构(Extended strand)比例为11.09%;β-转角(Beta turn)最少,仅为3.35%(图5)。CmWRKY蛋白的三级结构分析表明,该转录因子的WRKY结够域与AtWRKY1非常相似[18](图6),推测CmWRKY蛋白可能具有与AtWRKY1相类似的调控功能。同时,其结构域主要由4个β-折叠组成,依次为β-折叠1:WRKYGQK;β-折叠2:RSYYKC;β-折叠3:KKKVER;β-折叠4:AEIVYK。

最长竖线.α-螺旋;第2长竖线.延伸链;第3长竖线.β-转角;最短竖线.无规则卷曲;横向数值.氨基酸位置。The longest vertical bars.α-helix; The second longest vertical bars. Extended strand; The third longest vertical bars. Beta turn; The shortest vertical bars. Random coil; The horizontal numbers .The position of amino acid.
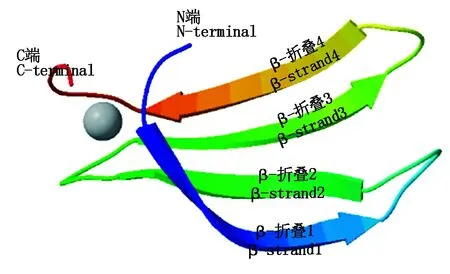
β-折叠1.WRKYGQK;β-折叠2.RSYYKC;β-折叠3.KKKVER;β-折叠4.AEIVYK。β-strand1. WRKYGQK; β-strand2.RSYYKC; β-strand3.KKKVER; β-strand4.AEIVYK.
2.5 板栗CmWRKY蛋白的同源进化分析
为了解CmWRKY蛋白和其他植物WRKY蛋白之间的进化关系,利用系统进化分析软件Mega 6.05,通过邻接法(Neighbor-Joining)方法构建CmWRKY与NCBI数据库中29种植物WRKY的系统进化树(图7)。系统进化树分析结果显示,蔷薇目(Rosales)、金虎尾目(Malpighiales)、锦葵目(Malvales)、无患子目(Sapindales)-(芸香科,Rutaceae)、壳斗目(Fagales)-(壳斗科,Fagaceae)植物分别聚集在一起;其中,蔷薇目下的榆科(Ulmaceae)、蔷薇科(Rosaceae)及豆科(Fabaceae)植物又分别聚集在一起,相比豆科植物,榆科植物与蔷薇科植物亲缘关系更近;金虎尾目下的大戟科(Euphorbiaceae)植物聚集在一起。同时,葡萄(Vitisvinifera)和猕猴桃(Actinidiachinensis)由于均为藤本植物而聚集在一个分支。这些结果都符合植物的生物进化规律。
板栗与同为壳斗科的西班牙栓皮栎亲缘关系最近,其次为核桃,与芸香科植物亲缘关系也较近。这与CmWRKY和它们之间的氨基酸序列同源性较高相符合。

图7 Neighbor-joining(NJ)方法构建CmWRKY蛋白与其他植物WRKY蛋白的系统进化树Fig.7 Phylogenetic tree between CmWRKY protein and other plant WRKY protein by Neighbor-Joining(NJ)method
2.6 原核表达载体的构建及鉴定
带酶切位点的板栗CmWRKY基因片段和pET-28a载体经BamH Ⅰ和XhoⅠ酶切后,回收酶切产物,产物通过T4DNA连接酶构建重组表达载体,转化大肠杆菌BL21(DE3)。提取阳性菌液重组质粒,通过双酶切鉴定可见预期大小的片段(图8)。测序结果进一步表明,pET28a-CmWRKY原核表达载体构建成功。

M.DL5000;1.重组质粒pET28a-CmWRKY双酶切产物;2.重组质粒pET28a-CmWRKY。M.DL5000; 1.Double enzyme product of pET28a-CmWRKY; 2.pET28a-CmWRKY plasmid.
2.7 pET28a-CmWRKY-BL21(DE3)的诱导表达及条件优化
为进一步CmWRKY蛋白的功能研究提供试验基础,对该蛋白进行原核诱导表达。
IPTG浓度对CmWRKY蛋白表达的影响。选择0.2,0.4,0.6,0.8,1.0 mmol/L 5个不同的IPTG浓度,在37 ℃下诱导6 h,经SDS-PAGE电泳分析显示(图9-A),在各IPTG浓度下均能诱导表达出一条预期大小的融合蛋白,分子质量约为56 ku(CmWRKY蛋白52 ku+His-tag标签蛋白4 ku),且对照组均无目的蛋白表达,但不同IPTG浓度间表达量无明显差异。以0.2 mmol/L IPTG作为最优诱导浓度。
诱导时间对CmWRKY蛋白表达的影响。pET28a-CmWRKY-BL21(DE3)分别诱导2,4,6,8,10 h。结果显示,不同诱导时间长度对该蛋白的表达量影响较为明显,随时间的增加,CmWRKY蛋白的表达量逐渐增加,在10 h蛋白的表达量达到最大(图9-B)。因此,选择诱导10 h作为最优诱导时间。
诱导温度对CmWRKY蛋白表达的影响。pET28a-CmWRKY-BL21(DE3)加入0.2 mmol/L IPTG分别在25,30,37 ℃下诱导10 h。结果显示(图9-C),25 ℃诱导条件下几乎无目的蛋白产生;30 ℃诱导条件下有目的蛋白产生且主要以可溶性蛋白的形式存在;37 ℃条件下诱导的目的蛋白可溶性量较少,主要以包涵体的形式存在。因此,选择30 ℃作为pET28a-CmWRKY-BL21(DE3)最优诱导温度。
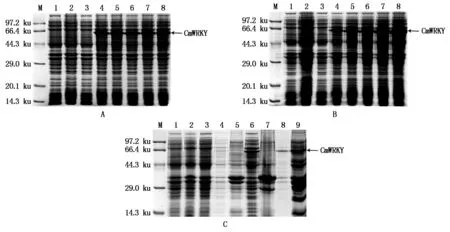
M. 蛋白质分子量标准;A. IPTG诱导浓度的优化:1. pET28a-BL21(DE3)未诱导;2. pET28a-BL21(DE3)诱导(0.6 mmol/L IPTG)6 h; 3-8. 终浓度为0,0.2,0.4,0.6,0.8,1.0 mmol/L IPTG;B. 诱导时间的优化:1. pET28a-BL21(DE3)未诱导;2. pET28a-BL21(DE3)诱导(0.2 mmol/L IPTG)6 h;3-8. 诱导0,2,4,6,8,10 h;C. 诱导温度的优化:1. pET28a-BL21(DE3)未诱导;2. pET28a-BL21(DE3)诱导(0.2 mmol/L IPTG)10 h;3. 未诱导;4. 25 ℃诱导上清;5. 25 ℃诱导沉淀;6. 30 ℃诱导上清;7. 30 ℃诱导沉淀;8. 37 ℃诱导上清;9. 37 ℃诱导沉淀。
M. Protein Marker; A. Optimization of IPTG induced concentration: 1. pET28a-BL21(DE3)without IPTG induction; 2. pET28a-BL21(DE3)was induced for 6 h(0.6 mmol/L IPTG); 3-8. pET28a-CmWRKY-BL21(DE3)was induced by 0, 0.2, 0.4, 0.6, 0.8, 1.0 mmol/L IPTG; B. Optimization of induction time: 1. pET28a-BL21(DE3)without IPTG induction; 2.pET28a-BL21(DE3)was induced for 6 h(0.2 mmol/L IPTG); 3-8. pET28a-CmWRKY-BL21(DE3)was induced for 0, 2, 4, 6, 8, 10 h; C. Optimization of induction temperature: 1. pET28a-BL21(DE3)without IPTG induction; 2. pET28a-BL21(DE3)was induced for 10 h(0.2 mmol/L IPTG); 3.pET28a-CmWRKY-BL21(DE3)without IPTG induction; 4.Supernatant of pET28a-CmWRKY-BL21(DE3)was induced at 25 ℃; 5.Precipitate of pET28a-CmWRKY-BL21(DE3)was induced at 25 ℃; 6.Supernatant of pET28a-CmWRKY-BL21(DE3)was induced at 30 ℃; 7.Precipitate of pET28a-CmWRKY-BL21(DE3)was induced at 30 ℃; 8.Supernatant of pET28a-CmWRKY-BL21(DE3)was induced at 37 ℃; 9.Precipitate of pET28a-CmWRKY-BL21(DE3)was induced at 37 ℃.
图9 重组表达质粒pET28a-CmWRKY诱导条件的优化
Fig.9 Optimization of induction condition of pET28a-CmWRKYplasmid
3 结论与讨论
植物中WRKY蛋白基于存在的WRKY结构域的数量和锌指的类型,WRKY蛋白质已被分类为Ⅰ、Ⅱ和Ⅲ组,具有2个WRKY结构域的WRKY蛋白质属于第Ⅰ组,具有一个WRKY结构域的蛋白质基于锌指基序的特征属于第Ⅱ组或第Ⅲ组[19]。通过氨基酸序列分析,本研究所克隆的CmWRKY蛋白具有2个WRKY结构域和2个锌指结构,属于第Ⅰ组。CmWRKY三级结构以AtWRKY1蛋白为模板同源建模获得,Duan等[18]发现在AtWRKY1中,转录因子AtWRKY1与DNA的结合能力是由β2与β3之间的β折叠区域决定的,推测其与拟南芥AtWRKY1蛋白具有相似的功能。Agarwal等[20]研究发现,WRKY结构域由4条β-折叠组成,锌配位Cys/His残基形成锌结合口袋,而本研究获得的CmWRKY三级结构,也由4条β-折叠组成,与其研究结果一致。系统进化分析表明,CmWRKY蛋白与其他物种间的WRKY蛋白同源性较高,与同为壳斗科的西班牙栓皮栎亲缘关系最近,其次为核桃,聚集为一个分支。西班牙栓皮栎QcWRKY蛋白功能未见相关报道,核桃JrWRKY4参与低温胁迫反应[21],推测CmWRKY可能也参与低温胁迫的生理过程。
为进一步研究板栗CmWRKY蛋白的生物学功能,利用基因工程技术构建了pET28a-CmWRKY原核表达载体,转入BL21(DE3)后进行原核表达,获得了分子质量约为56 ku的目的蛋白,比预测分子质量略大,主要是由于His-tag标签序列造成的[22]。大肠杆菌作为常用的原核表达系统,除了选择合适的载体和表达菌株之外,IPTG浓度、诱导时间及诱导温度等培养条件对其蛋白表达也具有较大的影响[10]。本研究也从这3个方面对CmWRKY蛋白的诱导表达进行优化,以期获得最大量的目的蛋白。SDS-PAGE分析显示,不同IPTG浓度下均能诱导表达出预期大小的融合蛋白,且不同诱导浓度间表达量并无差异,而低浓度IPTG诱导有助于可获得较多的可溶性蛋白[10],因此,选择低浓度IPTG(0.2 mmol/L)诱导。随着诱导时间的增加,CmWRKY蛋白表达量 逐渐增加,在10 h时表达量达到最大。本研究发现,CmWRKY蛋白在较高温度(37 ℃)诱导下,主要以包涵体的形式存在。研究表明,高温条件下,蛋白表达过快,不能正常折叠,容易形成包涵体[23]。但在较低温度(25 ℃)诱导下,几乎无目的蛋白产生,可能是温度过低的原因。而在30 ℃诱导温度下,CmWRKY蛋白主要以可溶性蛋白的形式存在。因此,利用大肠杆菌表达系统,在30 ℃,0.2 mmol/L IPTG诱导表达菌株10 h能获得最大量的可溶性CmWRKY蛋白。
本研究成功从板栗中克隆了一个CmWRKY基因,其氨基酸序列中含有2个WRKY保守结构域和2个C2H2锌指结构域,属于WRKY家族的第Ⅰ组。利用多种生物信息学软件分析了CmWRKY基因的同源性、蛋白质结构、系统进化等相关信息。初步探索了CmWRKY基因的原核表达情况,为其蛋白功能研究奠定了基础,也为揭示该基因在板栗抗病过程的分子调控打下基础。
