神经内分泌前列腺癌的临床特征及诊治(2例报告并文献复习)
2019-08-31程嘉豪金大春张唯力
程嘉豪 金大春 张唯力
重庆医科大学附属第二医院泌尿外科(重庆 400010)
神经内分泌前列腺癌(neuroendocrine prostate cancer,NEPC)与普通前列腺癌的临床特征完全不同,发病率低,恶性程度高,易于早期转移且较少伴有PSA升高。近年来随着新型雄激素受体(androgen receptor,AR)途径抑制剂阿比特龙、恩杂鲁胺等的开发应用,前列腺癌伴神经内分泌分化 (neuroendocrine differentiation,NED)或去势后NEPC (treatment-emergent NEPC,t-NEPC)的比例逐渐增加。现报告我院2017年收治的2例NEPC病例,并结合文献将该病的流行病学特点、临床表现、病理特征、诊治方案及预后进行总结,为临床医师诊治该病提供参考。
病例报告
例1,男,81岁,因“进行性排尿困难半年,加重伴尿痛1周”于2017年4月22日入院。半年前患者出现排尿困难,尿线变细,伴尿频、夜尿增多,1周前上述症状加重伴明显尿痛,无肉眼血尿、畏寒发热等不适,余病史无特殊。直肠指诊示前列腺II°增大,表面光滑,质韧无压痛,边缘清楚,中央沟消失,退指无血迹。tPSA:7.09ng/mL,fPSA:2.60ng/mL,fPSA/tPSA:0.37, 睾 酮 :77.70ng/dL。泌尿系彩超:左肾结石;前列腺增生,大小约5.0cm×5.4cm×3.8cm;膀胱壁不规则增厚。胸片:侧位片上胸椎及心影后方可疑斑片影;右上肺少许陈旧灶。患者完善检查后考虑前列腺增生,行TURP术,术中见12点方向前列腺组织呈分叶状凸向膀胱腔内,电切见局部组织异常,呈碎渣样、絮状改变,质脆易出血。术后病理:前列腺伴NED的低分化腺癌,Gleason评分5+5=10 分 (图 1)。 免疫表型:PSA、NSE、HCK、P63、EMA、Vim、LCA、CerbB-2 阴性;P504S(局灶 +)、Ki-67(20%+)、P53 阳性;Syn、CgA、PSAM、80%CK、LCK 中度阳性;AR强阳性。患者术后规律予以氟他胺、亮丙瑞林去势治疗,去势治疗8个月后,患者突发持续严重肉眼血尿,予以止血输血、持续膀胱冲洗等对症治疗无缓解,后反复行经尿道膀胱血凝块清除术,平均每次冲洗出血凝块350mL,期间并行前列腺动脉栓塞止血术,术后患者仍有活动性出血,血Hb进行性下降,血尿素肌酐、血钾反复波动后持续上升,最终在2018年5月1日死于晚期肿瘤合并全身多器官功能衰竭,生存时间为12个月。
例2,男,68岁,因“左骶尾部伴肛门疼痛1月余”于2017年11月29日入院。患者于1个月前出现左侧骶尾部及肛门疼痛,无肉眼血尿、排尿困难等不适。患者有高血压、冠心病、2型糖尿病和脑梗塞病史,余病史无特殊。直肠指征示前列腺II°增大,表面凹凸不平呈结节感,左侧较为突出并压迫直肠,质硬无压痛,边缘不清,中央沟消失,退指无血迹。tPSA:0.38ng/mL,fPSA:0.04ng/mL,fPSA/tPSA:0.11,睾酮:92.10ng/dL。 胸 + 全腹部CT:左肺上叶舌段钙化灶;前列腺增生伴钙化,局部与左侧精囊、直肠前壁分界不清,左侧精囊不规则增大。盆腔MRI:前列腺左侧外周带占位,大小约33.5mm×37.1mm×39.1mm,考虑前列腺癌伴邻近移行带受侵可能,肿块右侧缘与临近直肠分界欠清,直肠受侵不除外。右侧精囊萎缩,左侧精囊受压阻塞可能。盆腔未见明显肿大淋巴结及积液(图3)。ECT:未见肿瘤骨转移征象。患者完善检查后行B超引导下前列腺穿刺活检术。术后病理:神经内分泌癌(图2)。免疫表型:PSA、P504S、CKH、LCA、CD3、CD20、CK、S-100 阴 性 ,CgA、Syn 弱阳性;P63、EMA 部分(+)阳性;NSE、KI-67(70%+)、CD99阳性;CD56中度阳性。患者分别于2017.12.19、2018.01.15予以EP方案化疗:依托泊苷(110mg,D1-3)+顺铂(130mg,D1),28d为 1个周期。 2个周期化疗后,患者诉骶尾部疼痛较前好转,复查头+胸+上腹部CT未见肿瘤相关异常。盆腔MRI:前列腺肿物较前稍增大,大小约37.7mm×44.7mm,左侧精囊腺及直肠受侵可能;右侧精囊腺未见显示(图4)。ECT:未见肿瘤骨转移征象。tPSA:0.31ng/mL,fPSA:0.04ng/mL,fPSA/tPSA:0.13,睾酮:121.00ng/dL。复查结果示化疗效果欠佳,建议患者行前列腺癌根治术,患者拒绝手术治疗,后于2018年3月16日行超声引导下前列腺粒子置入术。现带瘤生存,规律随访。
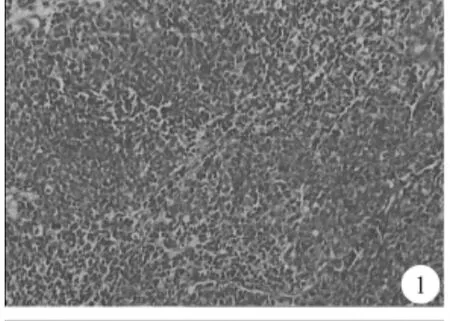
图1 例1前列腺伴NED的低分化腺癌(HE×40);

图2 例2神经内分泌前列腺癌(HE×40);
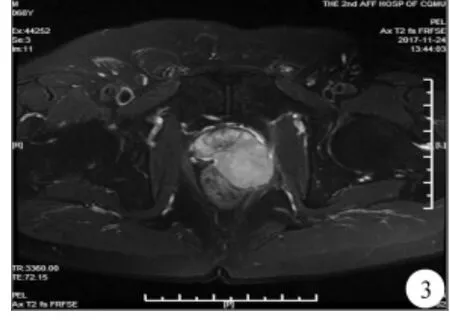
图3 例2化疗前盆腔MRI;

图4 例2化疗后盆腔MRI
讨 论
一、流行病学特点
NEPC临床罕见,检索Pubmed、Embase及Cnki等国内外数据库,全球近20年报道不足400例,其中最常见的是前列腺癌伴NED,恶性程度最高的小细胞癌占比小于1%[1]。NEPC中位生存时间仅10个月,5年总生存率为12.6%[2]。最新2016年第4版《泌尿系统和男性生殖器官肿瘤WHO分类》中NEPC的病理学分型如下:(1)前列腺腺癌伴NED;(2)腺癌伴潘氏细胞样NED;(3)类癌;(4)小细胞癌;(5)大细胞癌[3]。 10%~100%前列腺腺癌中均存在少量神经内分泌 (neuroendocrine,NE)细胞[4],其中5%~10%腺癌可见大量单个的或呈簇巢状分布的癌性NE细胞,可诊断前列腺癌伴NED。由癌性NE细胞组成,具备NE肿瘤特定结构且表达NE标记的肿瘤,可诊断为小细胞癌、类癌或大细胞癌。本文例1即属前列腺腺癌伴NED;例2分型未明,结合病理特征及免疫表型,考虑小细胞癌可能性大。
NEPC的细胞来源尚不清楚。有学者提出其源自于正常NE细胞发生致癌性突变,但更多学者认为NEPC(t-NEPC)是前列腺腺癌细胞通过遗传或表观遗传失调向NED谱系的转分化,且NED程度与肿瘤侵袭性、疾病进展和不良预后相关[5]。
二、临床表现
NEPC多发生于老年人,平均年龄69.3岁[6],亦有低龄患者报道。与普通前列腺癌类似,NEPC临床表现不典型,随病程进展可出现会阴不适、尿路刺激征、排尿困难或血尿等症状,但患者PSA往往正常或轻度升高,极易误诊为前列腺增生或慢性前列腺炎。不同的是,NEPC早期便发生肝、骨、肺、淋巴结及中枢神经系统转移,部分患者还可因肿瘤细胞分泌激素而出现副肿瘤综合征,如Cushing综合征、高钙血症、重症肌无力或异常分泌抗利尿激素、甲状旁腺激素等[7]。本文例1即是以排尿困难症状就诊,考虑前列腺增生,行TURP术治疗后偶然发现肿瘤,中位生存时间窗附近出现严重血尿,与文献报道相符;例2出现左骶尾部及肛门疼痛,考虑肿瘤早期侵及直肠及周围神经所致。
三、病理特征及诊断
NEPC主要依靠病理特征及免疫表型进行诊断。与其他来源的小细胞癌类似,光镜下前列腺小细胞癌缺乏腺癌腺泡结构,呈片巢状分布,可有凝固性坏死区,肿瘤细胞呈小圆形或短梭形,核质比高,几乎裸核,细胞边界模糊,核染色较深而核仁不明显,核分裂象和挤压现象常见[8]。50%~60%病例以纯小细胞癌的形式发生,构成单纯NEPC的主要类型,亦可与腺癌同时发生。而类癌胞质则相对丰富,核分裂象少,无肿瘤坏死现象,常与腺癌并存。大细胞癌主要由巨大的瘤细胞巢构成,巢周围呈栅栏状、花环状排列,常伴地图状坏死,肿瘤细胞大,呈圆形或椭圆形,胞质丰富,嗜双色性,核染色深但核仁明显,核分裂象常见[9]。混合型NE癌同时存在NE肿瘤(小细胞癌、类癌或大细胞癌)和腺癌两种甚至更多组分,组分间转变比较明显。
光镜下小细胞癌与Gleason 5级腺癌形态学上有重叠,可根据免疫表型将其鉴别。PSA、PSAP、PSMA、P501S、P504S等是经典前列腺腺癌标记,即使在低分化腺癌中亦有广泛表达,而NEPC不表达或仅局灶性表达。 NEPC 主要表达 NSE、CgA、Syn、CD56、TTF-1等标记,文献报道上述标记阳性率分别为85%、80%、85%、92%、83%,而低分化腺癌则不表达,少数混合癌PSA、PSAP可呈阳性[10,11]。本文2例免疫表型符合文献报道。通过形态学和免疫表型仍难确定分型的病例,推荐采用“具有小细胞癌和腺泡性腺癌重叠特征的前列腺癌”来命名。
NEPC的临床诊断与普通前列腺癌大体类似,主要包括直肠指征及影像学检查(泌尿系彩超、盆腔CT和MRI等),但上述检查并不具备影像学诊断特异性,最终均需依靠病理特征及免疫表型进行确诊。
四、治疗方式
NEPC临床罕见,现有治疗方案是从少数病例报道中获得的,有效性和安全性尚难确立。对早期或局限病例应按侵袭性肿瘤处理,行前列腺癌根治术并结合术后放化疗,即使有局部浸润也应行根治性或姑息性手术[12]。Tamas等对16例局限混合型NEPC患者行根治术并结合放化疗,无进展生存期达46个月[13]。但多数患者就诊时已有淋巴结或远隔器官转移,仅能行姑息性减瘤治疗,手术联合放化疗应成为此类患者的首选治疗方式。
国内研究发现化疗与患者生存期关系密切,接受化疗与未行化疗的1年生存率分别为50%和9%[14]。以铂类为基础的化疗(依托泊苷/多西他赛+铂类)是首选治疗方案[1],但有效持续时间较短,很快出现耐药及疾病进展。本文例2即采用依托泊苷+顺铂方案化疗,但获益甚微,需联合其他治疗方式改善患者预后。在一项II期研究中,12例患者采用“多西他赛+卡铂”和“依托泊苷+顺铂”的循环化疗方案,中位生存期达16个月[15]。1例腺癌/小细胞癌混合并伴有骨盆、淋巴结转移的患者,联合应用去势治疗、化疗(依托泊苷+顺铂6个疗程)及放疗,临床缓解达36个月[16],凸显出多学科联合治疗的优越性。
放射治疗可控制转移性NEPC的局部症状,常与化疗联用,但其有效性受到一定质疑。文献指出对术后病检切缘阳性或pT3患者应予以放射治疗[17]。常规计量为45~55Gy,根据前列腺体积进行调整。亦有学者指出对非转移性NEPC患者,手术根治能显著改善患者生存期,但放疗无保护作用;而对转移性病例,无论采取手术或放疗,均无法显著改善患者预后[6]。
是否行去势治疗应由肿瘤病理类型定夺。研究发现手术或去势治疗参数的变化与患者生存期均无明显关联[14],但临床上仍建议对混有腺癌成分的病例行去势治疗。大多数前列腺癌初期均对去势治疗有效,但经过中位时间12~18个月后,几乎所有病例都将进展为去势抵抗性前列腺癌,其中包括25%~30%的t-NEPC[18]。去势治疗是导致癌细胞发生NED最主要的导火索[19-21]。去势后癌细胞通过转分化或克隆选择过程增强组织NED,转分化为AR(-)的癌细胞表现出对AR通路抑制的适应性,在p53和Pten共同突变失活的背景下,MYCN和AURKA大量表达扩增,并与表观遗传因子SOX2、EZH2协同作用,共同诱导前列腺腺癌细胞转分化为癌性NE细胞。而经过去势治疗的克隆选择过程,大量腺癌细胞凋亡,AR(-)的癌性NE细胞存活并继续增殖,通过表达激活不同途径和生物过程的神经肽促进剩余肿瘤细胞雄激素非依赖性生长和侵袭转移。
考虑到去势治疗对腺癌细胞NED的潜在诱导作用,故建议去势治疗前先行予以化疗[21]。本文例1患者术后仅行去势治疗,忽视了化疗的重要性,这是导致肿瘤进展时间缩短的重要因素。间歇性去势治疗可用于前列腺癌患者,以延迟去势治疗抵抗引起的NED和肿瘤进展时间[22]。治疗期间应定期复查血清PSA及NE标记,对PSA较低而NSE、CgA、Syn升高者应高度警惕NED或t-NEPC发生。单纯NEPC(小细胞癌、类癌、大细胞癌)不表达AR及PSA,去势治疗不会使肿瘤细胞进入凋亡状态,去势治疗对其无效[23]。
针对NEPC的分子靶向治疗是当今研究热点,其治疗机制主要包括三个方面:(1)通过阻断NEPC发生的基因组改变和分子途径阻止其诱导;(2)选择性靶向杀伤癌性NE细胞;(3)通过抑制癌症干细胞获得或逆转转分化过程,将癌性NE细胞恢复至AR敏感状态。实验证实N-myc和AURKA协同诱导前列腺癌的NED[18],MYCN基因过度表达并进一步激活PARP1,PARP2,BRCA1,RMI2和 TOPBP1。 使用 AURKA 抑制剂 Danusertib(PHA 739358)或 Alisertib(MLN8237)可破坏AURKA-MYCN复合物以抑制MYCN依赖性转录,从而特异性抑制癌性NE细胞生长及NE标记表达[24,25]。癌性NE细胞靶向研究主要集中在SSTR受体领域。大多数NE肿瘤表达SSTR2,故针对SSTR2具有高亲和力的生长抑素类似物(奥曲肽、帕瑞肽和兰瑞肽等)被用于NEPC的治疗[26]。其不仅作用于癌细胞,还能影响癌细胞周围微环境,抑制血管生成,促进细胞凋亡。生长抑素类似物中加入放射性标记,可通过局灶微环境放疗效应增强抗肿瘤作用。靶向癌症干细胞获得或逆转转分化过程也能阻止NEPC的诱导。前列腺癌干细胞表现出乙醛脱氢酶(ALDH)的高度活性,用ALDH抑制剂双硫仑可抑制ALDH活性并使迫使其重获上皮细胞性状,降低其恶性程度及治疗抗性[27]。普通前列腺癌到NEPC的转分化与表观遗传因子EZH2的上调密切相关,抑制EZH2可逆转转分化过程,增加细胞AR表达减少NED,现有EZH2抑制剂包括GSK2816126和tazemetostat等[28,29],然而其疗效仅在淋巴瘤、CRPC等实验阶段获得证实,对NEPC的疗效尚待探索。
五、预后
NEPC预后主要取决于NE肿瘤的成分及比例,而与血清PSA和腺癌成分关系不大[14]。研究发现NSE、CgA与肿瘤的雄激素非依赖、进展及预后相关,但NSE和CgA间无相关性,是NEPC的独立预后因素[30]。NED程度越高,血清NSE、CgA、Syn表达就越强,而PSA无明显变化。考虑到PSA在NEPC诊断及预后的局限性,故有学者建议将血清NSE、CgA、Syn代替 PSA作为NEPC术后复发转移和病情监测指标。
通过对国内外文献报道的复习,结合我院NEPC患者的临床资料,我们有如下体会:(1)NEPC是一种罕见的高度恶性肿瘤,细胞来源尚有争议;(2)NEPC缺乏特异性临床表现,早期即易发生转移,误诊概率较大;(3)NEPC的诊疗方案有待统一,早期诊断并采取手术结合放化疗的多学科综合治疗可提高患者生存率。近年来许多国内外学者致力于NEPC多种基因与信号转导途径的探索,未来从分子机制抑制、逆转肿瘤NED进程将有望改善NEPC患者的临床结局。
