犬左室三层细胞的分离和电生理记录*
2019-08-31纪荣静赵永辉藏小彪张静王现青马继芳宋卫峰
纪荣静 赵永辉 藏小彪 张静 王现青 马继芳 宋卫峰
随着膜片钳技术的逐渐推广和心肌细胞电异质性等研究领域的发展,心肌细胞已成为各类心血管疾病结构重构和电重构机制研究的重要部分。尤其是对犬等大型动物的心肌细胞的电生理特性的研究越来越多,也越来越精细。目前分离的犬心房肌细胞即刻存活率为80%~90%,复钙至1.0 mmol/L KB液中静置72 h存活约70%左右[1-2];分离犬心室肌细胞即刻存活率为60%~80%[3-4],复钙后存活40%~60%。成功分离出高活性和高产量的犬心室肌三层心肌细胞并使其保持良好状态是决定整个实验成败的核心环节。因此,寻求一种简单、经济、高效的分离和鉴别大型动物心肌细胞的方法已成为当务之急。笔者借鉴前人的经验,根据文献[3,5]的方法对实验装置、灌流液成分、酶液成分及消化时间的判断等方面加以改进,摸索出简单、高效的分离方法,并应用全细胞膜片钳技术对正常和肥厚左室三层心肌细胞动作电位(AP)内、外向离子流进行研究,旨在为研究治疗哺乳类动物心血管疾病的新型药物提供理论基础。
1 材料与方法
1.1实验动物
成年健康比格犬15只,体重12 ~15 Kg,由南京亚东实验动物研究中心提供,编号:NO.201708679。
1.2主要试剂
Ⅱ型胶原酶(collagenease type Ⅱ-Gibco 17101-015 315.00 uints/mg)为Gibco Biochemical公司产品,HEPES(4-羟乙基哌嗪乙磺酸,J3015)为Santa cruz Biotechnology公司产品,Mg-ATP(SLBR2781V)、Na2-ATP(A1852)、K-Gluconate(110M0003V)、Phosphocreatine disodium salt(磷酸肌酸二钠盐P7936)、Nifedipine(N7634)、TEA-Cl(氯化四乙胺T2265)、多聚赖氨酸(polylysine SLBV1703)、Taurine(牛磺酸,SLBS2001V)、EGTA(乙二醇二乙醚二胺四乙酸,SLBR7504)均为Sigma Biochemical公司产品,其他试剂均为国产分析纯。
1.3溶液配制(单位:mmol/L)
无钙Tyrode′s液:NaCl 137.0、KCl 5.4、HEPES 20.0、MgCl2·6H2O 1.2、NaH2PO4·2H2O 1.2、Glucose 10.0、Taurine 10.0,用NaOH调节批pH值至7.35 ~7.40。Tyrode′s液:CaCl21.0,其他成分与无钙Tyrode′s液相同。KB液:KOH 80.0、KCl 30.0、L-Glutamic 50.0、MgCl2·6H2O 1.0、HEPES 10.0、Glucose 10.0、KH2PO420.0、Taurine 20.0、EGTA 0.5,用KOH调节pH至7.35~7.40。酶液:无钙Tyrode′s液(mmom/L)+II型胶原酶(0.9~1.0mg/ml)+BSA (1.0mg/ml)。CaCl2储液 200.0 mmol/L、BSA储液 100 mg/ml。
AP内液:NaCl 5.0、K-Gluconate 140.0、CaCl20.1、MgCl21.0、HEPES 10.0、D-Glucose 10.0、EGTA 1.0、Mg-ATP 2.0,用KOH调节pH值至7.20。AP外液:NaCl 140.0、KCl 3.5、HEPES 10.0、NaH2PO41.25、MgCl2·6H2O 1.0、CaCl22.0,用NaOH调节pH值至7.40。
快激活延迟整流钾电流(IKr)细胞外液:NaCl 135、CdCl20.2、 CsCl 1、KCl 5.4、HEPES 15、BaCl20.2、D-glucose 5.5、 NaH2PO40.4、 MgCl21、 CaCl21.8,用NaOH调节pH值至7.40。细胞内液:KCl 120、MgCl21、EGTA 5、Phosphocreatine disodium salt 14、 Na2-ATP 5、用KOH调节pH值至7.20。
慢激活延迟整流钾电流(IKs)细胞外液:Choline chloride 115、 NaCl 20、CaCl21.8、MgCl21、CsCl 5.4、D-glucose 10、HEPES 10、BaCl20.3、CdCl20.1,用NaOH调节pH值至7.40。细胞内液:KCl 20、K-Aspartic 115、MgCl21、EGTA 5、HEPES 10、Na2-ATP 2,用KOH调节pH值至7.20。
晚钠电流(INa-L)细胞外液: NaCl 140、CsCl 5.4、MgCl21、CaCl21.8、BaCl20.3、D-glucose 10、HEPES 10、NaH2PO40.33,用NaOH调节pH值至7.40。使用前加10 μol/L Nifedipine 阻断钙电流。细胞内液: CsCl 120、TEA-Cl 10、CaCl21、MgCl25、HEPES 10、EGTA 10、Na-ATP 5,用CsOH调节pH值至7.20。Buffer A:含0.05 mmom/L CaCl2的KB液。Buffer B:含1.0mmol/L CaCl2的KB液。
以上所有溶液均使用无菌去离子水配制,使用前通以100%氧气。且所有配制好的溶液均经0.22μm滤膜过滤除菌。同时遵循无菌操作原则。
1.4器械和仪器
台式低速自动平衡离心机(YIDA TDZ5M)、台式高速冷冻离心机(YIDA TGL20M)、改良Langendorff装置(自制)、离体心脏灌流蠕动泵(LongerPump BT100-2J)、膜片钳倒置显微镜(OLYMPUS IX71)、膜片钳放大器(HEKA EPC 10USB)、微操纵仪(SUTTER MP-285)、膜片钳恒温器(WARRNER TC-334B)、膜片钳蠕动泵(LeadFluid BT100L)、玻璃微电极拉制仪(SUTTER P-97)、玻璃毛细管(SUTTER BF150-86-10 10cm),其他器械均为中国制造。
1.5实验方法
1.5.1准备 依次用75%的酒精、无菌超纯水、有钙台氏液以恒定的12 ml/min流速冲洗 改良Langendorff灌流装置(图1A)各15 min。排除灌流装置内的气泡和杂质。同时,将恒温水浴装置的温度设置为43℃,使灌流液经自制蛇形管流出的温度达到并维持37℃。并且将所有的灌流液以100% O2充灌至少30 min。
1.5.2获取犬左室灌流组织块和单个心室肌细胞 参考Tadevosyan等[5]的手术方法和灌流方法,称重、麻醉,打开胸腔取出心脏,将心脏置于预冷的Buffer A中,从主动脉确定主动脉左窦的位置,保留左窦,并以其为起点中心,向下成辐射状保留左前降支,去除右心室及大部分室间隔。将左室灌流组织块经主动脉左冠窦悬挂于改良Langendorff装置上(图1B)。以12 ml/min的速度灌流Buffer B,此时将左回旋支、右侧冠状动脉及可见的血管断端全部结扎(图1C),使心肌组织内的灌流压升高。待Buffer B灌流约2 min后,灌流无钙台氏液,约5 min后,灌流酶液3~5 min心脏开始拉丝即可开始循环灌流。酶液循环灌流约15 min时取下一小块组织观察,若有大量单细胞散落,且横纹清晰,即可终止消化。
A:改良Langendorff装置。B:经主动脉左冠窦沿左前降支走行的方向,悬挂并固定左室心肌组织块。C:用4-0缝合线依次将左冠状动脉回旋支及前降支各分支断端结扎,进行灌流,心肌组织逐渐涨大,表面绷紧、光滑
图1灌流装置及灌流组织处理
室温下,取下心肌组织,放入盛有100% O2饱和KB液的玻璃皿中,分三层剪下心肌组织,外层(Epi):外膜面至其下2 mm;中层(Mid):外膜面下2~7 mm;内层(Endo):内膜面至其下2 mm。注意剪取内中外三层心肌组织时,使用不同的眼科剪。将剪下的三层心肌组织分别放于预先标记好的盛有100%O2饱和KB液的40 ml小烧杯中。三层心室肌用各自的眼科剪剪成1 mm3左右絮状块,再用各自吸管轻轻吹打,使细胞分散。将吹打后的组织静置1 min,将悬浊液吸入15 ml离心管中,500 r/min、离心30~40 s,去除上清液,保留沉淀。
向上述离心管中按3∶1、2∶1、1∶1、0∶1的比例加入Buffer A和Buffer B复钙。每次复钙重旋后,静置5 min, 然后500 r/min、离心30~40 s,去除上清液,保留沉淀。重复上述步骤,直至最后一次复钙,重旋,静置5 min后,将混悬液均匀铺于经多聚赖氨酸处理的盛有细胞爬片的3.5 cm培养皿中。将培养皿置于4℃冰箱静置1 h。
1.5.3全细胞膜片钳技术 用微电极拉制仪将毛细玻璃管拉制成记录电极。采用Hammill等[6]膜片钳全细胞记录方法,在倒置显微镜下操纵微电极操纵仪将记录电极接触到细胞上,给予负压抽吸,形成高阻抗封接。形成高阻抗封接后进行快速电容补偿,然后继续给予负压,吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容及串联电阻。不给予漏电补偿。记录快激活延迟整流钾电流(IKr),慢激活延迟整流钾电流(IKs),晚钠电流( INa-L),电流记录在室温下进行,AP在37℃条件下记录。实验数据由 EPC-10 放大器进行采集并储存于PatchMaster 软件中。各电流具体刺激方案见相应电流图。各电流根据不同膜电压下相应的电流密度绘制电流-电压(I-V)曲线。
1.6数据测量和统计分析 用Patch Maste+Clampfit(Version 10.6.2.2,HEKA)软件进行曲线测量,所有数据以均数±标准差表示。用SPSS24.0统计软件进行单因素方差分析,以P<0.05为差异有显著性。
2 结果
2.1心室肌细胞的分离情况
分离即刻,光镜下可见95%左右的心室肌细胞状态良好(图2A),呈杆状或矩形,边缘整齐,具有横纹清晰,表面光滑、稳定无收缩、折光性好、立体感强 。室温下静置3 h后,仍存活90%左右。复钙到1.0 mmol/L,4℃冰箱静置1~2 h后,约20%左右的细胞发生自发性收缩或死亡,细胞皱缩变为球形,80%左右的细胞可用于膜片钳实验(图2B)。存活的细胞在含1 mmol/L CaCl2的KB液中可存活10 h以上。在静息状态下,心肌细胞不发生自发性收缩;不同强度的电刺激下,心肌细胞产生收缩,细胞收缩的方向与细胞长轴方向一致或平行(图2C、D)。

A:心室肌细胞分离后即刻存活率约95%左右;B:复钙到1.0 mmol/L,4℃冰箱静置1~2 h后,约20%左右的细胞发生自发性收缩或死亡,细胞皱缩变为球形,80%左右的细胞可用于膜片钳实验 ;C:高倍镜下心肌细胞的形态;D:膜片钳下心肌细胞形态
图2不同情况下的镜下细胞状态
2.2三层心肌细胞AP比较 Endo细胞AP复极50%的时程(APD50)分别短于Mid和Epi细胞APD50(P<0.5),而Mid细胞与Epi细胞无差异(P>0.5);Mid细胞AP复极90%的时程(APD90)长于Epi与Endo细胞(P<0.05),而Epi与Endo细胞无差异(P>0.05)(见表1和图3)。

表1 正常犬心室肌三层细胞的APD90、APD50/ms
注:与Endo、Epi比较,#P<0.01,*P<0.05;与Endo比较,△P<0.05
2.3三层心肌细胞的INa-L、IKr、IKs
三层细胞中INa-L极小或几乎测不到(图4A)。在-30 mV电压下,Mid细胞INa-L电流密度较Endo、Epi稍大,但三者之间无统计学差异[(-0.198±0.087) pA/pF vs (-0.174±0.124;-0.178±0.088) pA/pF](图4B);Mid细胞IKr的电流密度峰值较Epi和Endo细胞稍大,但无统计学差异[(1.342±0.46) pA/pF vs (1.158±0.211 ;1.038±0.513) pA/pF](图5A、B);Mid细胞中IKs电流密度峰值最小,与Endo、Epi存在明显差异[(2.318±0.370) pA/pF vs (3.586±2.176;3.756±0.778) pA/pF,P<0.05](图6A、B)。

AP刺激方案:将细胞记录转换为电流钳模式(C-Clamp)下,维持在0pA。用时程为10 ms的600pA刺激电流激发出动作电位(具体的刺激强度根据每一个细胞有所差异,由先导的检测刺激确定),记录APD90
图3内、中、外三层心室肌细胞APD90典型图
4 讨论
本实验Langendorff装置由小水浴锅、蠕动泵、五口蛇形套管、水浴烧杯组成。与郭凯等[4]试验中应用的Langendorff装置相比,利用蠕动泵控制灌流压力,比通过高度梯度更精确,更能满足不同情况下灌流需要。将灌流液放于水浴烧杯中并且利用蛇形套管的逆向对流作用,使其温度稳定在36.5℃~37.5℃。蛇形管下端接由8号灌胃针制成的冠脉插管,不会被止血钳夹闭或夹碎。整套装置相对小巧、可拆分,完全可移至无菌操作台下进行操作,从而分离得到无菌灌流的单个细胞。
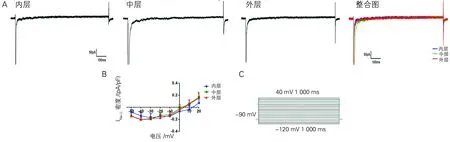
A:-30mv电压下内、中、外三层心肌细胞INa-L的典型电流图及其整合图;B:三层心肌细胞INa-L的I-V曲线图;C:INa-L刺激方案简图
图4三层心室肌细胞INa-L及I-V曲线
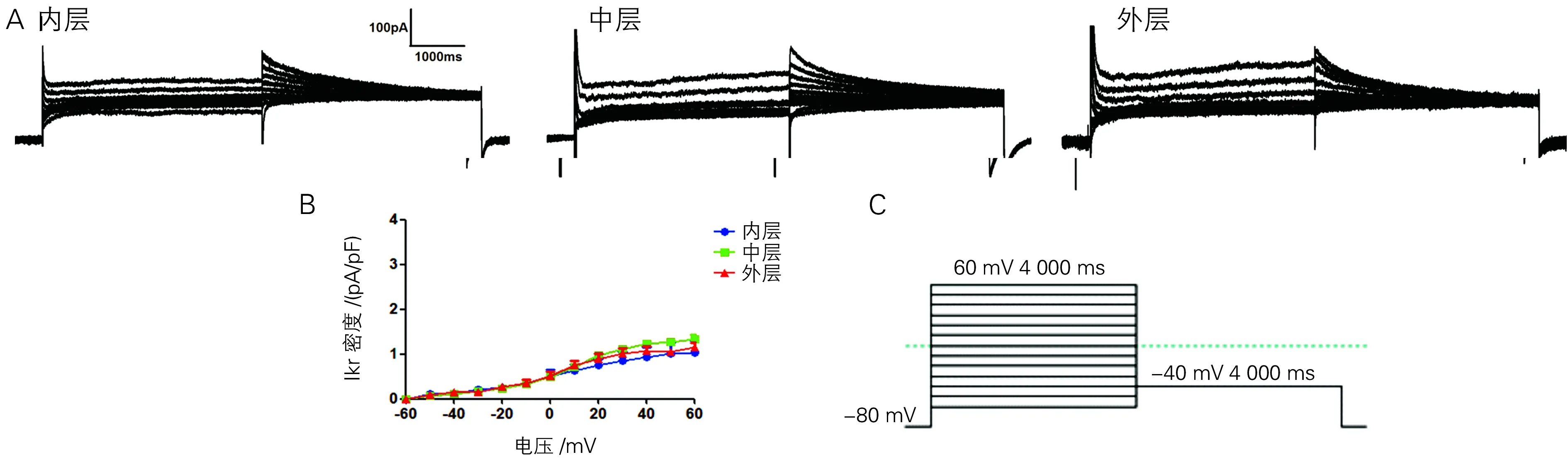
A:内、中、外层IKr典型图电流图; B: IKr的I-V曲线;C:IKr刺激方案
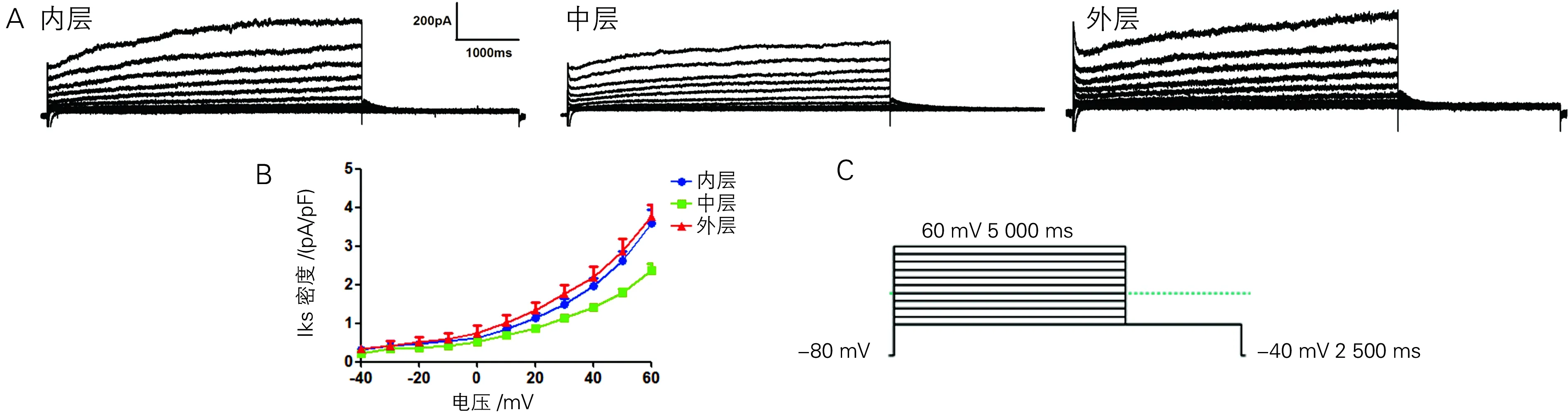
A:内、中、外层IKs典型图电流图; B: IKs 的I-V曲线;C:IKs刺激方案
通过参考Tadevosyan等[5]分离心肌细胞的方法,笔者利用改良的Langendorff灌流装置,不断摸索酶液成分、浓度及酶液灌流时间;总结出获得高产量、高活性心肌细胞时心肌组织的状态,以进一步明确灌流成功的终点。首先,笔者研究对象为大型哺乳动物,心脏体积较啮齿类动物(如:大鼠、豚鼠等)心脏体积大,既往王如兴等[7]研究方法为经主动脉逆行全心灌流分离细胞,此方法于本实验不可行。根据文献[4,8],经摸索,笔者采用经主动脉左冠窦灌流左室前降支供血的心肌组织块法,既可获取高活性的耐钙心肌细胞,又节省实验材料,缩短试验时间。其次,酶液中未添加任何类型的蛋白酶,因为蛋白酶易破坏心肌细胞膜上的蛋白质,影响膜结构稳定性,从而降低细胞的活性及耐钙性,影响心肌细胞电生理的研究。酶液的浓度控制在0.9~1.0 mg/ml,从灌流标准Tyrode′s液开始至灌流终点仅历时30 min,酶液灌流仅历时18~23 min,节约了实验时间。避免因酶浓度太低,灌流时间过长,而使心肌细胞活性降低;也避免了因酶浓度过高,消化时间不好控制,易发生消化过度,以上均影响心肌细胞的活性和产量,进而影响后续实验的进行。关于实验终点的判断,笔者总结出,在酶液进行灌流时,当心肌组织开始拉丝后,再灌流15~16 min,可获得95%以上的高活性心肌细胞;期间,心肌组织的颜色由暗红色变为淡粉色,用眼科镊尖端扎心肌组织会感觉到组织由韧变软,用眼科剪剪取组织,呈糜状,镜下观察均为杆状、横纹清晰、边缘规整的单个心肌细胞。酶液消化在分离单个心肌细胞过程中至关重要:酶消化不足,细胞耐钙性差,覆盖后,存活率低;酶消化时间过长,细胞耐钙,但横纹溶解,膜片钳实验时不易高阻抗封接,不易进行破膜。
笔者证实犬左室游离壁内、外膜及中层细胞之间存在明显的跨室壁复极异质性,中层细胞APD比内、外心室肌细胞明显延长,与既往研究的结论相一致[9-10]。中层细胞有明显长的APD,可能与某些离子流有关,比如:IKs、INa-L、INa-Ca[9,11-12]。IKr在犬三层心肌细胞间无差异,在中层细胞APD较长和慢频率依赖性所起的作用不大,与Viswanathan等[12]的实验结果一致;而IKs在中层细胞较心内、外膜层肌细胞小,使复极过程延长,APD明显延长[11]。与Suthedand等[13]以及李泱等[14]在兔、鼠心室肌细胞中记录到的IKr、IKs的特性相一致。正常犬三层心肌细胞的INa-L无明显差异,与Zygmunt等[9]报道的中层细胞中有较大的INa-L这一结论不一致,但在Wasserstrom等[15]的实验中发现INa-L在正常犬三层心肌细胞中并没有明显不同。关于正常三层心室肌细胞INa-L是否存在差异,可能与实验对象的种属、性别、年龄等因素有关,还需进一步实验研究。
