环指蛋白Efp对人肝细胞增殖及侵袭力的作用机制
2019-08-30周东何艳平李恒平黄卫东
周东 何艳平 李恒平 黄卫东
环指蛋白Efp(estrogen-responsive ring finger protein,Efp)是RBCC(Ring-finger B-box coild-coil)家族的主要成员,其生物结构包括一个环指区域、两个B盒区域、一个螺旋状卷曲区域以及一个C末端的SPRY区域[1]。Efp是雌激素受体(estrogen receptor)的靶点基因,在生物体内子宫、肾脏、脑及肝脏等多器官中表达,同时与细胞多种生物功能调节有关,其中包括细胞周期、凋亡及肿瘤生成等[2]。目前已有研究发现,Efp与肿瘤细胞的异常病理活动密切相关,Efp基因对子宫内膜癌细胞的生长有重要的调节作用[3]。但是,目前对Efp与肝癌细胞的相关研究鲜有报道,其相关的调控机制尚未清楚。本研究采用RNA干扰对人肝细胞株Bel7404进行Efp基因沉默,探讨Efp基因沉默对肝癌细胞Bel7404的增殖及侵袭力的作用机制,以期为相关的临床治疗提供新的可能性。
资料与方法
一、材料与试剂
人肝癌细胞株Bel7404购买自美国菌种保藏中心。DMEM培养基和胎牛血清均购买自美国Hyclone公司。脂质体LipofectaminTM 2000的转染试剂盒购买自美国Invitrogen公司,质粒DNA提取纯化试剂盒购买自美国TIANGEN公司。兔抗鼠多克隆抗体Efp购买自Santa Cruz公司,兔抗鼠多克隆抗体CyclinE和CDK2均购买自中国Proteintech公司。细胞增殖活性检测MTT试剂盒、Transwell小室和BCA蛋白定量试剂盒均购买自中国Beyotime公司。
二、试验方法
(一)Efp干扰质粒的设计与合成 根据GenBank中Efp基因序列,使用小干扰RNA(small interfering RNA,siRNA)设计软件,合成的siRNA序列为5’-GGUCCACCUGAUGUAU-AAGCUUAUACAUCAGGUGGAC-3’;同时阴性对照链为3’-TTAAGAGGCUUGCACAGUGCA-5’。siRNA合成交由武汉晶赛生物工程公司完成。
(二)细胞培养 将冷存与液氮中的人肝癌细胞株Bel7404复苏后,接种在含有100U/ml的青霉素与100ug/mL的链霉素、10%胎牛血清以及DMEM培养基的6孔板中,然后将其置于37℃的细胞培养箱中,2-3天进行细胞换液,待细胞长满至80%以上,采用胰蛋白酶进行消化传代后接种在新的培养皿中。
(三)细胞转染及分组 本研究设立对照组(Control)和转染组(siRNA),对照组采用阴性对照链的RNA进行转染,转染组再用Efp的siRNA干扰质粒进行转染,转染时每组细胞设6个复孔,细胞铺满孔内80%以上后采用脂质体LipofectaminTM2000方法进行细胞转染。转染首先采用无血清DMEM培养基6 h,然后再将培养基换为10%胎牛血清后继续培养48 h,其余过程均按照说明书指示进行。
(四)Western blot检测蛋白表达 将两组细胞加入蛋白裂解液后提取总蛋白,采用BCA方法检测蛋白浓度后,将总蛋白进行SDS-PAGE凝胶电泳分离、NC膜转膜、5%牛奶封闭1 h后,分别进行Efp、CyclinE、CDK2和β-actin一抗4℃孵育过夜。次日进行TBST洗膜三次后,再加入二抗室温孵育1 h,暗室加入ECL试剂盒显影记录结果。
(五)细胞增殖能力检测 首先将细胞接种于96孔中,每孔约1×104个,待转染细胞24、48和72 h时,每孔加入MTT液10 μL,然后再将培养皿置于细胞培养箱孵育3 h后去除上清液,加入DMSO液体孵育10 min后进行酶标仪检测各孔吸光度,计算每组细胞的增殖能力。
(六)细胞侵袭力检测 将转染前后的Bel7404细胞接种无血清DMEM上室后,将含有10%胎牛血清的DMEM培养基置于下室,待细胞培养24 h后取出小室,此刻细胞已经迁移至上室膜的底面,将小室进行4%多聚甲醛固定15 min后,采用结晶紫染色5~8 min,最后将其置于显微镜下随机选取5个视野进行细胞数量定量分析。
(七)统计学处理 采用SPSS 19.0 统计软件分析,两组间的比较采用t检验,计量资料均采用均数±标准差表示,P<0.05为差异有统计学意义。
结 果
一、转染siRNA对Efp蛋白表达的影响
图1结果表明,人肝癌细胞株Bel7404的siRNA组中Efp蛋白表达为0.32±0.05,较对照组的1.00±0.00明显下降,且差异有统计学意义(图1,P<0.05),此结果提示siRNA对人肝癌细胞株Bel7404体外转染成功,细胞中的Efp基因表达可被干扰siRNA沉默,具体见图1。

图1 转染后Efp蛋白的表达;A: Bel7404细胞各组中Efp蛋白表达
二、转染siRNA质粒对细胞增殖及其机制的影响
图2结果表明,人肝癌细胞株Bel7404中siRNA组的细胞增殖率在24、48和72h时为0.087±0.010、0.107±0.013以及0.120±0.010,分别较对照组的增殖率0.112±0.012、0.134±0.011以及0.163±0.010明显下降,且差异有统计学意义(图2A,P<0.05)。该结果提示肝癌细胞株在沉默Efp后可明显抑制细胞增殖能力,而且呈时间依赖性,为进一步深入研究Efp对细胞增殖的作用机制,本研究进而检测细胞周期标志蛋白CyclinE和CDK2的蛋白表达。结果表明,siRNA组中细胞的CyclinE和CDK2蛋白表达为0.47±0.04和0.27±0.12,分别较对照组明显下降,且差异有统计学意义(图2B,P<0.05),此结果提示Efp可通过抑制细胞周期蛋白CyclinE和CDK2的表达进而阻碍肝癌细胞株的过度增殖,具体见图2。
三、转染siRNA质粒对细胞侵袭能力的影响
Transwell结果表明,人肝癌细胞株Bel7404的siRNA组中细胞侵袭率为0.3384±0.0492,显著低于对照组的0.7057±0.0836,且差异有统计学意义(t=5.35,P<0.05),此结果提示Efp可明显抑制人肝癌细胞株的过度侵袭能力。
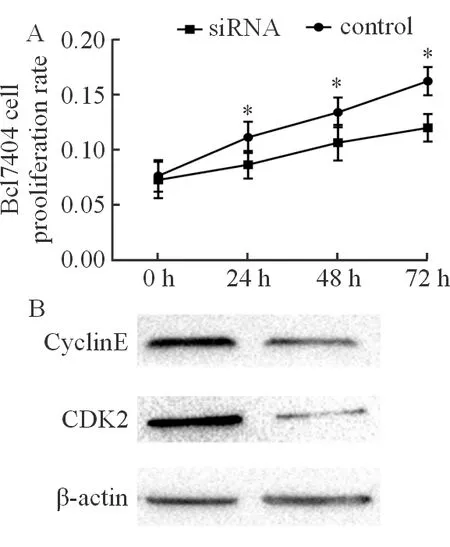
图2转染后Efp对Bel7404增殖及其机制的影响 A: 各组Bel7404细胞中不通时间点的增殖能力;B: Bel7404细胞各组中CyclinE和CDK2蛋白表达;*与对照组(Control)比较,P<0.05,差异具有统计学意义
讨 论
Efp基因作为机体内泛素连接酶E3调节机体内细胞的生长、增殖及分化等生物功能[4]。已有研究证明Efp可调节肿瘤的生长与转移,但是主要的研究多集中在乳腺癌或子宫内膜癌的病理活动或预后发展[2],关于Efp在肝癌细胞中的表达及调控机制研究较少。
研究表明Efp沉默可明显抑制子宫内膜癌细胞血管生成,进而抑制子宫内膜癌的增殖及迁移[2]。而肝细胞癌症多为血管富集性肿瘤,其肿瘤的发生、发展及转移都与血管生成有着紧密的联系[5-6]。根据肝脏肿瘤与血管生成紧密相连的病理机制以及过往的研究的结果,本研究通过采用Efp基因沉默,进一步研究其余肝癌细胞的增殖及侵袭力的关系。本研究选取人肝癌细胞株Bel7404作为研究对象,在此基础沉默Efp表达,进一步检测其对细胞增殖及其侵袭力的影响机制。
本研究结果显示,Bel7404细胞在转染siRNA后,Efp蛋白表达明显下降,这一结果说明病毒已转染至细胞中并成功使Efp基因沉默。而进一步实验发现,Efp基因沉默后24、48以及72 h Bel7404的细胞增殖率明显降低,并且呈时间依赖性。同时,实验研究结果也发现沉默后Efp可明显抑制细胞株的侵袭能力。关于细胞增殖作用机制,其中细胞周期标志蛋白CyclinE和CDK2是细胞周期的关键调控因子,主要调控细胞由G1期过渡至S期,最终促进细胞增殖[7]。结合相关理论及前期实验,为探讨Efp对人肝癌细胞增殖及侵袭力的具体机制,本研究通过检测细胞蛋白表达,发现Efp基因沉默后可明显降低细胞中周期蛋白CyclinE和CDK2的表达,这可能是Efp调控肝癌细胞增殖的作用机制。而Efp可作为泛素连接酶E3,特异识别相关蛋白后促进其在泛素途径内降解。根据我们研究结果和以往的研究,我们认为Efp主要是通过靶向识别细胞周期标志蛋白CyclinE和CDK2后,促进细胞周期蛋白在肝癌细胞内的降解,进而通过阻滞细胞从G1期过渡至S期以达到抑制肝癌细胞的增殖及侵袭能力的目的。
综上所述,本研究通过基因沉默Efp验证其通过加速CyclinE和CDK2的降解,进一步可调节人肝癌细胞株Bel7404的增殖及侵袭能力,为肝癌治疗开辟新的靶点,同时为后续研究提供了很多理论依据。