SEPT9基因在人肝细胞癌侵袭转移中的作用
2019-08-30邓冲郭德良谢雄伟
邓冲 郭德良 谢雄伟
肝癌是我国发病率最高的恶性肿瘤之一,严重威胁国民的身体健康[1]。由于肝癌具有很强的侵袭性和转移性,如何降低肝癌的侵袭和迁移,抑制肿瘤细胞的增殖是临床一致探究的问题[2]。SEPT 9基因是GTPase活性保守基因Septin的重要成员之一[3],参与细胞分裂、胞内转运、细胞调控等多种生理调节[4-5]。近年来的研究显示,SEPT 9蛋白的高表达与肿瘤的发展密切相关,临床已将其作为多种恶性肿瘤早期筛查的重要标志物[6-7],但关于SEPT 9基因如何调控肿瘤细胞增殖、转移的研究尚无明确报道,因此本文通过构建SEPT 9的靶向shRNA,沉默该基因的表达,分析其对肝癌细胞增殖侵袭能力的影响,为今后肝癌靶向药物的开发提供基础研究参考。
材料与方法
一、主要试剂
肝癌HepG2、Bel-7402、MHCC97、Hep3B、Huh-7细胞购于ATCC,DMEM培养基、二甲基亚砜(Dimethyl sulfoxide,DMSO)、青霉素和链霉素、胰蛋白酶、嘌呤霉素等(上海生工生物股份有限公司;中国);EDU、MTT(Sigma公司;美国),胎牛血清(杭州四季青生物工程材料有限公司;中国);HIF-1α、Ki67、PCNA、MMP-9、VEGF、Vimentin、N-cadherin、E-cadherin、β-actin等一抗蛋白(Santa Cruz公司,美国);HRP羊抗兔IgG、HRP羊抗鼠IgG等二抗(Thermo公司,美国);SEPT9阴性对照病毒(SEPT9-NC)、SEPT9靶向shRNA(靶向序列为5′-GGCAGCCCATCATGAAGTTCA-3′)购于上海吉玛公司;细胞裂解液、ECL化学发光试剂及其他试剂、耗材(北京索莱宝科技有限公司, 中国)。
二、主要设备
CO2培养箱(SanYo公司,日本),DNM-9606酶标分析仪(北京朗普新技术有限公司 中国);EVOS FL 型全自动智能成像系统(Thermo,美国);湿转仪(AB公司,美国),电泳仪(Bio-red,美国),凝胶成像系统(DNR公司,以色列);XD-202倒置显微镜(南京江南永新光学有限公司);其他仪器购于德国eppendorf公司。
三、细胞培养
用含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM培养液培养肝癌HepG2、Bel-7402、MHCC97、Hep3B、Huh-7细胞,培养条件为37℃,5% CO2。隔天换液一次,细胞融合度达到85%以上时进行传代培养,三次传代后进行实验检测。
四、SEPT9蛋白高表达细胞系筛选
收集对数生长其的细胞106个,提取肿瘤组织的总蛋白,酶标仪490 nm波长条件下进行蛋白定量。12% SDS-PAGE电泳分离,采用湿转法将蛋白转至硝酸纤维素膜上,4℃条件依次加入封闭液孵育2 h,SEPT9抗体孵育过夜(稀释比例均为1∶1 000),二抗孵育2 h(稀释比例均为1∶5 000)。用ECL化学发光试剂显色,在凝胶成像系统检测分析蛋白条带,蛋白表达定量分析用Image J图像分析软件对条带进行分析,内参采用β-actin。筛选SEPT9蛋白高表达细胞系,用于后续实验。
五、慢病毒转转染
取对数生长期的SEPT9蛋白高表达细胞,调整细胞浓度为1×105/mL,2 mL/孔接种于6孔板,37 ℃,5% CO2条件下,待细胞生长覆盖度达到50%时进行慢病毒感染,按照试剂操作说明书要求,进行慢病毒转染,对照组加入20 μL培养基;阴性对照组加入20 μL SEPT9阴性对照病毒(SEPT9-NC,滴度2×108TU/mL);抑制组加入6 μL SEPT9干扰病毒(SEPT9-shRNA:滴度9×108TU/mL)以及2 μL的polybrene(5 μg/μL),转染过夜后(约16 h)每天更换新鲜培养基。培养5 d后向培养基中加入终浓度为2 μg/mL的嘌呤霉素进行耐药细胞株的筛选,westernblot鉴定病毒转染效果,将转染成功的细胞用于后续实验。未经病毒转染的细胞为对照组,转染空病毒细胞(SEPT9-NC)为阴性对照组,转染抑制基因病毒(sh-SEPT9)为实验组。
六、细胞增殖检测
取对数生长期的对照组、阴性对照组、实验组细胞,调整细胞浓度为1×105个/mL,100 μL/孔接种于96孔板,37 ℃, 5% CO2条件下,过夜培养(约16 h)过夜培养,根据EdU染色试剂盒说明书,检测细胞增殖。完全培养基稀释EdU溶液,作用浓度为10 μM,每孔加入100 μL,孵育4 h后弃培养基,PBS清洗两次,多聚甲醛固定,Apollo染色,立即检测或用抗荧光淬灭封片后,保存检测。
七、细胞侵袭实验
在Transwell小室中进行。取5 μg 纤粘连蛋白用移液器均匀的涂抹在小室内的PVPF聚碳酸滤膜外表面;同样的操作方式在膜的内侧表面涂5 μg matrigel。调整细胞浓度,每室分别接种2×105细胞对照组、阴性对照组、实验组细胞,设置3个复孔;37 ℃, 5% CO2温箱培养4 h。PBS清洗三次并去除小室中膜内侧表面多余的细胞,多聚甲醛进行固定;400倍显微视野下随机选取10个视野, 倒置显微镜下采用双盲计数法统计膜下表面的细胞数目平均值。实验重复检测三次。
八、划痕迁移实验
将划痕实验插件置于24孔板,取对数生长期的对照组、阴性对照组、实验组细胞,调整细胞浓度为5×105个,37 ℃, 5% CO2条件下培养过夜(约16 h)。小心移去划痕实验插件,用完全培养基润洗3次,加入10 μM丝裂霉素,继续培养2 h,更换新鲜完全培养基,显微镜下拍照,时间点为0时,继续培养24 h拍照分析细胞的迁移情况。
九、westernblot检测细胞蛋白表达
取对数生长期的对照组、阴性对照组、实验组细胞,细胞量为5×105个于1.5 mL离心管,westernblot操作方法参见1.2.2,提取细胞蛋白,分析沉默SEPT9蛋白后对肝癌细胞HIF-1α、Ki67、PCNA、MMP-9、VEGF、Vimentin, N-cadherin、E-cadherin蛋白的表达影响,蛋白表达定量分析用Image J图像分析软件对条带进行分析,内参采用β-actin。
十、统计学分析
结 果
一、SEPT9高表达细胞系筛选
结果如图1所示,通过对5种肝癌细胞系HepG2、Bel-7402、MHCC97、Hep3B、Huh-7等检测发现,SEPT9蛋白在各细胞系均有表达,蛋白表达定量分析显示,HepG2细胞中的表达量相对较高。因此本文选择HepG2细胞为研究对象,研究沉默SEPT9基因表达对肝细胞癌侵袭转移的影响。

图1 SEPT9蛋白在不同肝癌细胞系中的表达
二、慢病毒转染结果
结果如图2所示,与对照组相比,阴性对照组细胞SEPT9蛋白表达没有显著变化(P>0.05),实验组HeGp2细胞SEPT9蛋白表达显著降低,差异统计学分析有意义(P<0.05)。多次传代培养后westernblot检测显示,通过病毒转染所构建的SEPT9蛋白低表达HeGp2细胞株性质稳定,能够用于后续实验步骤。

图2慢病毒转然sh-SEPT9对肝癌HeGp2细胞SEPT9表达的影响 与对照组相比:***P<0.001
三、SEPT9对肝癌HeGp2细胞增殖的影响
结果如图3A所示,与对照组相比,SEPT9沉默后HeGp2细胞的增殖能力明显受到抑制,差异统计学分析有意义(P<0.05)。Western blot实验结果如图3B所示,SEPT9沉默后HeGp2细胞Ki67和PCNA的表达明显受到抑制,差异统计学分析有意义(P<0.01),表明SEPT9沉默后HeGp2细胞Ki76和PCNA蛋白表达明显受到抑,增殖能力显著降低。
四、SEPT9对肝癌HeGp2细胞侵袭能力的影响
结果如图4A所示,对照组侵袭细胞数为(108.69±15.21)个,HeGp2-SEPT9-NC组侵袭细胞数(108.69±15.21)个,与对照组相比,差异统计学分析无意义(P>0.05),SEPT9-shRNA转染组侵袭细胞数显著减少为(45.23±7.32)个,与对照组相比,差异统计差异统计学分析有意义(P<0.05)。Western blot实验结果如图4B所示,SEPT9沉默后HeGp2细胞Vimentin, N-cadherin 的表达明显降低,E-cadherin的表达显著增强,差异统计学分析有意义(P<0.05);表明sh-SEPT9能够通过下调HeGp2细胞Vimentin、N-cadherin的表达,上调E-cadherin的表达水平,降低细胞的侵袭能力。
五、SEPT9对肝癌HeGp2细胞迁移能力的影响
结果如图5A所示:与对照组相比:HeGp2-SEPT9-NC组细胞的迁移能力无明显变化,差异统计学分析无意义(P>0.05),HeGp2-SEPT9-shRNA组细胞的迁移明显降低,差异统计学分析有意义(P<0.05)。Western blot实验结果如图5B所示,SEPT9沉默后HeGp2细胞HIF-1α、MMP-9及VEGF的表达量显著降低,差异统计学分析有意义(P<0.05);表明sh-SEPT9能够通过下调HeGp2细胞HIF-1α、MMP-9及VEGF的表达,降低细胞的迁移能力。
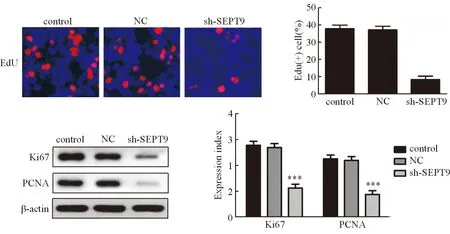
图3 sh-SEPT9对肝癌HeGp2细胞增殖的影响 与对照组相比:***P<0.001

图4 sh-SEPT9对肝癌HeGp2细胞侵袭能力的影响 与对照组相比:***P<0.001

图5 sh-SEPT9对肝癌HeGp2细胞迁移能力的影响 与对照组相比:***P<0.001
讨 论
Septin基因是广泛纯在除植物以外的几乎所有真核生物,是GTPase活性的保守基因,广泛分布在人体的多个组织或细胞中,参与细胞分裂、胞内转运、细胞调控等多种生理调节。SEPT 9基因是septin基因家族中重要成员之一,通过与细胞内微丝、微管及肌动蛋白相互作用,调控蛋白运输。研究显示SEPT 9蛋白在结肠癌、乳腺癌、肺癌及血液系统肿瘤等组织细胞中存在明显的高表达情况[8],SEPT 9蛋白达沉默后正常分裂将会受到抑制,易产生多核细胞。因此本文通过构建SEPT 9的靶向shRNA,研究沉默该基因的表达,对肝癌细胞增殖侵袭能力的影响。
通过对肝癌细胞SEPT 9蛋白表达检测显示,HeGp2细胞表达量相对较高,本文通过慢病毒转染,沉默HeGp2细胞SEPT 9蛋白表达,结果显示SEPT 9-shRNA转然后,HeGp2细胞SEPT 9蛋白表达显著降低,多次传代后检测发现,SEPT 9-shRNA对HeGp2细胞SEPT9蛋白沉默作用能够稳定遗传,表明本文构建的HeGp2-SEPT 9-shRNA细胞系成功,能够用于后续课题的研究。
通过EdU染色[9]检测发现,与对照组相比,SEPT9沉默后HeGp2细胞的增殖的数量明显减少,增殖能力显著降低(P<0.05)。Western blot对SEPT9沉默后HeGp2细胞Ki67和PCNA的表达分析显示,与对照组相比,SEPT 9-shRNA组细胞Ki67和PCNA的表达量显著降低(P<0.05)。由于沉默细胞SEPT9蛋白表达后,能够抑制细胞的有丝分裂,而Ki67是一种核抗原[10],PCNA细胞有丝分裂间期DNA合成所必需的一种核蛋白[11],均参与细胞有丝分裂,其活性与细胞增殖能力密切相关。因此沉默HeGp2细胞SEPT9蛋白表达后,细胞的增殖受到抑制,分裂能力降低,造成Ki67和PCNA蛋白的表达量显著降低。
上皮-间叶转化(EMT)是发生在胚胎时期的生理过程[12],通过破坏细胞的细胞间连接,促进细胞的侵袭。这可能是肝癌细胞具有较强的组织侵袭的原因,本文通过transwell小室实验发现,与对照组相比,SEPT9沉默后HeGp2细胞侵袭量显著减少(P<0.05);Western blot实验结果显示,SEPT9沉默后HeGp2细胞Vimentin, N-cadherin 的表达明显降低,E-cadherin的表达显著增强(P<0.05)。由于细胞发生EMT过程中,非上皮的黏附分子如 N-cadherin、Vimentin能够能提供微管及肌动蛋白所没有的弹性,改变细胞的灵活和形态,穿透上皮细胞的间隙,实现细胞的组织侵袭和迁移[13-14]。沉默SEPT9基因表达后,HeGp2细胞的Sentiment, N-cadherin的表达显著降低,表明其EMT机制显著受到抑制,从而降低HeGp2细胞的侵袭能力。
本文通过划痕实验也对SEPT9沉默后肝癌HeGp2细胞的迁移能力进行分析,结果显示,与对照组相比:SEPT9沉默后,HeGp2细胞迁移能力明显降低(P<0.05)。Western blot结果显示,SEPT9沉默后,HeGp2细胞HIF-1α、MMP-9及VEGF的表达量显著降低(P<0.05)。这是由于HIF-1对氧气的浓度依赖性很强,在低氧环境下肿瘤细胞通过刺激HIF-1α的表达,促进VEGF的表达,诱导血管新生,增强肿瘤组织中氧分和营养的供给,同时也为转移提供便利[15]。MPP-9作为主要的基质金属蛋白酶,能够破坏肿瘤细胞迁移的组织学屏障[16],表明沉默SEPT9蛋白表达能够抑制细胞HIF-1α、MMP-9及VEGF的表达,降低营养供给和血管新生,从而抑制HeGp2细胞的迁移。
综上所述,SEPT9基因高表达能够增强肝癌HepG2细胞的增殖能力,通过EMT机制,促进肝癌HepG2细胞的侵袭和转移。