AM真菌与根瘤菌对紫花苜蓿镰刀菌萎蔫和根腐病的影响
2019-08-30王晓瑜丁婷婷李彦忠段廷玉
王晓瑜,丁婷婷,李彦忠,段廷玉*
(1.兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学国家级草业科学实验教学中心,兰州大学草地农业科技学院,甘肃 兰州 730020;2.浙江大学生命科学学院,浙江 杭州 310058)
紫花苜蓿(Medicagosativa)是世界上栽培最早,种植最广泛的牧草之一。预计2020年我国对优质牧草总需求量为690万t,农业部《全国苜蓿产业发展规划(2016-2020)》中提出“到2020年,新增优质苜蓿种植面积300万亩,增加优质苜蓿产量180万t”[1]。在苜蓿种植面积扩大的同时,许多苜蓿病害也随之发生,造成产量降低、品质下降、甚至会导致家畜中毒[2]。
根腐病是影响苜蓿生长的主要病害之一,可在苜蓿生长的各个时期造成危害,通常直接导致苜蓿根茎、主根及侧根腐烂,进而导致植株枯黄、叶片萎蔫,最后整株枯死[3]。目前国际上已有报道的苜蓿根腐病病原菌种类较多,国内造成苜蓿大面积减产的根腐病病原菌主要是镰刀菌属(Fusarium)和丝核菌属(Rhizoctonia)。其中以镰刀菌属病原菌种类最多,危害最为广泛。由于其在苜蓿不同生长季节的菌量和种类数均有差异,因此也较难防控[4-5],尖孢镰刀菌(Fusariumoxysporum)就是其中致病性较强的病原菌之一[6]。
利用共生微生物防治土传病害已成为当前植物病害防治的热点之一。丛枝菌根(arbuscular mycorrhizal, AM)真菌在自然界广泛存在,可与绝大多数高等陆生植物建立共生关系,并促进植物对水分及养分的吸收、提高宿主抗逆性[7]。目前,国际上利用丛枝菌根真菌防治植物根腐病的报道多集中于番茄(Lycopersiconesculentum)[8]、大豆(Glycinemax)[9]、龙葵(Solanumnigrum)[10]、芦笋(Asparagusofficinalis)[11]、番木瓜(Caricapapaya)[12]等经济作物,国内也有关于根腐病田间调查的报道,但相关生理生化机制研究和生物防治研究尚待深入。根瘤菌是可与豆科植物共生形成结瘤,并能将空气中的氮气进行生物固定的一类杆状细菌。之前关于根瘤菌-植物互作的研究和应用主要集中于提高根瘤活性,促进植物养分吸收,提高根瘤菌利用效率等,近年来根瘤菌对于植物病害的生物防治作用日渐被重视[13-14],利用根瘤菌防治尖孢镰刀菌就是其中之一[15]。
上述3种微生物共同存在于土壤中,“丛枝菌根真菌-豆科植物-根瘤菌”可建立互惠共生体系[16]。AM真菌和根瘤菌对植物生长及抗病性的作用受环境因素影响较大,相关生理生化机制仍不明确,二者互作对致病能力较强的尖孢镰刀菌是否具有防治作用,需深入研究。本研究以陇东苜蓿为供试对象,设置AM真菌、根瘤菌及病原菌互作处理,通过温室试验探究AM真菌和根瘤菌对植物生长、养分吸收及对尖孢镰刀菌引起的苜蓿萎蔫和根腐病的影响,旨在明确AM真菌-根瘤菌调控紫花苜蓿镰刀菌萎蔫和根腐病的生理生化机制。
1 材料与方法
1.1 供试材料
1.1.1供试植物 供试植物为陇东苜蓿(M.sativacv. Longdong),由甘肃省出入境检验检疫局提供。播种前将陇东苜蓿种子用10% H2O2表面消毒10 min,用无菌水冲洗5次后,将其均匀摆放于直径8 cm,铺有双层滤纸的培养皿中,每皿摆放25粒种子。加入少量蒸馏水之后,置于20~25 ℃光照培养箱中进行催芽,2 d后种子露白后播种。
1.1.2丛枝菌根真菌 丛枝菌根真菌为摩西管柄囊霉(Funnelliformismosseae),原始菌种购买于北京植物营养与资源所,编号为BGC NM04A。由本实验室扩繁,每盆称取200 g菌剂,添加到2400 g河沙中,以白三叶(Trifoliumrepens)为宿主进行扩繁,培养3个月后白三叶株高约12 cm,土壤中孢子量达到100个·g-1时,用所得孢子、培养基质以及白三叶根段混合物作为接种物。
1.1.3根瘤菌 根瘤菌为苜蓿中华根瘤菌(Sinorhizobiummedicae,S.m),由甘肃农业大学草业学院姚拓教授提供。
1.1.4病原菌 病原菌为苜蓿尖孢镰刀菌(F.oxysporum,F.o),由兰州大学草地农业生态系统国家重点实验室李彦忠教授提供。
1.1.5供试土壤 将草炭土于121 ℃高压蒸汽灭菌1 h,自然风干后,再次于121 ℃高压蒸汽灭菌1 h并风干备用;将河沙过3 mm筛,置于烘箱170 ℃干热灭菌24 h;将兰州大学榆中校区采集的黄土置于烘箱170 ℃干热灭菌24 h。然后将草炭土、黄土和河沙以体积比为1∶1∶2混匀,装在密封的袋子内备用,取20 g土样测定土壤理化性质。土壤理化性质:pH 7.6;全P 0.68 mg·g-1;全N 1.46 mg·g-1。
1.2 试验方法
1.2.1试验设计 盆栽试验于2017年在兰州大学榆中校区智能温室开展。共设置8个处理,其中包括2种AM真菌处理:不接种AM真菌(NM)和接种AM真菌(AM);2种根瘤菌处理:不接种根瘤菌(S-)和接种根瘤菌(S+);2种接病处理:不接种病原菌(F-)和接种病原菌(F+)。共有对照处理(NMS-F-)、单接病原菌处理(NMS-F+)、单接根瘤菌处理(NMS+F-)、根瘤菌+病原菌处理(NMS+F+)、单接AM真菌处理(AMS-F-)、AM真菌+病原菌处理(AMS-F+)、AM真菌+根瘤菌处理(AMS+F-)和AM真菌+根瘤菌+病原菌处理(AMS+F+)8个处理,每个处理4个重复,共32盆陇东苜蓿。播种时,每盆移栽露白种子6粒,出苗1周后,选择长势较为一致的保留4株,试验期间植物随机摆放。
1.2.2AM真菌接种 上述土壤灭菌并混匀后,先装入900 g土。AM真菌处理(AM)平铺添加100 g接种剂;不接种处理(NM)则平铺添加等量灭活菌剂100 g,且用过2层42号滤纸过滤接种物中AM真菌,滤液加入土壤,还原土壤中其他微生物,以确保微生物区系一致[盆·(10 g·20 mL)-1],最后上层覆土200 g,每盆共装入1200 g土,花盆直径15 cm,高18 cm,试验期间土壤水分保持在70%±5%。
1.2.3根瘤菌接种 先将供试菌株接种到酵母甘露醇琼脂(yeast mannitol agar, YMA)平板培养基上进行扩繁保存,28 ℃恒温培养2 d后,置于4 ℃密封保存。再将供试菌株从平板培养基转接到斜面培养基进行活化,28 ℃恒温培养2 d后,转接于YMA培养液(200 mL)锥形瓶中,置于恒温振荡器,在转速150 r·min-1、温度28 ℃条件下,培养1周至对数生长期,配制成根瘤菌悬浮液。
出苗2周后,接种根瘤菌处理(S+)每株用注射器贴近苜蓿轴根,注射20 mL根瘤菌菌液;不接种根瘤菌处理(S-)每株用注射器贴近苜蓿轴根,注射20 mL无菌水。隔天再次接种,共接种5次。
1.2.4病原菌接种方法 原始病原菌分离自田间发病植株,接种前用马铃薯琼脂(potato dextrose agar, PDA)平板培养基扩繁,密封后置于22 ℃霉菌培养箱活化。待菌丝长满培养皿后,用无菌水配制孢子悬浮液。采用血球计数板法对原始孢子悬浮液进行镜检计数,将原液稀释一定倍数,并确保分生孢子数大于109个·mL-1后,密封待用。
出苗3周后,接种病原菌处理(F+)每株用注射器创伤苜蓿根系后,注射20 mL病原菌孢子悬浮液;不接种病原菌处理(F-)每株用注射器创伤苜蓿根系后,注射20 mL无菌水。隔天再次接种,共接种5次,确保土壤中镰刀菌的菌量维持在一定范围。试验期间温室温度18~25 ℃,湿度保持在65%~80%,光照为自然光照,每天光照时长约为15 h。
1.2.5试验指标测定方法 叶片发病情况:第1次接种镰刀菌根腐病后第48天进行统计,记录发病叶片数,根据分级标准计算病情指数。0级:无症状;1级:叶片枯黄面积小于叶片总面积的25%;2级:叶片枯黄面积为叶片总面积的26%~50%;3级:叶片枯黄面积为叶片总面积的51%~75%;4级:叶片枯黄面积大于叶片总面积的76%;5级:苜蓿整株枯死。根系病状表现为:茎基部出现淡紫色,根系腐烂,侧根大量断裂、脱落,主根病状不明显,根系仅取样、分离、纯化、鉴定病原菌,不做病情指数测定。
发病率=(发病叶片/叶片总数)×100%
病情指数=[∑(发病叶片数×病级数)/(总叶片数×最高病级数)]×100%
苜蓿生长10 周后收获,茎叶部分齐地面刈割后称量鲜重,根系部分洗去泥沙,待根系表面水分自然蒸发后称量鲜重。采用放大镜观察记录根瘤数(直径大于1 mm),其中粉红色为有效根瘤;剪取15~20段1 cm 左右的根系置于10 mL离心管,保存于4 ℃取样冰盒,采用染色镜检法测定AM真菌侵染率[17];分别称取1 g左右紫花苜蓿叶片和根系,放入预冷的研钵中,用液氮研磨至粉状,共用9 mL 4 ℃预冷的磷酸缓冲液冲洗研钵2~3次,全部转入10 mL离心管中,用冷冻离心机5000 r·min-1低温离心30 min,取6 mL上清液移入新的10 mL离心管中,将离心管放入液氮罐带回实验室后4 ℃保存备用。生物量测定:将取样后剩余植物样置于105 ℃烘箱中杀青30 min,80 ℃烘箱中烘干48 h后按比例换算测定:
生物量=取样后剩余样干重/(取样后剩余样鲜重/总鲜重)
于刈割前1 d采用叶绿素仪(SPAD 502, Li-Cor, USA)测定叶绿素含量[18-19];全N、全P含量测定:用球式研磨仪研磨苜蓿干样,用强催化剂消煮处理后,采用流动注射仪(FIAstar 5000 Analyzer, FOSS, Sweden)测定[20];β-1, 3-葡聚糖酶活性测定:参照Isaac等[21]和Cattelan等[22]的方法;丙二醛含量测定:参照Zhang等[23]的方法;苯丙氨酸解氨酶(phenylalnine ammonialyase, PAL)活性测定:参照Qin等[24]的方法;过氧化氢含量测定:参照Mukherjee等[25]的方法;茉莉酸浓度测定:采用液相色谱法[26];木质素浓度测定:参照Abiven等[27]的方法;NO浓度测定:采用氧合血红蛋白法[28];脱落酸浓度[29]、超氧化物歧化酶活性测定:参照Mukherjee等[25]的方法。
1.3 试验数据统计处理
试验数据按照不同接菌处理,采用JMP IN 4统计软件进行方差分析,比较不同接菌处理所造成的差异,通过多重比较法对差异显著的处理进行比对,采用GraphPad Prism 5.01作图。
2 结果与分析
2.1 AM真菌侵染率、根瘤数以及苜蓿发病率、病情指数
NM处理未检测到菌根结构,根瘤菌处理和病原菌处理对苜蓿菌根侵染率没有显著影响(P>0.05)(图1a)。
未接种根瘤菌处理(S-)没有检测到根瘤结构,病原菌处理对苜蓿根瘤数无显著影响(P>0.05),AM真菌极显著地增加了苜蓿根瘤数(P<0.01)。AMS+F-和AMS+F+处理下苜蓿根系根瘤较NMS+F-分别多86.78%和136.63%。双接种AM真菌和根瘤菌处理下,病原菌增加了苜蓿根瘤数(26.90%)(图1b)。
AM真菌显著降低苜蓿发病率(P<0.05)和病情指数(P<0.001)。与对照相比,AM真菌单独接种(AMS-F+)处理降低苜蓿发病率80.13%(图1c)。AM真菌单独接种(AMS-F+)及与根瘤菌双接种(AMS+F+)处理下,病情指数分别较对照低89.93%和75.05%(图1d)。
2.2 苜蓿茎叶、根系生物量及叶绿素含量(SPAD值)
AM真菌和根瘤菌处理显著提高了苜蓿茎叶、根系干重(P<0.01)。与对照(NMS-F-)(下同)相比,根瘤菌与AM真菌单独及混合接种后提高苜蓿茎叶干重4.7~23.4倍,增加苜蓿根系干重11.3~15.0倍,缓解了病原菌对苜蓿生长的抑制作用(图2a,b)。
AM真菌和病原菌处理对苜蓿叶绿素含量影响极显著(P<0.01)。其中AM真菌单独接种提高苜蓿叶绿素含量29.1%~65.6%,AM真菌与根瘤菌互作处理较对照苜蓿叶绿素含量高25.7%~85.3%(图2c)。
2.3 苜蓿全N、全P
不同微生物处理下苜蓿N、P含量与苜蓿生物量相似(图2a,b)。AM真菌和根瘤菌显著促进了紫花苜蓿养分吸收,单独接种AM真菌苜蓿茎叶、根系总N含量和总P含量分别较对照提高22.3、10.7、39.1和23.5倍;单独接种根瘤菌处理苜蓿茎叶、根系总氮含量分别提高6.2和1.7倍,总磷含量提高14.6和39.1倍。AM真菌+根瘤菌处理下苜蓿茎叶总氮和总磷含量分别较对照提高26.5和14.0倍,根系总氮和总磷含量提高54.3和51.3倍(图3)。
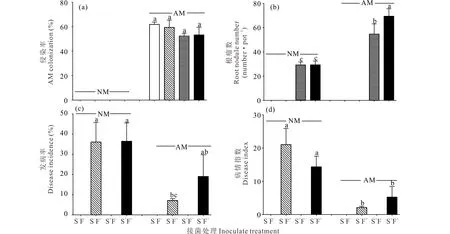
图1 不同处理下AM真菌侵染率(a)、根瘤数(b)、苜蓿发病率(c)和病情指数(d)Fig.1 AM colonization (a), root nodule number (b), disease incidence (c) and disease index (d) under different treatments 图中不同小写字母表示不同处理间存在显著差异(P<0.05),下同。Different lowercase letters on the bars show significant difference within the treatments at 0.05 level, the same below.
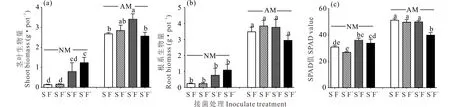
图2 不同处理下苜蓿茎叶生物量(a)、根系生物量(b)和SPAD值(c)Fig.2 Shoot biomass (a), root biomass (b) and SPAD value (c) under different treatments
2.4 苜蓿根系抗氧化酶活性及丙二醛含量
本研究测定了苜蓿地上、地下抗病相关酶及信号传导物质,均以苜蓿根系对AM真菌、根瘤菌及病原菌的响应更为敏感,而各接菌处理下茎叶相关酶指标无显著差异,因此不再进行科学分析,结果部分仅展示根系指标。
根瘤菌显著提高了苜蓿根系超氧化物歧化酶(SOD)活性(P<0.01)。相较于对照处理,根瘤菌、AM真菌分别提高苜蓿根系SOD活性27.8%和28.4%以上,二者互作处理下苜蓿根系SOD活性提高41.05%(图4a)。AM真菌、根瘤菌单独及双接菌分别降低苜蓿丙二醛(MDA)含量16.82%、7.73%和24.57%(图4b)。
2.5 苜蓿根系病程相关水解酶及苯丙氨酸解氨酶活性
AM真菌和根瘤菌互作可提高苜蓿根系β-1, 3-葡聚糖酶活性(P<0.05)。AMS-F-、AMS-F+和AMS+F+处理下,β-1, 3-葡聚糖酶活性比对照分别高出33.84%、29.44%和31.06%。NM处理下,各接菌处理间β-1, 3-葡聚糖酶活性无显著差异(图5a)。
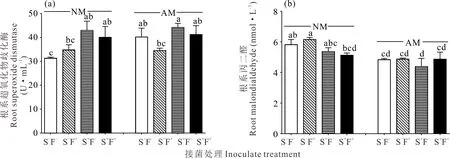
图4 不同处理下苜蓿根系超氧化物歧化酶活性(a)和丙二醛含量(b)Fig.4 Root superoxide dismutase activity (a) and malondialdehyde content (b) under different treatments

图5 不同处理下苜蓿根系β-1, 3-葡聚糖酶(a)和苯丙氨酸解氨酶活性(b)Fig.5 Root β-1, 3-glucanase (a) and phenylalanine ammonialyase activity (b) under different treatments
AM真菌、根瘤菌均显著降低了苜蓿根系苯丙氨酸解氨酶活性,且有交互效应(P<0.01)。相较于对照(NMS-F-),根瘤菌(NMS+F-、NMS+F+、AMS+F-、AMS+F+)、病原菌(NMS-F+、NMS+F+、AMS-F+、AMS+F+)下苜蓿PAL酶活性分别降低28.97%和28.85%,3种微生物互作(AMS+F+)下苜蓿根系PAL酶活性较对照降低14.96%(图5b)。
2.6 抗病相关植物激素及物质
根瘤菌和病原菌互作显著降低苜蓿根系脱落酸(ABA)、一氧化氮(NO)和过氧化氢(H2O2)浓度(P<0.05)。AM真菌单独处理下,苜蓿根系ABA、NO 和H2O2浓度平均分别较对照降低19.36%、23.06%和24.19%;AM真菌+根瘤菌处理下,ABA、NO和H2O2浓度分别降低26.68%、9.63%和25.26%(图6a,b,c)。
根瘤菌和病原菌交互作用极显著增加了紫花苜蓿根系茉莉酸浓度(P<0.01),其中AMS+F-处理下苜蓿根系JA浓度较对照高23.32%,其余各接菌处理下无显著差异(P>0.05)(图6d)。3种微生物均显著促进了苜蓿根系木质素浓度(P<0.05),促进范围为18.28%~50.69%(图6e)。

图6 不同处理下苜蓿根系脱落酸(a)、一氧化氮(b)、过氧化氢(c)、茉莉酸(d)和木质素(e)浓度Fig.6 Root abscisic acid (a), nitric oxide (b), hydrogen peroxide (c), jasmonic acid (d) and lignin (e) concentrations under different treatments
3 讨论
本研究在温室条件下,通过接种AM真菌、根瘤菌和病原菌,研究了苜蓿萎蔫根腐病重要病原(尖孢镰刀菌)对我国主要苜蓿栽培品种(陇东苜蓿)生长和生理生化反应的影响。发现AM真菌和根瘤菌可以促进植物生长、养分吸收,通过调节相关酶活性、生化物质浓度,减轻镰刀菌萎蔫根腐病的发生。对于理解AM真菌、根瘤菌作为生防菌调控植物病害的生理机制具有重要作用。
AM真菌、根瘤菌均促进了紫花苜蓿N、P吸收和生物量,且AM真菌促生作用更为显著。病原菌降低了紫花苜蓿叶绿素含量,但未显著影响紫花苜蓿生物量和N、P吸收。AM真菌显著促进了苜蓿根部结瘤,源于其对植物根系生长的显著促进作用,为根瘤菌创造了更大的侵染面积和结合位点,这与Tajini等[30]对菜豆(Phaseolusvulgaris)的研究结果一致。同时,AM真菌的侵染可促进豆科植物根瘤相关基因的表达[31],二者表现为相互促进。
AM真菌和根瘤菌的互惠共生关系具有古老的起源[33],本研究中AM真菌显著促进了苜蓿根系结瘤,一个直观的原因为AM真菌显著促进了苜蓿生长,苜蓿根系生物量、根系长均增加,为根瘤菌创造了更大的侵染面积和结合位点。研究发现,菌根菌与根瘤菌共生体存在关联的信号转导途径,二者互惠共生相互促进[31],但本研究中AM真菌侵染率、根瘤数显示根瘤菌与AM真菌有竞争趋势,可能与植物-微生物组合、土壤类型、土壤养分等相关,这也体现出了植物-微生物-环境互作的复杂性。此外,AM真菌对于苜蓿生长及叶绿素合成的促进作用显著高于根瘤菌,这种促进作用自苜蓿生长初期就表现为显著;相反的,根瘤菌对苜蓿生长促进作用主要体现于苜蓿生长后期,以2种共生微生物互作处理下苜蓿株高最高。这与两类微生物促生机理相关,AM真菌仅仅是帮助植物吸收养分,当土壤中有限的养分吸收殆尽时,其作用即从共生转为寄生,而根瘤菌具有固氮作用,可在植物生长期固氮。因此,在土壤养分有限的情况下,根瘤菌处理将在植物生长后期发挥更大的作用。
本研究发现,在根腐病发生早期,苜蓿根系尚未显示腐烂症状,但苜蓿地上部分萎蔫、黄化已很严重,即便如此,植物根系苯丙氨酸解氨酶(PAL)、脱落酸(ABA),木质素、丙二醛(MDA)等相关生化指标对病菌的侵染较植物叶片更为敏感,病原菌的侵染显著地影响了根系上述指标的含量,但未显著影响植物叶片上述指标。木质素通常被认为是阻碍病原菌扩散的物理屏障,有研究认为木质素沉积可以阻止养分和水分向病原菌的转移,也可能会通过阻止病原菌的毒素和酶扩散来抑制病原菌传播[32]。MDA是细胞膜脂过氧化的主要产物之一,可以代表细胞膜损伤程度的大小,通常植物细胞膜损伤越严重,植物体MDA沉积量越多。苜蓿根系木质素和MDA浓度降低,可能反映出苜蓿受到病害胁迫的程度降低,因此推断AM真菌和根瘤菌两类微生物均降低了病原菌对苜蓿的胁迫。此外,AM真菌显著提高了苜蓿根系PAL浓度。PAL可通过参与植保素、木质素等其他物质的合成间接参与植物抗病过程,通常PAL浓度越高植物抗病性越强[34-35]。马静芳等[36]对镰刀菌苜蓿根腐病的研究也发现,PAL活性与苜蓿抗病性显著正相关,苜蓿茎叶根系PAL活性存在显著差异。
除上述生化指标外,病原菌侵染植物过程中,植物其他相关酶活性、激素浓度及信号物质会发生一系列变化,其中SOD是活性氧清除系统中第一个发挥作用的重要氧自由基清除酶。活性氧迸发(oxidative burst)被认为是植物感病时发生的特征性反应,大量活性氧自由基可以激发植物的免疫反应机制,也是植物应对病原菌侵染的前期反应之一[37]。本研究发现,在所有处理中,AM真菌和根瘤菌互作处理下的苜蓿根系SOD活性最高。通常感染病害的植株其体内SOD活性都有所增强,但生物是一个复杂的有机体,夏民旋等[38]发现,病害导致植株活性氧自由基迸发后,机体对于活性氧自由基的清除过程中有大量酶促反应和细胞代谢过程参与,SOD并非单独作用而是通过与其他抗氧化酶以及非酶类抗氧化保护系统协调平衡,来完成对植物体内活性氧自由基的清除,这也说明了单一酶活性高低对植物抗病能力的影响有限。在病原菌胁迫下,植物可以通过多种途径强化抗病能力。
β-1,3-葡聚糖酶是一种重要的PR(pathogenesis related protein)蛋白,当病原物入侵植物体时,植物体内几丁质酶、β-1,3-葡聚糖酶均会迅速积累,诱发防卫反应[39]。降解真菌病原菌的细胞壁主要成分β-1,3-葡聚糖,破病原菌细胞壁导致病原菌死亡。另外它也可以抑制真菌菌丝的延伸和生长,并释放真菌细胞壁诱导物,从而间接促进寄主体内植保素积累[40]。β-1,3-葡聚糖酶和几丁质酶可以分解暴露在真菌菌丝尖端的β-1,3-葡聚糖和几丁质,从而直接参与植物抗病过程[41]。本研究中β-1,3-葡聚糖酶和几丁质酶浓度没有显著差异和本次取样时间有很大关系,通常植物对病原菌的反应表现为短期、迅速地应答,本研究中为使得根腐病发病更为明显,选择在第5次病原菌接种48 d之后收苗。
NO是继乙烯之后自然界中发现的第二种气体信号分子,本研究中AM真菌和根瘤菌互作处理下一氧化氮浓度仅低于对照(图6b,P>0.05)。研究发现NO对病原菌无直接影响,而是通过其对植物的作用参与植物抗病机制的[42]。NO同时也具有独立诱导植物防御反应初期表达的Pal基因(PAL基因)的作用,从而合成植保素等抗病物质。此外,AM真菌和根瘤菌处理下苜蓿根系JA浓度达到最高,JA在植物抗病过程中起诱导作用,病原菌侵染通常会导致植物体内JA含量提高[43],并且有研究认为这种提高过程会由于植物抗病性强弱表现出不同的时间进程[44]。由于JA可以诱导植物特异基因表达,合成PAL等相关防御蛋白,促使植物产生木质素等防御相关物质,从而提高植物抗病性[45],因此可以认为植物提高抗病相关激素基因表达也是植物对病原菌的应答效应之一。
4 结论
AM真菌和根瘤菌可显著促进紫花苜蓿N、P吸收和生长,提高植物抗氧化物酶活性,促进水解酶合成,提高根系木质素含量,调节植物激素浓度,进而降低病害对植物的损伤;根瘤菌强化了AM真菌的上述作用,进一步降低了病害的发生和危害,二者具有良好的生防潜力。本研究是该领域为数不多的报道,有助于理解共生微生物调控植物抗病的生理生化机制。基于本研究结果,今后应加强植物病害相关酶、生理生化物质代谢通路及调控基因表达的研究,从分子机理进一步阐释AM真菌、根瘤菌调控植物病害的机制。
