添加白菜尾菜和甲酸对干玉米秸秆贮存品质的影响
2019-08-30任海伟孙安琪任军乐李志忠范文广王昱刘菲菲沈佳莉孙文斌
任海伟,孙安琪,任军乐,李志忠*,范文广,王昱,刘菲菲,沈佳莉,孙文斌
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050; 2.兰州理工大学西部能源与环境研究中心,甘肃 兰州 730050; 3.甘肃省生物质能与太阳能互补供能系统重点实验室,甘肃 兰州 730050; 4.西北低碳城镇支撑技术协同创新中心,甘肃 兰州 730050)
作物秸秆是我国资源量最为丰富的大宗农业副产品,被广泛用于动物青贮饲料[1]、生物能源[2-3]、活性炭制备[4]等领域,但由于秸秆收获具有明显季节性与时效性,使得如何有效衔接秸秆贮存和利用环节始终是其规模化应用的限制因素。另一方面,由于我国农耕条件和耕作习惯等因素,大多数玉米秸秆收获时已处于萎蔫或干黄状态,此时的秸秆已严重纤维化,水分和糖分大量流失,实现干秸秆的长时间保质贮存已成为资源化利用的重要前提。常见的规模化秸秆保存方法有干法和湿法贮存两类,其中机械通风等干法贮存具有成本高、干物质损失大、火灾风险等缺陷;而湿法贮存是秸秆等生物质原料在适宜水分和营养条件下进行厌氧密闭保存,主要依赖乳酸细菌等微生物菌群的微生态平衡来发挥腐败菌抑制作用,这种方法作业简便、成本低、安全性高,被广泛用于动物饲草的跨季节贮存[5]。然而,不同收获阶段的秸秆因其理化特征差异需要选择不同的贮存方法。一般情况下,鲜绿秸秆由于水分和养分较为充足,常采用直接或混合青贮,此时推荐的适宜干物质含量约35%,而干黄秸秆的自身干物质含量高达70%~80%,木质纤维化程度严重,需要与马铃薯渣[6]、玉米浆[7]和花椰菜茎叶[8]等高含湿、高营养物质混贮,才能满足青贮对水分、糖分等营养物质的必要条件。我国是蔬菜种植和生产大国,2017年蔬菜产量约81000万t,其中约有30%尾菜(蔬菜根、茎、叶、盘等)被废弃或填埋,资源化利用迫在眉睫。研究表明,干秸秆与白菜(Brassicapekinensis)、莴笋(Lactucasativa)叶等尾菜混合贮存能实现干秸秆湿法贮存,解决尾菜问题[9-10],这种混贮模式非常适宜在西北干旱地区推广,避免秸秆复水带来的水资源浪费。但由于干秸秆自身的“营养缺乏”瓶颈,使其与尾菜的混贮发酵过程仍需优化调控,从而进一步改善贮存品质。
适宜的微生物菌剂、酶制剂、化学试剂等添加剂能有效改善青贮品质,其中有机酸是常用的发酵抑制剂,能在发酵初期快速降低pH值,有效抑制腐败菌生长[11]。张晓庆等[12]认为添加甲酸能显著降低pH值和氨态氮,得到品质优良的麻叶荨麻(Urticacannabina)青贮料。郭艳萍等[13]发现添加乙酸能显著提高青贮高粱(Sorghumbicolor)的乳酸含量,添加丙酸能显著降低青贮pH值和氨态氮含量。白春生等[14]发现添加甲酸和丙酸能降低羊草(Leymuschinensis)青贮pH值和氨态氮含量,提高发酵品质。李君风等[15]认为乙酸能改善燕麦(Avenafatua)和紫花苜蓿(Medicagosativa)混合青贮发酵品质并提高有氧稳定性。Schmidt等[16]发现添加乙酸能有效降低玉米(Zeamays)青贮pH值,防止腐败变质。究其原因,青贮发酵本质上是乳酸菌等微生物菌群协同作用的动态生化变化过程,了解贮存过程中的微生物菌群多样性对其发酵品质调控至关重要。近年来,高通量测序技术因其能全面准确描述微生物群落和微生态信息,被广泛用于土壤、海洋、肠道及极端生境的微生物多样性研究,而应用于青贮微生物的研究报道还相对较少。熊乙等[17]利用高通量测序技术分析比较了全国5个主要地区牧场中全株玉米青贮饲料的微生物(乳酸菌、酵母菌、霉菌)多样性。Ni等[18]利用MiSeq PE300平台分析了乳酸菌和糖蜜添加剂对大豆青贮过程中微生物群落变化的影响,发现二者组合添加能提高乳杆菌属(Lactobacillus)丰度,降低梭菌属(Clostridium)和肠杆菌属(Enterobacter)等不良微生物丰度。Li等[19]利用MiSeq PE300研究了加入微藻对五节芒(Miscanthusfloridulus)青贮过程中优势乳酸菌及腐败菌等微生物菌群的影响,发现青贮过程中厚壁菌门是最丰富的细菌门,添加微藻后乳杆菌属为优势菌属。Ogunade等[20]通过Illumina MiSeq分析了不同添加剂对青贮苜蓿微生物多样性的影响,发现添加植物乳杆菌和布氏乳杆菌改变了青贮苜蓿的微生物组成,提高了乳杆菌属相对丰度。
为进一步优化调控干秸秆贮存过程,本试验以干玉米秸秆为原料,首先从化学组分和发酵产物构成模式等方面研究了添加废弃白菜对干秸秆贮存品质的动态影响,在此基础上分析添加甲酸对干秸秆/废弃白菜混贮发酵品质的调控效果,并利用MiSeq高通量测序技术分析贮存过程中的微生物菌群动态演绎过程,为实现干秸秆的高品质、可调控、长时间湿法贮存提供理论基础。
1 材料与方法
1.1 材料与试剂
干玉米秸秆(dry corn stalk,DCS)收集自甘肃省定西市陇西县,摘穗后田间留置3个月,含水量为10.23%,粉碎至0.5~1.0 cm备用;废弃白菜(cabbage waste,CW)收集自兰州市七里河区职工菜市场,含水量为91.41%,切碎至2 cm×2 cm备用;甲酸(formic acid,FA)等化学试剂为分析纯;DNA试剂盒采用Water DNA Isolation Kit,购自成都福际生物技术有限公司。
1.2 干玉米秸秆的贮存试验设计
本试验设置1个对照组和2个混合贮存组,其中SE组为干秸秆单独密闭贮存对照组,ME组为干秸秆与废弃白菜混合贮存处理组,FB组为添加甲酸的干秸秆/废弃白菜混合贮存处理组(表1),甲酸添加量为0.6%(质量分数),每组3个重复,填实密封后恒温(18±1 ℃)连续贮存60 d(试验时间为2015年1月至2月),分别于30和60 d分析其化学组分、发酵品质和细菌多样性。

表1 干玉米秸秆和废弃白菜贮存试验设计Table 1 Storage experiment design of dry corn stalk and cabbage waste based on silage theory
1.3 贮存样品预处理及其分析方法
按照四分法称取3份有代表性的贮存样品20 g,其中一份以1∶9加蒸馏水混合打浆,经4层纱布和定性滤纸过滤后3900 r·min-1离心10 min,离心后的上清液经抽滤得澄清液,使用丹佛UB-7型酸度计测定pH后于-20 ℃冻存,用于测定乳酸(lactic acid,LA)、乙酸(acetic acid,AA)、丙酸(propionic acid,PPA)、丁酸(butyric acid,BA)、乙醇(ethanol,EA)和氨态氮(ammonia nitrogen,AN)等小分子有机物;使用SBA-40X生物传感器(山东省科学院生物研究所)测定乳酸和乙醇含量,采用苯酚-次氯酸比色法测定氨态氮含量,采用GC9790II气相色谱仪(浙江福立分析仪器有限公司)测定乙酸、丙酸和丁酸等含量,总有机酸(total organic acid)包括乳酸、乙酸、丙酸和丁酸等小分子酸[13]。
另一份样品于105 ℃烘干至恒重,粉碎过筛(孔径为0.45 mm)用于测定可溶性碳水化合物(water soluble carbohydrates,WSC)、总氮(total nitrogen,TN)以及酸性洗涤纤维(acid detergent fiber,ADF)、中性洗涤纤维(natural detergent fiber,NDF)和酸性洗涤木质素(acid detergent lignin,ADL)等木质纤维组分;采用蒽酮-硫酸比色法测定WSC[13]含量,使用F800纤维测定仪测定NDF、ADF、ADL含量,纤维素(cellulose,CL)、半纤维素(hemicellulose,HC)和综纤维素(holocellulose,HoC)含量由公式CL=ADF-ADL、HC=NDF-ADF、HoC=CL+HC计算得出,使用K9840凯氏定氮分析仪(山东海能科技有限公司)测定总氮含量。
第3份样品用于DNA提取和微生物多样性分析。无菌环境下,将20 g样品与200 mL无菌生理盐水混合,37 ℃恒温振荡2 h制得菌悬液,再用孔径0.22 μm无菌滤膜过滤得到微生物菌体。将整张带有菌体的滤膜剪碎后置于2 mL无菌离心管中,按照Water DNA Isolation Kit 试剂盒方法提取总DNA,经2%琼脂糖凝胶电泳检测合格后送上海派森诺生物科技有限公司Illumina Miseq平台测序分析。选定相对丰度高于0.1%的细菌制作菌群微生态分布图,并从门、属水平进行微生物多样性分析[21]。
1.4 数据分析
基础数据经Excel 2010软件整理,利用SPSS 20.0软件进行统计分析,结果用平均值±标准差表示,对不同处理组数据进行单因素方差分析,P<0.05代表数据存在显著性差异。
2 结果与分析
2.1 添加废弃白菜和有机酸对贮存品质的动态影响
2.1.1干秸秆添加废弃白菜贮存DM和WSC含量的动态 贮存30和60 d时,3个试验组中的DM和WSC含量均显著低于0 d(P<0.05)(表2)。混合废弃白菜后,ME和FB组2个混合贮存组中DM含量均显著低于SE组,且贮存60 d时FB组中DM含量显著低于ME组(P<0.05)。另外,相对于干秸秆的低WSC含量,加入废弃白菜后混贮体系中的WSC含量显著高于SE组(P<0.05),达到9.53%,符合糖含量青贮必要条件范围(8~10% DM);但贮存30和60 d后,ME组中的WSC含量却显著低于SE组(P<0.05),说明WSC组分被湿法贮存过程中的微生物菌群消耗利用;而加入甲酸的FB组中WSC含量显著高于ME组(P<0.05),说明加入有机酸抑制了微生物对糖的代谢利用,有利于WSC组分保存。
2.1.2干秸秆添加废弃白菜贮存纤维组分的动态 贮存期间3个试验组中的木质纤维组分含量变化趋势较为复杂(表3)。总体上看,随贮存时间延长,SE和ME组中ADL含量呈先减少后增加的趋势,HC、CL和HoC含量均呈先增加后减少的趋势(除SE组中CL和HoC);而FB组中ADL含量则显著下降(P<0.05),HC和HoC显著增加(P<0.05)。另一方面,贮存期间2个混合贮存组中NDF含量均显著低于SE组(P<0.05); 且与ME组相比, FB组中NDF含量显著减少(P<0.05)。60 d时2个混合贮存组中ADF含量显著低于SE组(P<0.05),且FB组中ADF含量显著低于ME组(P<0.05)。2个混合贮存组中,ADL含量在0和30 d时均显著高于SE组(P<0.05);60 d时均低于SE组,且FB组中ADL含量显著低于ME组(P<0.05)。30 d时,ME组中HC、CL和HoC含量均显著低于SE组(P<0.05),同时FB组中三者含量均显著低于ME组(P<0.05),但60 d时FB组中HC和HoC含量均显著高于ME组(P<0.05)。
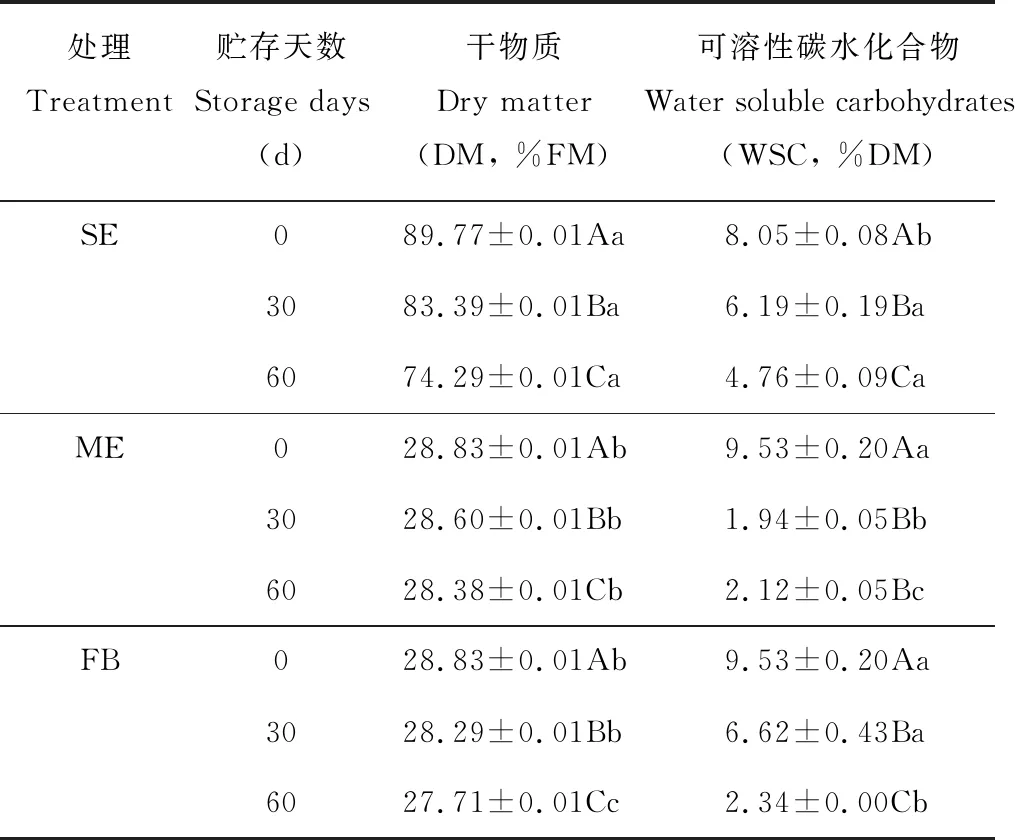
表2 贮存过程中干物质和可溶性碳水化合物含量的动态变化Table 2 Dynamic changes on the content of dry matter (DM) and water soluble carbohydrates (WSC) during storage
注:同列不同小写字母表示相同时间不同处理组差异显著(P<0.05),同列不同大写字母表示相同处理组不同时间差异显著(P<0.05)。FM:鲜重。下同。
Note: The different lowercase within the same column indicate significant differences atP<0.05 between different groups at the same time, the different capital letters within the same column indicate significant differences atP<0.05 for the same groups within different time. FM: Fresh weight. The same below.
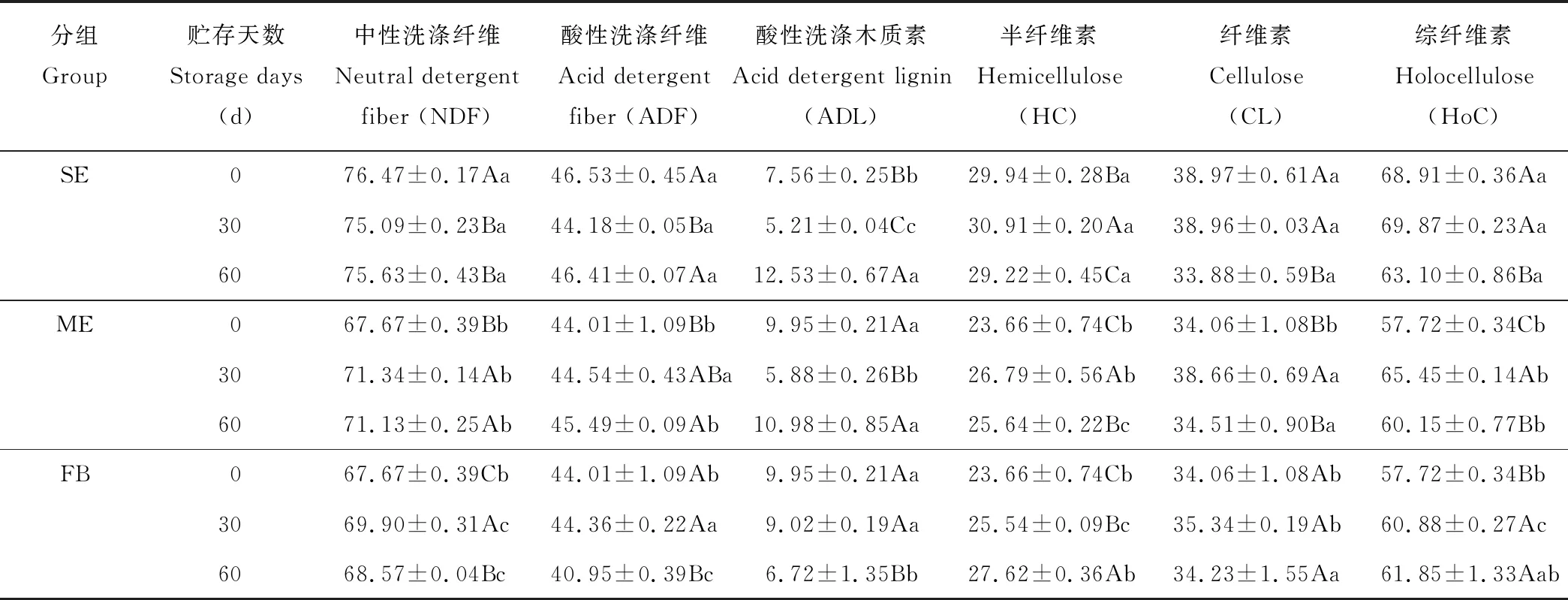
表3 贮存过程中木质纤维组分含量的动态变化Table 3 Dynamic changes on the content of lignocellulosic constituents during storage (%DM)
2.1.3干秸秆添加废弃白菜贮存pH和AN/TN的动态 贮存期间3个试验组中pH值均随时间延长显著升高(P<0.05);ME和FB组的pH值均显著低于SE组(P<0.05),且FB组pH值在30 d时与ME组差异不显著(P>0.05),60 d时显著高于ME组(P<0.05)(表4)。另一方面,SE组中AN/TN值随时间延长显著升高(P<0.05),ME组变化差异不显著(P>0.05),FB组AN/TN值显著下降(P<0.05)。而且,贮存期间3个试验组的AN/TN值均远低于优良青贮推荐值10%。
2.1.4干秸秆添加废弃白菜贮存发酵特性参数的动态 SE、ME和FB组中LA和AA含量均随时间延长显著增加(P<0.05)(表5)。贮存期间2个混贮组中LA含量均显著高于SE组(P<0.05),且ME组始终显著高于FB组(P<0.05);贮存期间FB组中AA含量最低,说明添加甲酸抑制了LA和AA生成。贮存期间3个试验组PPA含量均低于0.1%,BA含量均低于1%,处于良好青贮品质范围。2个混贮组中的LA/AA和LA/TOA值远高于SE组,但FB组这2个指标低于ME组,说明有机酸抑制了乳酸发酵强度。

表4 贮存过程中pH和AN/TN值的变化Table 4 Dynamic changes of pH and AN/TN during storage

表5 贮存过程中发酵特性的动态变化Table 5 Dynamic changes of fermentation profile during storage
2.2 干秸秆添加废弃白菜贮存微生物多样性的动态
2.2.1门水平细菌群落分析 干玉米秸秆主要附着有变形菌门(65.26%)、厚壁菌门(33.78%)和少量拟杆菌门、放线菌门细菌,但后两者丰度之和不足1%。废弃白菜主要附着变形菌门(80.23%)、拟杆菌门(18.57%)和少量厚壁菌门、放线菌门、蓝藻(三者丰度均<1%)门细菌(图1)。干秸秆单一贮存(SE组)60 d期间,变形菌门细菌丰度始终保持最高值,30、60 d时分别为81.80%和64.30%;而厚壁菌门细菌丰度大幅下降至3.10%(30 d)、9.60%(60 d)。对添加白菜和甲酸的混合贮存组而言,ME组中厚壁菌门细菌丰度最高,30 d时为51.10%,60 d时增至56.60%,而FB组厚壁菌门细菌在30、60 d时的丰度分别为33.00%和56.20%。与SE组相比,ME和FB组中变形菌门细菌丰度均有所下降,30 d时丰度分别为48.30%和60.00%,60 d时丰度分别下降至40.40%和42.10%。另外,贮存期间,SE组中还存在一定量拟杆菌门细菌,30、60 d时的丰度分别为11.90%和22.00%,而ME和FB组中拟杆菌门细菌丰度均较低,介于0.50%~6.40%。
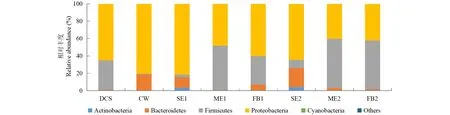
图1 贮存过程中门水平上细菌群落组成Fig.1 The bacterial community composition in phylum level during storage DCS:干玉米秸秆;CW:废弃白菜;SE、ME、FB的后缀1, 2分别表示贮存周期为30,60 d。下同。DCS: Dry corn stalk; CW: Cabbage waste; The suffixes with 1, 2 of SE, ME, FB: storage period for 30, 60 d respectively. The same below. Actinobacteria: 放线菌门; Bacteroidetes: 拟杆菌门; Firmicutes: 厚壁菌门; Proteobacteria: 变形菌门; Cyanobacteria: 蓝藻; Others: 其他.
2.2.2属水平细菌群落及乳酸菌多样性分析 干玉米秸秆主要包含肉食杆菌属(27.71%)等乳酸细菌和肠杆菌属(47.11%)、泛生菌属(10.14%)、耶尔森菌属(4.76%)、微小杆菌属(3.46%)、假单胞菌属(2.27%)等非乳酸细菌。废弃白菜中主要包含假单胞菌属(48.40%)、泛生菌属(17.10%)、黄杆菌属(16.26%)等非乳酸细菌,乳酸细菌总丰度不足1%,含量极少(图2和图3)。干秸秆单独贮存(SE组)过程中,乳酸细菌总丰度始终低于1.10%,30 d时乳酸细菌主要有乳球菌属、肠球菌属和肉食杆菌属,60 d时演变为类乳杆菌属和乳杆菌属;而SE组中的非乳酸细菌总丰度在30、60 d时分别高达90.20%、84.70%,主要包括欧文氏菌属(Erwinia)、肠杆菌属、假单胞菌属、地杆菌属、葡萄球菌属、金黄杆菌属、农杆菌属、鞘脂单胞菌科等。此外,SE组中还存在一些未知细菌(30 d时8.70%;60 d时14.90%)。
添加废弃白菜与干玉米秸秆混贮后,ME组中乳酸细菌多样性较SE组变得更加丰富,主要包括乳杆菌属、类乳杆菌属、肉食杆菌属、乳球菌属、片球菌属、肠球菌属等细菌,其中乳杆菌属和类乳杆菌属丰度较高,30 d时分别为20.70%和22.90%,60 d时演变为35.40%和15.40%,且乳酸细菌总丰度随时间延长而增加,由30 d时49.90%增至60 d时54.90%。加入甲酸后FB组中乳酸细菌由30 d时的类乳杆菌属(15.50%)、毛形螺菌属(8.60%)、乳杆菌属(4.80%)等演变为60 d时的乳杆菌属(25.40%)、类乳杆菌属(21.90%)、片球菌属(7.60%)等,乳酸细菌总丰度从30 d时30.90%上升至60 d时55%。总之,与SE组相比,ME和FB组中乳酸细菌多样性变得更丰富。另一方面,2个混合贮存组中含量最高的腐败细菌均为肠杆菌属,30 d时丰度分别为44.90%(ME组)、49.90%(FB组),60 d时均被有效抑制,丰度分别降至36.00%、33.10%;另外,ME和FB组还有少量地杆菌属、欧文氏菌属、鞘脂单胞菌科、黄杆菌属、金黄杆菌属等细菌。

图2 贮存过程中属水平上细菌群落组成Fig.2 The bacterial community composition in genus level during storage Carnobacterium: 肉食杆菌属;Paralactobacillus: 类乳杆菌属;Lactobacillus: 乳杆菌属;Pediococcus: 片球菌属;Lactococcus: 乳球菌属;Lachnobacterium: 毛形螺菌属;Microbacteriaceae: 微杆菌科;Flavobacterium: 黄杆菌属;Chryseobacterium: 金黄杆菌属;Sphingobacteriaceae: 鞘脂杆菌科;Pedobacter: 地杆菌属;Sphingobacterium: 鞘氨醇杆菌属;Staphylococcus: 葡萄球菌属;Agrobacterium: 农杆菌属;Sphingomonadaceae: 鞘脂单胞菌科;Sphingomonas: 鞘脂单胞菌属;Comamonadaceae: 丛毛单胞菌科;Enterobacter: 肠杆菌属;Erwinia: 欧文氏菌属;Pantoea: 泛生菌属;Serratia: 沙雷氏菌属;Pseudomonas: 假单胞菌属;Xanthomonadaceae: 黄单胞菌科;Stenotrophomonas: 寡养单胞菌属;Caulobacteraceae: 柄杆菌科;Rhizobiales: 根瘤菌科;Devosia: 德沃斯氏菌属;Methylobacterium: 甲基杆菌属;Novosphingobium: 新鞘脂菌属;Sphingobium: 鞘脂菌属;Comamonas: 丛毛单胞菌属;Delftia: 代尔夫特菌属;Variovorax: 贪噬菌属;Pseudoxanthomonas: 假黄色单胞菌属;Exiguobacterium: 微小杆菌属;Yersinia: 耶尔森菌属;Saccharibacillus: 糖化杆菌;Cyanobacteria norank: 诺兰柯蓝细菌;Janthinobacterium: 詹森菌属;Duganella: 杜檊氏菌属;Others: 其他.

图3 贮存过程中乳酸菌属的细菌多样性Fig.3 The bacterial composition diversity of lactic acid bacteria (LAB) during storage Aerococcus: 气球菌属;Carnobacterium: 肉食杆菌属;Enterococcus: 肠球菌属;Paralactobacillus: 类乳杆菌属;Lactobacillus: 乳杆菌属;Pediococcus: 片球菌属;Lactococcus: 乳球菌属;Lachnobacterium: 毛形螺菌属;Other: 其他.
3 讨论
3.1 添加废弃白菜和有机酸对干物质和有机组分含量的影响
原料中干物质含量多寡是影响其青贮发酵品质的重要因素之一。试验中,干秸秆单一贮存60 d后干物质损失率最高为17.24%,而添加废弃白菜和有机酸混贮后的ME和FB组中干物质损失率分别为1.56%和3.88%,说明湿法贮存的干物质损失率远低于单一贮存,但FB组的干物质损失率大于ME组,原因可能是长时间酸性环境和有机酸加入能促使纤维中部分非结构性碳水化合物被降解[22],这与Shinners等[23]报道的干法贮存干物质损失率远高于湿法贮存结果一致。另一方面,可溶性碳水化合物(WSC)是发酵过程中微生物菌群繁殖代谢的重要底物,废弃白菜和干玉米秸秆混贮过程中WSC含量下降较快,原因可能是混合后湿法贮存环境使乳酸菌等微生物菌群繁殖代谢活性升高,增加了糖代谢消耗量;而添加甲酸后能使pH值迅速下降,从而抑制与呼吸作用相关的植物酶和微生物菌群活性,减少WSC利用,这与李君风等[15]报道结果基本一致。侯美玲等[24]也认为添加甲酸可显著提高天然牧草中WSC含量,因为添加甲酸对结构性碳水化合物具有一定酸解作用,释放更多的水溶性碳水化合物,促进乳酸发酵,改善青贮发酵品质。
木质纤维组分是秸秆干物质的主要成分,其含量多寡直接影响秸秆的生物降解效率。试验中,干秸秆单一贮存期间,木质纤维组分含量较高,依然保持干瘪韧性的物理状态,不利于秸秆降解[25]。而加入白菜或甲酸进行湿法贮存后,干秸秆变得软化湿润,木质纤维网络结构松散,有利于NDF和ADF含量降低,且添加甲酸效果更显著。张树攀等[26]也发现添加甲酸对高丹草青贮料中的NDF和ADF含量有一定降低作用。另一方面,木质素对纤维素和半纤维素具有物理性阻碍和牢固共价键束缚,使其降解利用的难度大大增加[27]。贮存60 d时2个混合贮存组中ADL含量均低于对照组,且添加甲酸后效果更明显,说明长时间酸性贮存环境有助于秸秆ADL组分的下降,提高生化转化效率。这与王莹等[28]报道甲酸处理组中ADL含量显著降低结果一致。
3.2 添加废弃白菜和有机酸对发酵品质的影响
研究表明,pH值与蛋白质降解程度密切相关,pH<4.2时蛋白质分解为较稳定的氨基酸,损失小;pH>4.2时,由于梭菌等腐败菌活动,使氨基酸分解成非蛋白氮(氨,胺等),造成蛋白质损失[29]。氨态氮/总氮值(AN/TN)反映了蛋白质和氨基酸分解程度,该值越大说明氨基酸和蛋白质分解越多,意味着贮存质量变差[30]。试验中,添加废弃白菜和有机酸的2个混合贮存组pH和AN/TN 值均显著低于单一贮存组,且3个试验组的AN/TN值均远低于良好发酵品质阈值10%,这与侯建建等[31]报道一致。
除pH值和AN/TN指标外,厌氧密闭贮存过程中发酵生成的有机酸及其构成模式也是评价发酵品质优劣的重要指标。与干秸秆单一贮存相比,添加废弃白菜进行湿法混合贮存的发酵方式有利于原料附着微生物对营养物质的代谢利用,添加废弃白菜和有机酸的2个混合贮存组中LA含量显著高于对照组,但添加甲酸的FB组中LA含量始终低于ME组。这可能是因为,一方面加入甲酸对乳酸发酵反应有直接抑制作用,另一方面甲酸的抑菌效果较弱,从而对酵母菌等微生物抑制作用微弱,少数有活性的酵母菌仍能代谢利用乳酸底物,从而使乳酸含量显著下降[32]。荣辉等[33]认为甲酸的抑菌作用取决于H+浓度效应和未离解酸的选择性抑菌效应,高添加量(6.6 mL·kg-1)时H+效应较强,能完全抑制微生物活性,从而降低乳酸生成量。另一方面,乳酸含量的升高又会对乳酸菌繁殖代谢产生反馈抑制作用,从而使乳酸含量随时间延长显著下降。乳酸/乙酸(LA/AA)反映了混贮体系中同型发酵程度的强弱,乳酸/总有机酸值(LA/TOA)反映了混贮体系的乳酸发酵强度。试验中,添加废弃白菜的湿法贮存体系中乳酸发酵程度较为强烈,而加入甲酸后的乳酸发酵强度有所抑制,但这种抑制作用随时间延长有所减弱。此外,3个试验组中丙酸和丁酸含量均较低,属于优质青贮范围[34]。总之,从有机酸角度来看,添加废弃白菜和有机酸的2个混合贮存组均具有良好的发酵品质。
3.3 添加废弃白菜和有机酸对贮存过程中细菌多样性的影响
干玉米秸秆贮存前的门水平优势菌为变形菌门和厚壁菌门,其中厚壁菌门是革兰氏阳性菌,主要有产芽孢、非产芽孢和支原体菌群,很多芽孢杆菌可以降解多种大分子化合物,如纤维素、淀粉、蛋白质等[35],变形菌门属革兰氏阴性菌,包括很多病原菌,如大肠杆菌等,会与乳酸菌竞争利用糖类,同时引起蛋白质降解[36]。当干秸秆单一贮存时,厚壁菌门丰度大幅下降,而加入废弃白菜和有机酸混贮后,厚壁菌门丰度升高,同时变形菌门丰度下降,这可能也是2个混合贮存组中NDF和ADF含量均有所下降的原因之一。陶莲等[36]也发现玉米秸秆青贮后厚壁菌门的菌群丰度显著增加。
同时,贮存过程中乳酸菌等微生物菌群的构成及丰度是不断变化的。从属水平细菌群落分析,干玉米秸秆主要含有肉食杆菌属和肠杆菌属等细菌,其中肠杆菌属属于好氧细菌,能消耗利用可溶性碳水化合物等营养成分引起秸秆腐败变质。干秸秆单一贮存后肠杆菌属丰度降低,总乳酸细菌丰度也大幅下降至1.10%左右,因为单一干秸秆贮存时的微生物生命活动接近于生理干燥状态,发酵活动相对微弱。添加废弃白菜混贮后,贮存体系中水分和糖分等营养物质得到补充,达到青贮必要条件(水分含量60%~70%[22],可溶性碳水化合物8%~10%DM),使ME组乳杆菌属和类乳杆菌属等乳酸细菌的丰度明显提高,并有效抑制肠杆菌属腐败细菌,使其丰度随时间延长逐渐下降。加入甲酸后的混贮体系中,30 d时总乳酸细菌丰度有所下降,60 d时又恢复到与ME组相近,且片球菌属丰度明显升高。与干秸秆单一贮存(SE)组相比,ME和FB组的总乳酸细菌丰度大幅升高,有效降低了发酵pH值,增加乳酸产量。这与陶莲等[36]报道的玉米秸秆青贮后片球菌属和乳杆菌属菌群丰度显著增加结果一致。Ogunade等[37]发现添加丙酸的青贮玉米中主要有乳杆菌属、鞘氨醇杆菌属、魏斯氏菌属、不动杆菌属、寡养单胞菌属、沙雷氏菌属等细菌。Dunière等[38]发现玉米青贮过程中主要存在类芽孢杆菌、黄杆菌科、鞘脂单胞菌属、微小杆菌属、根瘤菌科、不动杆菌属和布赫纳氏菌属等细菌。试验中,添加废弃白菜和有机酸的秸秆混贮体系中主要存在乳杆菌属、类乳杆菌属、片球菌属、肠杆菌属、欧文氏菌属、地杆菌属、鞘脂单胞菌科、黄杆菌属、金黄杆菌属等细菌群落,与上述报道不完全一致,这可能与原料种类、贮存温度及检测方法等因素有关。
4 结论
相较于干玉米秸秆单独密闭贮存,添加废弃白菜或甲酸进行湿法混合贮存更有利于减少原料中干物质损失。混贮体系中的低pH值和高有机酸含量能起到优化木质纤维结构组分和改善贮存品质的作用,且在长时间甲酸作用下,有助于保存可溶性碳水化合物、纤维素、半纤维素和综纤维素等能量组分。综合考虑,建议干玉米秸秆与废弃白菜进行混合湿法贮存,且添加适量甲酸的贮存效果最佳。
