罗布麻K+通道编码基因AvAKT1的克隆与表达分析
2019-08-30夏曾润王文颖刘亚琪王锁民
夏曾润,王文颖,刘亚琪,王锁民*
(1.兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020;2.农业农村部富硒产品开发与质量控制重点实验室,富硒食品开发国家地方联合工程实验室,安康市富硒产品研发中心,陕西 安康 725000)
K+是植物生长发育必需的三大营养元素之一,是植物体内含量最丰富的无机单价阳离子和60多种酶的活化剂,参与离子稳态、气孔运动、膜电位调节等诸多关键性生理生化代谢过程。研究表明,植物可通过维持体内高的K+/Na+并发挥K+高效的渗透调节作用来抵御盐和干旱等非生物胁迫[1]。可见,有效吸收K+并维持体内K+浓度相对稳定对植物适应逆境至关重要。
植物主要通过K+转运蛋白[2]和K+通道[3]两大系统从外界环境中吸收K+。普遍认为,Shaker家族的K+通道是介导植物K+吸收和转运、维持细胞内K+平衡的主要通道。1992年Sentenac等[4]首次从拟南芥(Arabidopsisthaliana) cNDA文库中筛选到Shaker家族内整流K+通道基因AKT1(ArabidopsisK+transporter 1),随后相继从水稻(Oryzasativa)、大麦(Hordeumvulgare)、番茄(Lycopersiconesculentum)、陆地棉(Gossypiumhirsutum)等多种植物中克隆得到[5-8]。Shaker家族K+通道多肽包含1个较短的N末端结构域、6个跨膜片段结构(S1~S6)组成的核心功能区域和1个较长的C末端区域。其中,在S5与S6之间有一个高度保守的膜孔道区域-P结构域(pore loop),其TXXTXGYGD序列是判断K+通道结构的标志;S4区域含有带正电的Arg/Lys残基,是K+通道的电压感应器,通过应答膜电位的变化改变通道构象,从而控制通道孔的开闭;C末端结构域位于胞质内,含有一个环核苷酸结合位点(cyclic nucleotide-binding domain,cNBD),并且在最靠C末端形成富含疏水酸性残基区(a domain rich in hydrophobic and acidic residues, KHA),是调节离子通道活性的重要部位[9-12]。此外,AKT1类K+通道在cNBD下游有锚蛋白域(ankyrin-related domain,ANKY),此结构有助于通道与细胞骨架的结合,可促进蛋白之间的相互作用[13-14]。
拟南芥Shaker家族K+通道是目前研究最为透彻的植物K+吸收通道,已有9个家族成员被分离鉴定。内整流K+通道AKT1的组织特异性较强,主要在成熟根表皮、皮层和内皮层细胞等部位表达,具有双亲和性,主要负责根系从土壤中吸收K+,并在调节根系生长发育中也起着重要作用[2,15-16]。akt1突变体的K+吸收能力明显下降,其根细胞原生质体内向电流消失,在低钾环境下表现出明显的敏感表型[17-18]。此外,Shaker家族成员AtKC1能与AKT1形成异源复合K+通道,调控AKT1通道的活性,进而影响低钾环境中拟南芥根部的K+吸收和积累过程[19-20]。Pilot等[21]发现,拟南芥内整流K+通道KAT1和KAT2主要在保卫细胞中表达,通过介导保卫细胞K+的跨膜流动来调控细胞渗透势和气孔运动。也有研究显示,K+通道在盐胁迫下可介导低亲和性Na+的吸收[22]。然而,Qi等[23]的研究表明,拟南芥中细胞质Na+浓度的提高抑制了AKT1对K+的吸收;在中度盐胁迫(50 mmol·L-1NaCl)下,拟南芥atakt1-2突变体与野生型植株相比,其Na+浓度及净吸收速率均没有显著差异[24]。AKT1的突变使植物对水分胁迫的响应增强,水培介质中添加聚乙二醇(PEG)时,akt1植株较野生型水分损失少,并表现为蒸腾作用降低,水分消耗减小,在响应脱落酸(ABA)时akt1植株气孔迅速关闭[25]。越来越多的研究表明,内整流K+通道在参与植物对K+的吸收、转运以及非生物胁迫响应过程中发挥重要作用。
罗布麻(Apocynumvenetum)系夹竹桃科(Apocynaceae)罗布麻属(Apocynum)多年生宿根草本植物或小灌木,广泛分布于干旱半干旱及盐碱地区,生态幅度广,具有很强的抗旱耐盐性,是我国西北荒漠地区一种兼具生态、经济和药用价值的新兴多用途植物资源,具有良好的产业化前景和巨大的开发潜力[26]。前期研究发现,土培条件下,罗布麻体内K+的积累量与高富钾植物空心莲子草(Alternantheraphiloxeroides)、商陆(Phytolaccaacinosa)相当[26];水培条件下,罗布麻在低钾环境下能保持与正常供钾等同的K+吸收和利用效率,在盐或干旱逆境中其可维持体内高且稳定的K+含量和K+/Na+[27],这表明罗布麻体内可能存在高活性的K+吸收途径。鉴于此,本研究从罗布麻中分离到内整流K+通道AvAKT1的编码基因,并分析其在低钾、盐及渗透胁迫条件下的表达丰度,以期为逆境条件下,罗布麻维持K+稳态的分子机制研究奠定基础。
1 材料与方法
1.1 试验材料
罗布麻种子采自新疆阿勒泰戈宝茶股份有限公司种质资源圃。种子经0.5%的高锰酸钾溶液消毒10 min,用蒸馏水冲洗干净后在常温黑暗条件下浸泡24 h,将其均匀撒播于盛有蛭石的穴盘(5 cm×5 cm×5 cm)中,培养至3周龄,移入水培盒(19 cm×13.5 cm×7.5 cm)培养1周。期间浇灌Hoagland营养液[2 mmol·L-1KNO3, 0.5 mmol·L-1KH2PO4, 0.5 mmol·L-1MgSO4·7H2O, 0.25 mmol·L-1Ca(NO3)2·4H2O, 1.25 mmol·L-1CaCl2·2H2O, 0.06 mmol·L-1Fe-citrate, 50 mmol·L-1H3BO3, 10 mmol·L-1MnCl2·4H2O, 1.6 mmol·L-1ZnSO4·7H2O, 0.6 mmol·L-1CuSO4·5H2O, 0.05 mmol·L-1Na2MoO4·2H2O, pH=5.7],营养液每2 d更换一次。培养室昼/夜温度为25 ℃/22 ℃,光照时间为16 h·d-1,光强度约为230 μmol·m-2·s-1,空气相对湿度60%~70%。
1.2 材料处理
生长4周龄的罗布麻幼苗,分别做以下处理:1)对照:浇灌Hoagland营养液;2)盐处理:用含有25 mmol·L-1NaCl的Hoagland营养液处理6 h;3)渗透胁迫:用山梨醇调节渗透势大小为-0.2 MPa的Hoagland营养液处理6 h;4)钾处理:先用含有0.01 mmol·L-1K+的Hoagland营养液(分别用2 mmol·L-1HNO3和0.5 mmol·L-1H3PO4代替2 mmol·L-1KNO3和0.5 mmol·L-1KH2PO4,补充0.01 mmol·L-1KCl,用Tris溶液调整pH为5.7)处理3 d,随后分别用含有0.1和5.0 mmol·L-1K+的Hoagland营养液处理0、6、48 h。处理液每12 h更换一次。处理结束后,分别收集根、茎、叶,迅速于液氮中冷冻用于RNA提取。
1.3 总RNA的提取和cDNA的合成
参照UNIQ-10柱式Trizol总RNA抽提试剂盒(生工生物,上海)说明书提取总RNA。参照PrimeScriptTM1st strand cDNA Synthesis Kit试剂盒(TaKaRa,大连)进行反转录,合成cDNA第一链。根据SMARTerTMRACE cDNA Kit试剂盒(Clontech,USA)进行RACE反转录,合成5′-cDNA和3′-cDNA第一链。
1.4 AvAKT1基因的克隆
通过同源多重比对已分离得到的高等植物AKT1核苷酸序列,确定保守序列,利用DNAMAN 6.0和Primer 5.0设计简并引物P1和P2 (表1)。以盐处理下罗布麻根系的cDNA为模板,使用PrimeSTAR®高保真DNA聚合酶(TaKaRa,大连)扩增AvAKT1核心片段。PCR扩增在20 μL反应体系中进行,反应程序为:98 ℃预变性2 min;98 ℃变性10 s、53 ℃退火15 s、72 ℃延伸60 s,35个循环;72 ℃再延伸10 min,4 ℃保存。回收纯化得到的PCR产物连接pMD19-T载体(TaKaRa,大连),转入大肠杆菌(Escherichiacoli) DH5α感受态细胞,经蓝白斑筛选、鉴定阳性克隆后送至生工生物(上海)股份有限公司测序。
根据测序所得核心片断序列分别设计5′端和3′端外侧特异引物P3、P5和巢式特异引物P4、P6 (表1)分别与试剂盒提供的引物P7、P8配对,采用Phusion®超保真DNA聚合酶(Thermo,USA)进行外侧和巢式PCR扩增。外侧PCR反应程序:98 ℃预变性30 s;98 ℃变性10 s、55 ℃退火30 s、72 ℃延伸55 s(5′-RACE)和75 s (3′-RACE),35个循环;72 ℃再延伸10 min,4 ℃保存。巢式PCR反应程序:98 ℃预变性30 s;98 ℃变性10 s、55 ℃退火30 s、72 ℃延伸45 s (5′-RACE)和60 s (3′-RACE),35个循环;72 ℃再延伸10 min,4 ℃保存。将测序得到的核心、5′-RACE和3′-RACE序列进行拼接,获得AvAKT1全长cDNA序列。
1.5 生物信息学分析
将编码的氨基酸序列在NCBI (www.ncbi.nlm.nih.gov/BLAST)网站上进行Blast比对分析,检索该基因与其他物种的同源性;序列的翻译、开放阅读框(open reading frame,ORF)的分析及氨基酸序列的多重比对通过生物软件DNAMAN实现;该基因编码蛋白的等电点和分子量通过在线软件ProtParam (http://www.expasy.org/tools/protparam.html)预测;利用TMpred (http://www.ch.embnet.org/software/TMPRED_form.html)预测蛋白的跨膜结构域。采用MEGA 6.0软件中的临近法构建系统进化树,校验参数Bootstrap重复1000次。
1.6 AvAKT1基因表达模式分析
参考SYBR®Premix Ex Taq II试剂盒(TaKaRa,大连)说明书,以P9、P10为扩增引物,推测目的片段长度120 bp,采用ABI 7500荧光定量PCR仪(ABI,美国)检测不同处理下罗布麻AvAKT1的表达量;以罗布麻肌动蛋白编码基因AvACT(未发表数据)为内参基因,以P11、P12为扩增引物,推测目的片段长度112 bp。qRT-PCR反应程序为:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 34 s,40个循环。溶解曲线反应条件为:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。采用2-ΔΔct法[28]计算AvAKT1的相对表达量。每个样品重复3次。
1.7 数据分析
采用SPSS 18.0进行统计分析,结果以平均值±标准误表示。用Excel 2010、DNAMAN 6.0、TMHMM、MEGA 6.0等软件作图。
2 结果与分析
2.1 AvAKT1基因的克隆

表1 基因克隆和表达分析所用引物序列Table 1 Primer sequences used for gene cloning and expression analysis
以罗布麻根系cDNA为模板,设计简并引物进行扩增,获得约749 bp的核心片段(图1A);根据得到的核心片段设计引物,以RACE产物为模板,进行3′-RACE和5′-RACE扩增,分别获得长度约为1875 bp (图1B)和939 bp (图1C)的片段。测序结果经Blast比对分析,3个cDNA片段均与其他高等植物的AKT1有较高同源性,确定为罗布麻AKT1的编码基因片段。

图1 罗布麻AvAKT1基因PCR产物凝胶电泳检测Fig.1 Agarose gel electrophoresis of PCR products of AvAKT1 from A. venetum A: 核心片段扩增The RT-PCR product of the partial fragment; B: 3′-RACE; C: 5′-RACE; M: DL 2000 DNA marker.
2.2 AvAKT1基因序列及结构分析
用BioEdit软件拼接5′端、核心片段和3′端的核苷酸序列,得到一条全长为2906 bp的cDNA序列,该基因命名为AvAKT1。分析表明,AvAKT1的cDNA序列包括2700 bp的开放阅读框、55 bp的5′非翻译区(5′-untranslated region,5′UTR)以及151 bp含有poly-A尾巴的3′非翻译区(3′-untranslated region,3′UTR),推测其编码一个由899个氨基酸构成的多肽(图2)。在线软件ProtParam分析得出AvAKT1编码蛋白的理论等电点为7.05,蛋白质分子量为101.4 kDa。

图2 罗布麻AvAKT1的cDNA与预测的氨基酸序列Fig.2 The cDNA sequence and its predicted amino acid residues of AvAKT1 from A. venetum 方框处为起始密码子(ATG)和终止密码子(TGA)。The initiation codon (ATG) and termination codon (TGA) were framed with lines.
对AvAKT1基因编码的氨基酸序列进行疏水跨膜结构域和保守域预测分析,发现其包含6个高度保守的跨膜区(TM 1~TM 6),在TM 5和TM 6之间有一个高度保守的膜孔道区域(pore loop),C端包含一个推测的环核苷酸结合区(cNBD)和锚蛋白重复域(ANKY),且富含疏水性、酸性残基的KHA结构域(图3),符合典型的Shaker-like内整流K+通道结构特征。
2.3 同源序列和系统进化分析
运用DNAMAN软件分析发现该蛋白与其他高等植物的AKT1氨基酸序列的同源性在60%以上。其中,与烟草(Nicotianatabacum)NtAKT1的同源性最高,达76%;与大豆(Glycinemax)GmAKT1、拟南芥AtAKT1和小花碱茅(Puccinelliatenuiflora)PutAKT1的同源性分别为70%、64%和62% (图3)。
利用MEGA 6.0对AvAKT1与其他植物Shaker K+通道家族构建的系统进化树表明,Shaker K+通道家族分为5个亚族,AvAKT1隶属于第Ⅰ亚族(AKT1亚族),与烟草NtAKT1属同一进化分枝,与双子叶植物拟南芥AtAKT1、大豆GmAKT1亲缘关系较近(图4)。
2.4 AvAKT1的表达模式分析
正常条件下罗布麻AvAKT1主要在根中表达,在植株地上部的表达量极少,尤其在叶中几乎不表达(图5)。采用qRT-PCR检测不同浓度K+、盐和渗透胁迫处理下罗布麻根中AvAKT1表达水平的变化,结果表明,K+饥饿后添加5.0 mmol·L-1K+显著诱导了AvAKT1的表达(图6A);25 mmol·L-1NaCl和-0.2 MPa渗透胁迫处理时,AvAKT1的表达量在6 h受到显著诱导(图6B)。

图3 罗布麻AvAKT1与其他植物AKT1氨基酸序列多重对比Fig.3 Multiple sequence alignment of AvAKT1 with its homologs in other higher plants At: 拟南芥; Gm: 大豆; Nt: 烟草; Put: 小花碱茅。各基因编码氨基酸的GenBank登录号如下: AtAKT1(NM_128222), GmAKT1(XP_003549784), NtAKT1(XP_009619489), PutAKT1(GU327382)。TM 1~TM 6为6个跨膜域。At: A. thaliana; Gm: Glycine max; Nt: Nicotiana tabacum; Put: Puccinellia tenuiflora. Sources of Shaker-like K+ channel family and their GenBank accession numbers are as follows: AtAKT1(NM_128222), GmAKT1(XP_003549784), NtAKT1(XP_009619489), PutAKT1(GU327382). TM 1-TM 6 indicates the structures of the predicted trans-membrane segments of AvAKT1.
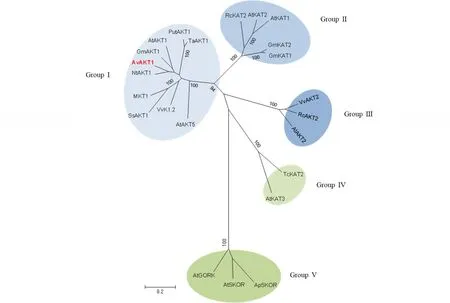
图4 AvAKT1与其他植物Shaker K+通道家族成员的系统进化分析Fig.4 Phylogenetic analysis of AvAKT1 (marked in red) with related Shaker-like K+ channel family Ap: 空心莲子草A. philoxeroides; At: 拟南芥A. thaliana; Gm: 大豆G. max; Nt: 烟草N. tabacum; Put: 小花碱茅P. tenuiflora; Rc: 蓖麻Ricinus communis; Ta: 小麦Triticum aestivum; Tc: 可可Theobroma cacao; Vv: 葡萄Vitis vinifera; Zm: 玉米Zea mays. 各基因编码氨基酸的GenBank登录号如下Sources of Shaker-like K+ channel family and their GenBank accession numbers are as follows: AtAKT1 (NM_128222), GmAKT1 (XP_003549784), NtAKT1 (XP_009619489), PutAKT1 (GU327382), TaAKT1 (AF207745), ZMK1 (CAA68912), VvK1.2 (FR669116), AtAKT5 (NP_194976), AtKAT1 (At5g46240), AtKAT2 (At4g18290), RcKAT2 (XP_002519693), GmKAT1 (XP_003541662), GmKAT2 (XP_003547208), AtAKT2 (At4g22200), VvAKT2 (XP_002268924), RcAKT2 (XP_002529533), AtKAT3 (At4g32650), TcKAT2 (EOY29638), AtSKOR (At3g02850), AtGORK (At5g37500), ApSKOR (AFO70199). 左下角标尺0.2表示系统进化树上进化枝的长短The scale bar 0.2 corresponds to the distance of clade on the evolutionary tree.
3 讨论

图5 罗布麻AvAKT1基因在根、茎和叶中的组织特异性Fig.5 The tissue expression characteristics of AvAKT1 in root, stem and leaf不同字母代表在P<0.05水平上差异显著(Duncan检验)。Columns with different letters indicant significant differences at P<0.05 (Duncan’s test).
植物通过根质膜上的K+通道和转运蛋白从环境中吸收K+。K+通道介导低亲和性K+的吸收,是特异性选择K+通过质膜的跨膜蛋白,也是离子通道中最庞大的家族,可分为Shaker、TPK与Kir-like三大家族[9,29-30]。研究显示,Shaker家族的成员在植物K+吸收和转运过程中发挥关键作用,对植物适应逆境至关重要[3,31]。
本研究从罗布麻根系中克隆并获得Shaker家族K+通道蛋白基因AvAKT1,其氨基酸序列的C末端包含Shaker家族K+通道的cNBD和KHA特征结构域,在cNBD下游还存在AKT1类K+通道区别于KAT1类的ANKY结构域,并在第5和第6跨膜区间具有Shaker家族K+通道高度保守和特异性序列TXXTXGYGD及P环孔道区域(图3),这些特征序列是鉴别Shaker家族K+通道蛋白的重要标准之一,也是K+通道蛋白功能的重要序列单元[12,14,32]。氨基酸序列比对和系统进化树分析显示,AvAKT1为第Ⅰ亚族(AKT1亚类)内整流K+通道蛋白,与烟草的同源性最高(图3,图4)。
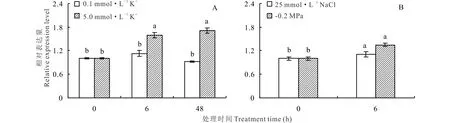
图6 不同处理下罗布麻根中AvAKT1相对表达量分析Fig.6 The expression level of AvAKT1 in root from A. venetum under different conditions
本研究结果显示,AvAKT1主要在罗布麻根中高丰度表达(图5);K+饥饿后,5.0 mmol·L-1K+显著诱导了罗布麻AvAKT1在根中的表达,0.1 mmol·L-1K+对其表达量几乎没有影响(图6A),表明AvAKT1主要在罗布麻根部发挥作用。已有文献报道[33-34], AKT1在维持植物离子稳态平衡及增强植物逆境胁迫耐受性等方面起着重要作用。在水稻中超表达OsAKT1后,转基因植株在干旱条件下生长良好,且根中积累较多的K+;相反,osakt1突变体植株表现为生长不良,且根中K+含量明显减少[35]。Golldack等[6]研究表明,盐处理下水稻根吸收Na+与OsAKT1的表达水平有直接关系。在水稻中超表达小花碱茅K+通道蛋白PutAKT1显著提高了水稻的耐盐性[36]。Duan等[37]研究发现,盐胁迫下盐地碱蓬(Suaedasalsa)SsAKT1的高丰度表达与植株体内K+的积累密切相关。最新研究结果表明[38],ZxAKT1对维持荒漠旱生植物霸王(Zygophyllumxanthoxylum)的K+吸收、K+/Na+稳态平衡至关重要。本试验中,25 mmol·L-1NaCl和-0.2 MPa渗透胁迫处理6 h时,AvAKT1的表达丰度显著上调(图6B),并且发现-0.2 MPa渗透胁迫下罗布麻叶中K+浓度显著上升、地上部K+/Na+显著提高,添加25 mmol·L-1NaCl后Na+对渗透势的贡献大幅增加,渗透胁迫对幼苗生长的危害得到缓解[27],据此推测AvAKT1可能在调控罗布麻体内K+和Na+选择性吸收、维持K+浓度稳定,进而增强其渗透调节能力中发挥重要作用。
4 结论
本研究通过RT-RCR和RACE技术从罗布麻根中分离得到内整流K+通道AvAKT1编码基因,并采用实时定量PCR的方法分析了其在低钾、盐及渗透胁迫条件下的表达丰度变化特征。结果表明,AvAKT1基因编码的氨基酸序列结构符合典型的Shaker-like内整流K+通道结构特征,与其他高等植物AKT1类K+通道蛋白的同源性在60%以上;罗布麻AvAKT1主要在根中表达,受到5.0 mmol·L-1K+、25 mmol·L-1NaCl及-0.2 MPa渗透胁迫的显著诱导。这可为研究逆境条件下,罗布麻维持K+稳态的分子机制研究奠定基础。
