受miRNA-205调控的重组柯萨奇病毒B3的构建及其复制
2019-08-30戴潇逸钟江
戴潇逸, 钟江
复旦大学生命科学学院微生物学与微生物工程系, 上海 200438
柯萨奇病毒B3 (coxsackievirus B3,CVB3) 属细小RNA病毒科(picornaviridae)肠病毒属(enterovirus),基因组为一条长7.4 kb的单股正链RNA。CVB3通常引发轻症感染,但作为病毒性心脏病的主要病原体[1-2],可引发病毒性心肌炎和扩张型心肌病,严重时甚至会导致病人猝死。开发低致病性的毒株对于制备减毒活疫苗有重要意义[3]。另外,有研究将CVB3用于肿瘤治疗。如何使该病毒具有肿瘤细胞靶向性,也是一项重要的课题[4]。
microRNAs (miRNAs)是一类非编码小RNA,种类众多,在调控真核生物发育、免疫、肿瘤形成等方面有重要作用。它通过结合靶序列引发目标mRNA的降解或抑制其翻译,从而在转录后水平上调控基因表达。利用miRNA特异性降解目标RNA的特点,在病毒基因组中加入特定miRNA的靶序列,就可以限制病毒在高水平表达该种miRNA的细胞中的复制。He等[5]利用miRNA靶序列限制CVB3对心肌细胞的趋向性,降低了野生型CVB3的致病力。
人类miRNA hsa-miRNA-205(包括miR-205-3p和miR-205-5p,简称为miR-205)参与上皮细胞分化、迁移和凋亡[6-8]。有研究表明miR-205在人宫颈癌细胞系HeLa细胞中低表达[9-10],而在人非小细胞肺癌细胞系A549 细胞中高表达[11-12]。本实验构建了在CVB3基因组编码区含有多拷贝miR-205靶序列的重组病毒v205T。实验显示重组病毒在HeLa和A549细胞系中的复制呈现明显差异,一系列小RNA转染细胞实验的结果表明病毒复制的差异由miR-205引起,证实了使用miR-205靶点改造CVB3的可行性。
1 材料和方法
1.1 细胞和培养基
HeLa、A549细胞均采用含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM高糖培养液培养,培养条件为37 ℃、5% CO2。
1.2 CVB3感染性克隆质粒的构建
野生型CVB3 感染性克隆质粒pCVB3-WT由实验室前期构建(图1A,未发表),该质粒以pcDNA3.1(+)为骨架,在CMV启动子后带有CVB3全长基因组,并以一段多聚腺苷序列(30 nt)结尾。在其下游加上了一段丁型肝炎病毒(HDV)的核酶序列[13]和牛生长因子转录终止信号(BGH polyA signal)。HDV核酶序列可以切去转录产生的RNA 3端的多余序列,保证与天然病毒基因组一致。在pCVB3-wt中,病毒衣壳蛋白编码区与2A蛋白酶编码区之间插入miR-205靶序列。该靶序列由hsa-miR-205-3p互补序列(5′-GAAC-TTCACTCCACTGAAATC-3′)和hsa-miR-205-5p的互补序列(5′-CAGACTCCGGTGGAATG-AAGGA-3′)各3个拷贝串联构成,每个拷贝之间以5nt随机核苷酸分隔。在保留原有病毒蛋白酶2A切割位点(TMTNTGAFGQQSGA)的同时,加入另一个同样的位点,使插入序列上下游各有一个切割位点(图1B)。插入序列由上海捷瑞生物公司合成,通过限制性内切酶插入目标位点,得到质粒pCVB3-205T。经DNA测序验证显示正确。

A: Wild type CVB3 infectious clone. B:CVB3 infectious clone with miR-205 targets. PCMV: CMV promoter;5′ UTR, 3′ UTR: 5′ and 3′ untranslated region; A30: A string of poly-polyadenylic acid of 30nt; BGH polyA signal: Bovine growth hormone polyA signal; HDV ribozyme: Hepatitis D virus ribozyme.
图1 CVB3 感染性克隆和插入miR-205靶位点克隆的结构示意图
Fig.1 Diagram of CVB3 infectious clone and the clone with miR-205 targets
1.3 重组病毒的拯救和传代
以pCVB3-WT和pCVB3-205T质粒转染HeLa细胞,转染试剂为DNA Transfectin 3 000(HEROGEN),按产品说明书进行操作。24 h后更换培养基。继续培养48 h后观测到大部分HeLa细胞发生裂解或出现细胞病变现象,此时收获细胞培养物并冻融3次,5 000 g离心5 min后保留上清液,得到拯救病毒vWT和v205T。病毒在HeLa细胞中扩增后用于实验。
1.4 病毒滴度及生长曲线的测定
待测病毒液10倍系列稀释后,分别接种到长有60%汇合度的HeLa细胞的96孔板上。培养3天后显微镜下观察实验细胞的病理变化,使用Reed-Muench法计算病毒滴度(TCID50/mL)。在12孔板上接种汇合度为60%的HeLa细胞或A549细胞,以MOI=1(pfu/cell)接入v205T和vWT,孵育60 min后去除病毒液,以PBS清洗3次,随后加入新鲜培养液继续培养。分时段收获感染细胞和培养液,反复冻融、离心后测定病毒液滴度。
1.5 miRNA类似物和抑制物
miRNA类似物和抑制物(序列见表1)由上海吉玛生物技术公司合成,用HiPerFect 转染试剂(QIAGEN)转染HeLa细胞或A549细胞,具体步骤参照产品说明书。RNA终浓度均为200 nmol。用两种RNA转染时每种的浓度均为100 nmol。转染后5 h后用病毒感染细胞(MOI=2~3),培养1h后更换200 μL培养基并继续培养24 h(HeLa细胞)或48 h(A549细胞)。结束后吸取细胞培养液并测定病毒滴度。
表1 实验中用到的 miRNA类似物及抑制物序列
Tab.1 miRNA mimics and inhibitors used in the study

NameSense(+/-)Sequences(5′-3′)hsa-miRNA-205-5pmimic+UCCUUCAUUCCACCGGAGUCUG-GACUCCGGUGGAAUGAAGGAUUhsa-miRNA-205-3pmimic+GAUUUCAGUGGAGUGAAGUUC-ACUUCACUCCACUGAAAUCUUNonspecificmiRNAmimic+UUCUCCGAACGUGUCACGUTT-ACGUGACACGUUCGGAGAATThsa-miRNA-205-3pinhibitor+GAACUUCACUCCACUGAAAUChsa-miRNA-205-5pinhibitor+CAGACUCCGGUGGAAAUGAAGGANon-specificmiRNAinhibitor+CAGUACUUUUGUGUAGUACAA
1.6 细胞活性分析
在96孔细胞培养板中进行病毒感染,感染一定时间后吸去培养基,每孔加入100 μL新鲜的DMEM培养基和10 μL的CCK-8试剂(上海翊圣生物科技有限公司),45 min后加入1% 十二烷基磺酸钠溶液终止反应,使用微孔板分光光度仪(BioTek Epoch)读取OD450值,计算相对细胞活性。
1.7 数据统计分析
所有实验组均经独立重复实验验证。每组实验测定3个样本以上数据,各图显示测定结果的平均值和标准差,并进行t检验,分析差异显著性。
2 结果
2.1 CVB3感染性克隆的构建和重组病毒的获得
在野生型CVB3感染性克隆质粒(pCVB3-WT)中插入miR-205 目标序列,构建质粒pCVB3-205T,即在病毒VP1和2Apro编码区之间插入miR-205-5p及miR-205-3p的靶序列各3个拷贝,并将该位置原有的2A蛋白酶切割位点改为2个拷贝,分别位于插入序列的上下游,同时保证原开放读码框架(open reading frame,ORF)不变,确保获得的重组病毒能正确表达并产生病毒蛋白(图1)。
以质粒pCVB3-WT和pCVB3-205T转染Hela细胞,36h后陆续出现细胞病变;转染72h后,几乎所有的细胞都从细胞板上脱离,部分细胞裂解。将细胞冻融3次,得到病毒悬液vWT和v205T。
2.2 病毒在HeLa 和A549细胞中的复制
分别用vWT和v205T感染HeLa和A549细胞,定时测定病毒滴度,如图2。结果显示,2株病毒在HeLa细胞中的滴度增长动态接近,但在A549细胞中差异明显, vWT在各个阶段的滴度均显著高于v205T,差别最大时超过 1 000 倍,48 h时差距有所缩小,但仍约为80倍左右(P<0.01)。感染48 h后,vWT感染的A549细胞多数发生了细胞病变,而v205T感染的A549细胞仍有相当部分形态基本保持正常。光学显微镜下观察结果与滴度测定结果一致。可见miR-205靶序列的插入使病毒在A549 细胞中的复制水平下降(图3)。
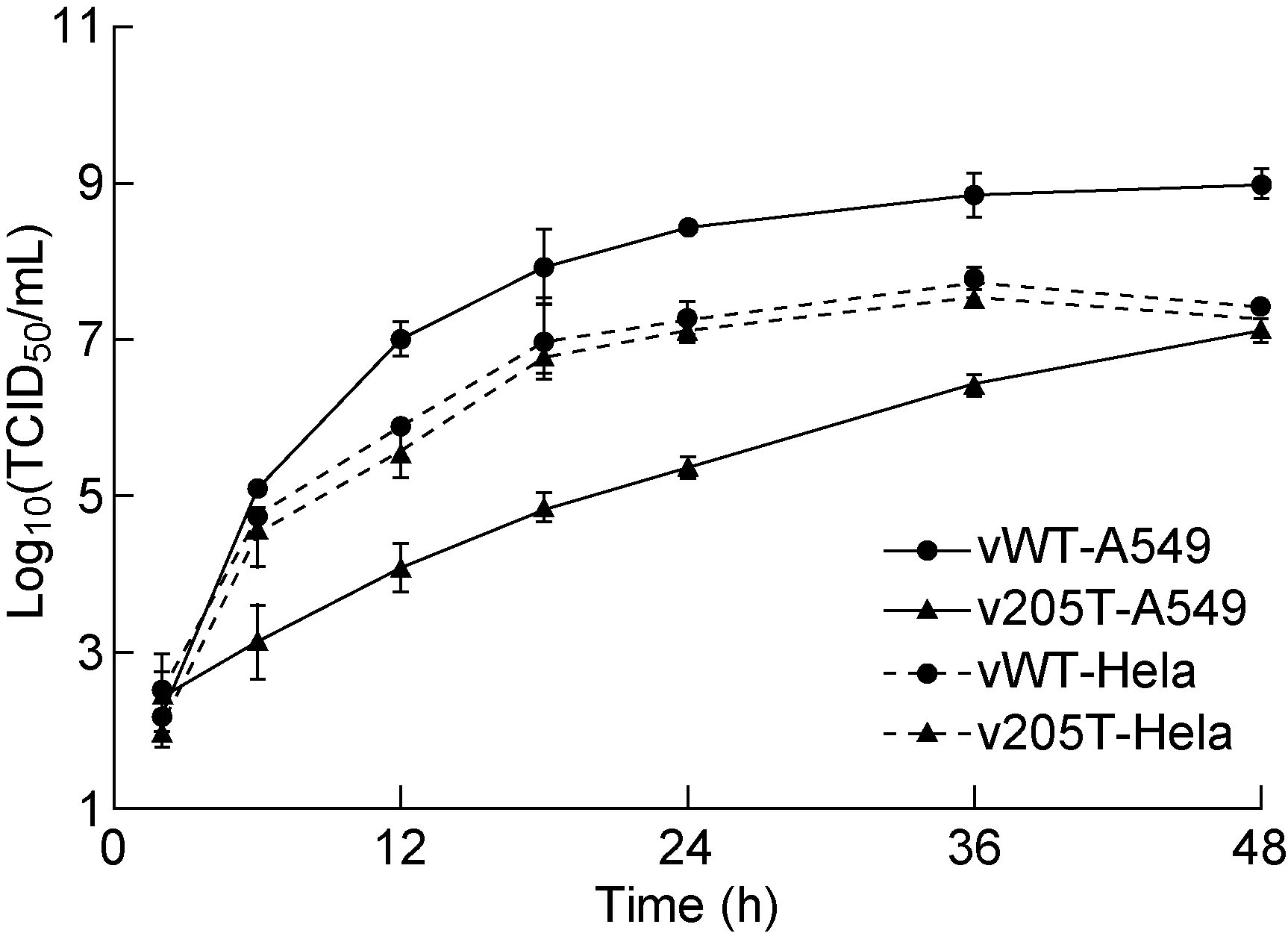
The averages of three replica were shown, and the error bars represented the standard errors.
图2 vWT和v205T在Hela细胞和A549 细胞中的复制曲线
Fig.2 Growth curve of vWT和v205T in HeLa and A549 cells

HeLa: 48 h post infection; A549: 72 h post infection; Scale bars: 50 μm.
图3 病毒感染HeLa和A549 细胞的光学显微镜观察
Fig.3 Light microscopy of virus-infected HeLa and A549 cells
2.3 miR-205类似物显著降低v205T在HeLa细胞中的复制
v205T在A549 细胞中的复制水平较在HeLa细胞显著降低,这与miR-205在HeLa细胞中低表达而在A549 细胞中高表达[8-11]的报道相一致。为证明病毒复制水平确与细胞中miR-205表达水平有关,进一步在HeLa细胞中转入miR-205的类似物,分析病毒复制和细胞病理效应(图4A)。
细胞活力检测表明,HeLa细胞转染200 nmol miR-205-3p或miR-205-5p类似物后,并没有影响vWT感染造成的细胞死亡,但却大大降低了感染v205T造成的细胞死亡,使细胞相对活性从0.03±0.01上升到0.26±0.04(miR-205-3p)和0.46±0.02(miR-205-5p)(图4A),病毒产量也随之下降,尤其是当miR-205-3p 和 miR-205-5p联合使用时,滴度约降低到原来的1‰(图4B)。这一结果证实miR-205的表达显著降低v205T在HeLa细胞中的复制。
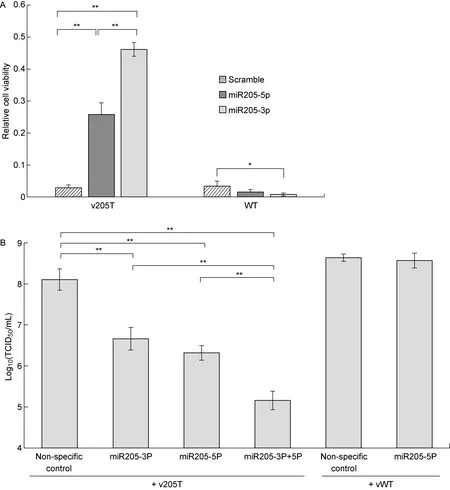
Cell viability (A) and virus titre (B) were determined 24 h post infection. The average of three replica were shown, and the error bars represented the standard errors. *:P<0.05; **:P<0.01.
图4 转染miR-205类似物对病毒感染HeLa细胞的影响
Fig.4 The effect of miR-205 mimics on the virus infection in HeLa cells
2.4 miR-205抑制物显著增强v205T在A549细胞的复制
在已知miR-205表达水平偏高的A549细胞中转染miR-205(miR-205-3p和miR-205-5p)抑制剂(浓度均各为100 nmol),细胞相对活性从对照的0.38±0.01降低到0.19±0.01 (图5A),病毒效价也上升了10倍以上(图5B),证明了miR-205抑制物可以提高v205T对细胞的杀伤作用。但是,miR-205(miR-205-3p和miR-205-5p)抑制物对vWT在A549中的复制没有明显影响。分别用miR-205-3p抑制物和miR-205-5p抑制物进行实验,同样观察到v205T对A549细胞杀伤作用的提高,包括细胞的活性下降(miR-205-3p:0.31±0.02;miR-205-5p:0.36±0.02),使病毒滴度提高(miR-205-3p:6.6倍;miR-205-5p: 3.0倍),但效果略低于两种抑制物联用(结果未在图中显示)。
3 讨论
运用miRNA的靶序列改建重组病毒的技术可在维持病毒基本增殖能力和基因组稳定的同时,实现在特定细胞中对病毒毒性和增值效率的有效调控,实现靶向性感染。该技术在弱毒株疫苗设计,肿瘤治疗等领域有潜在的应用前景[14-16]。如,有研究利用miR-let-7b靶序列构建了减毒H1N1流感病毒,该病毒在鸡胚中具有正常的复制能力,但对小鼠的毒性明显降低,在小鼠免疫实验中取得了良好的保护效果[17-18]。也有研究在腺病毒中加入了在胶质瘤细胞中低表达的4个miRNA(miR-124、miR-128、miR-146b和miR-218)的靶序列,得到的腺病毒对胶质瘤细胞的特异性有明显提高[19]。由于miRNA 靶位点短小,该技术对于CVB3这类基因组容量较小的病毒尤为适合。随着对miRNA表达数据的积累,丰富、可用的miRNA靶点将有助于这一技术的完善和实际运用。

The average of three replica were shown, and the error bars represented the standard errors. **:P<0.01
图5 转染miR-205抑制物对病毒感染A549细胞的影响
Fig.5 The effect of miR-205 inhibitor on the virus infection in 549 cells. Cell viability (A) and virus titre (B) were determined 48h post infection
本研究显示,带有miR-205目标序列的v205T在A549细胞(miR-205高水平表达)的复制效率显著低于野生型病毒,而在的HeLa细胞(miR-205低水平表达)中复制效率与野生型病毒一致。转染miR-205类似物可以抑制v205T在HeLa细胞中复制,转染miR-205抑制物则可以提高v205T在A549细胞中的复制,而无论类似物还是抑制物对野生型病毒的复制均无显著影响。这些结果证明miR-205确实造成了病毒在2个细胞系中复制的差异。
细小RNA病毒基因组较小,编码一个完整的ORF,因此在进行重组改造时维持基因组正常功能非常重要。He等在CVB3基因组的5′和3′非翻译区(untranslated regions,UTR)间选择了4个位点,进行插入随机序列或miR-133和miR-206靶序列的尝试,发现改造后的CVB3载体均不能产生有侵染力的子代病毒,因此选择将miRNA靶序列放在ORF的起始密码子之后[5]。本研究将miR-205的靶位点设置在CVB3的P1与P2编码区之间,并使用2A蛋白酶切位点隔离插入序列和病毒基因。结果显示v205T在HeLa细胞中与原型病毒具有相似的活性,基因组在传代5次后仍能维持稳定,表明这一构建策略不会影响病毒的正常复制。此外,我们还尝试了在病毒衣壳蛋白基因VP3和VP1之间插入两侧带有3C蛋白酶(3Cpro)切割位点的Flag Tag序列,发现同样能产生具有感染力的重组CVB3病毒,且其活力与野生型病毒相似(数据未显示)。细小RNA病毒科的病毒在复制时首先产生一个大的蛋白,经过2Apro、3Cpro等蛋白酶切割后变为成熟蛋白。本研究的结果表明,在编码区蛋白酶切割位置插入外源序列并同时添加蛋白酶切割位点,不会影响子代病毒的产生。
本研究证实,插入miRNA靶序列可有效地影响病毒的复制,但这究竟是因为造成了病毒RNA的降解或是影响了病毒蛋白质的合成,确切机制还需要进一步研究。另外,带有miRNA靶位点的病毒遗传稳定性也值得研究。为了避免细胞miR-205对v205T的选择压力导致该位点变异的积累,应选择miRNA表达水平较低的细胞,甚至可选用敲除miR-205基因的细胞系用于该病毒的生产制备。
控制病毒毒性和细胞趋向性是制备溶瘤病毒和新型减毒活疫苗的重要因素。本实验为使用miRNA靶位点改造CVB3积累了数据,也可为CVB3病毒减毒活疫苗的制备或基于CVB3载体的溶瘤病毒的研发提供经验。进一步的实验,可根据特定的需要,在病毒的基因组中插入多个miRNA靶序列,更有效地调控病毒复制水平和组织细胞靶向性。
