敏化氮化碳的制备及其光催化性能
2019-08-29李云锋尚嘉钰
王 帅,常 薇,李云锋,尚嘉钰
(西安工程大学 环境与化学工程学院,陕西 西安 710048)
0 引 言
近年来,利用光催化材料降解有机污染物,已成为解决环境问题的一个重要方法[1-4]。g-C3N4是一种较好的光催化剂[5-7],作为一种新型的非金属光催化剂、类似石墨的材料,其主要由碳氮构成[8-10],具有化学稳定性高、耐酸碱、改变性质比较方便、地壳含量丰富以及具有中等能带隙能的电子结构等优点[11-14]。然而,由于比表面积小、光吸收范围窄、光生电子空穴对的高复合率和低电导率,g-C3N4的光催化性能仍然受到限制[15-18]。如何减小催化剂的禁带宽度,使吸收光谱尽可能多地向可见光扩展是提高光能利用率的关键[16-19]。本文根据三聚氰胺诱导热聚合法制备g-C3N4,然后对材料进行敏化,以达到提高光催化性能的目的。
1 实 验
1.1 试剂与仪器
(1) 试剂 三聚氰胺(分析纯,天津市科密欧化学试剂有限公司);甲基橙(MO,分析纯,西安化学试剂厂);亚甲基蓝(MB,分析纯,天津市天新精细化工开发中心);无水乙醇(分析纯,利安隆博华医药化学有限公司)。
(2) 仪器 光催化反应仪(BL-GHX-V,西安比朗生物科技有限公司);红外光谱仪(Frontier,铂金埃尔默仪器有限公司);X射线衍射分析仪(Dmax-Rapid Ⅱ,日本理学(Rigaku)株式会社);紫外可见分光光度计(UV-2450,日本岛津);扫描电子显微镜(JSM-6700F,日本电子公司)。
1.2 材料的制备
称取10 g三聚氰胺加入40 mL的坩锅中,坩锅加盖呈半封闭模式,放入马弗炉中以15 ℃·min-1的升温速率至550 ℃,保持4 h完成缩合。自然冷却至室温,研磨成粉末,得到淡黄色产物g-C3N4。
称取0.50 g氮化碳(g-C3N4)和0.10 g甲基橙(MO), 加入50 mL无水乙醇(CH3CH2OH),搅拌并超声波处理15 min。然后磁力搅拌20 h离心处理并弃去上层清液。将离心管底部固体用无水乙醇洗涤多次至洗涤液无色,所得固体在空气中晾干,再在50 ℃的烘箱中保持3 h。研磨得到黄色产物记为MO-g-C3N4。
1.3 光催化性能的测定
取3份浓度为2.7×10-5mol/L的MB溶液20 mL,向其中2份分别加入12 mg的g-C3N4与MO-g-C3N4光催化剂,另一份作为空白对照。将其放入光催化反应仪中,暗室搅拌1 h, 使其达到吸附脱附平衡。在500 W汞灯照射下进行光催化降解实验,反应时间为60 min,每隔15 min,离心取上清液,用紫外分光光度计在该染料的最大吸收波长(664 nm)处测其吸光度A。
2 结果与讨论
2.1 XRD分析
图1为g-C3N4和MO-g-C3N4的XRD图。从图1可以看出,在2个样品的谱图中,均出现了2个衍射峰,且2个样品的(100)晶面和(002)晶面所对应的位置基本一致。最强峰均出现在2θ约为27.40°处,归属于g-C3N4的(002)晶面,在13.30°处的峰对应于g-C3N4的(100)晶面,与文献[1-13]的结果一致。由此可确定该样品为g-C3N4。MO-g-C3N4的XRD图与g-C3N4的基本一致,说明MO敏化并没有改变g-C3N4的晶相结构。

图 1 样品的XRD图Fig.1 XRD pattern of the samples
2. 2 SEM分析
图2为g-C3N4样品SEM图。可以看出,所制备的样品材料有团聚现象,呈二维片状结构,为典型的石墨相氮化碳结构。图3为复合物MO-g-C3N4样品SEM图。可以看出,样品形貌与图2相似,敏化没有改变g-C3N4的形貌。

图 2 g-C3N4样品SEM图Fig.2 SEM images of g-C3N4
2. 3 BET分析
图4(a)、图5(a)分别为样品g-C3N4和MO-g-C3N4的N2吸附-脱附曲线。可以看出,样品g-C3N4和MO-g-C3N4都具有典型的IV型等温线和H3型回滞环,表明两样品都存在一定的介孔,属于介孔材料。 g-C3N4比表面积为96.86 m2/g,孔容为1.940 cm3/g;MO-g-C3N4比表面积为98.73 m2/g,孔容为1.815 cm3/g,与g-C3N4基本相同。

图 3 MO-g-C3N4样品SEM图Fig.3 SEM images of MO-g-C3N4
图4(b)、图5(b)分别为g-C3N4和MO-g-C3N4的孔径分布曲线。可以看出,g-C3N4和MO-g-C3N4孔径分布范围都较宽,g-C3N4主要孔径分布在80 nm,MO-g-C3N4主要孔径分布在60 nm左右,与g-C3N4基本相同。进一步说明二者都为介孔材料。

(a) N2吸附-脱附图

(b) 孔径分布图 4 g-C3N4样品N2-吸附脱附图和孔径分布图
2.4 红外光谱分析
图6为g-C3N4与复合MO-g-C3N4的红外光谱图,六元杂环C3N4的伸缩振动引起区域1 218~1 635 cm-1内有若干个显著的吸收峰,在801 cm-1处也是由于振动引起,而左边宽大的吸收峰主要是样品表面的—OH及N—H键的振动。同样,可明显观察到复合MO-g-C3N4与g-C3N4具有相同的骨架,微小的差别主要来自于染料的耦合。
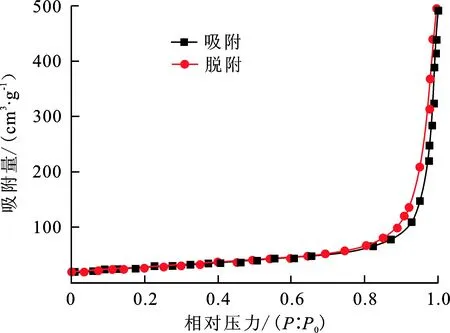
(a) N2吸附-脱附图
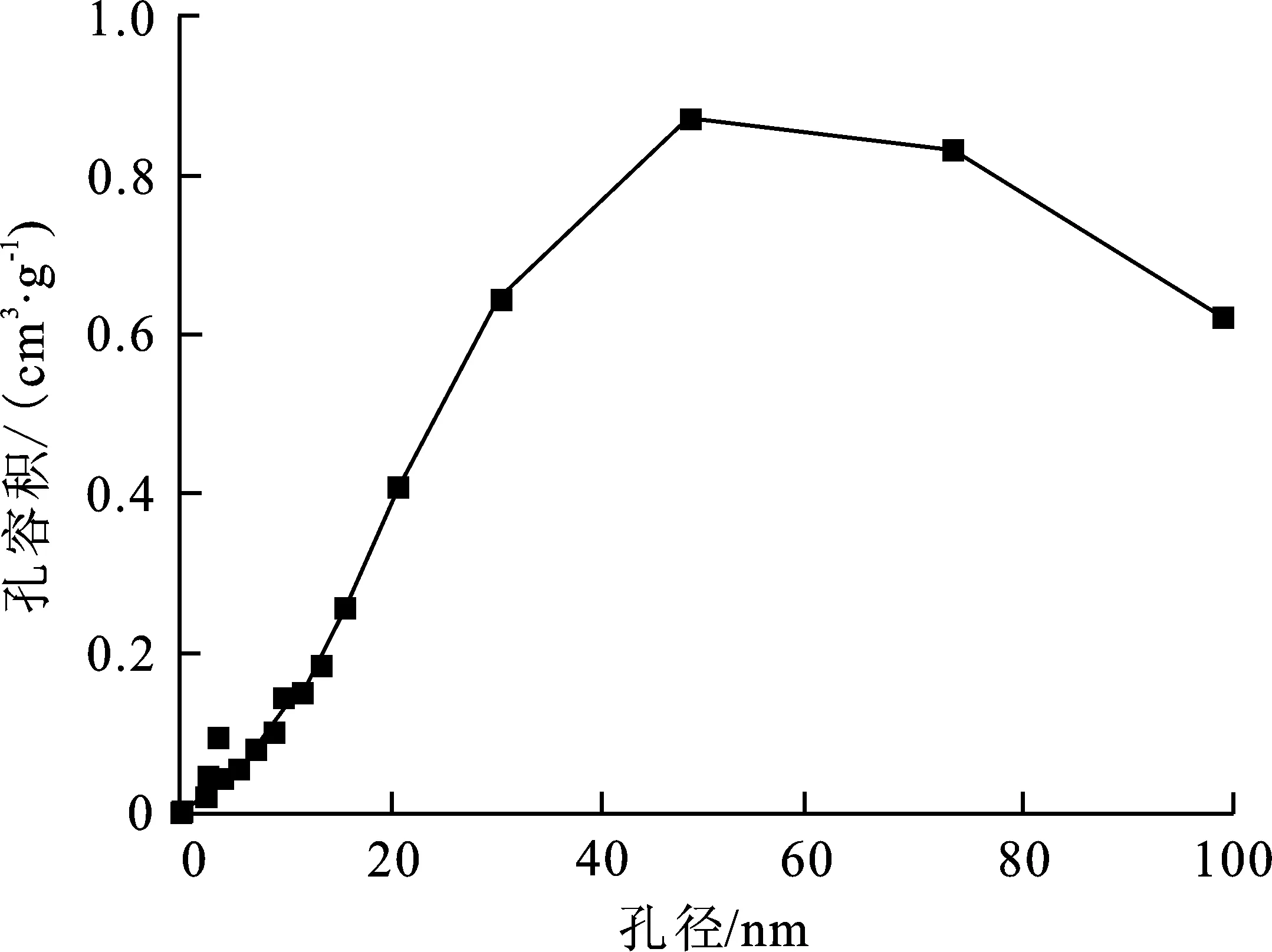
(b) 孔径分布图 5 复合物MO-g-C3N4样品N2-吸附脱附图和孔径分布图
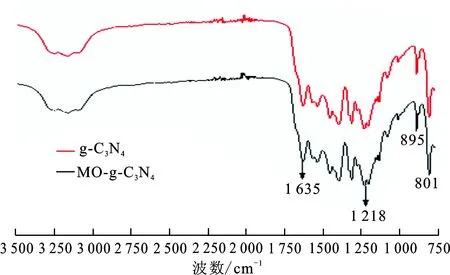
图 6 样品的红外光谱图Fig.6 IR spectra of the samples
2.5 UV-vis分析
图7为 g-C3N4与复合物 MO-g-C3N4的紫外-可见漫反射光谱图。 可以看出, MO-g-C3N4与g-C3N4相比,其 UV-vis 漫反射光谱图有明显红移现象, 在波长430 nm~600 nm 范围内 MO-g-C3N4对光的吸收明显强于 g-C3N4。 有利于光催化剂在光照下产生更多的光生电子-空穴对, 增强光催化活性。
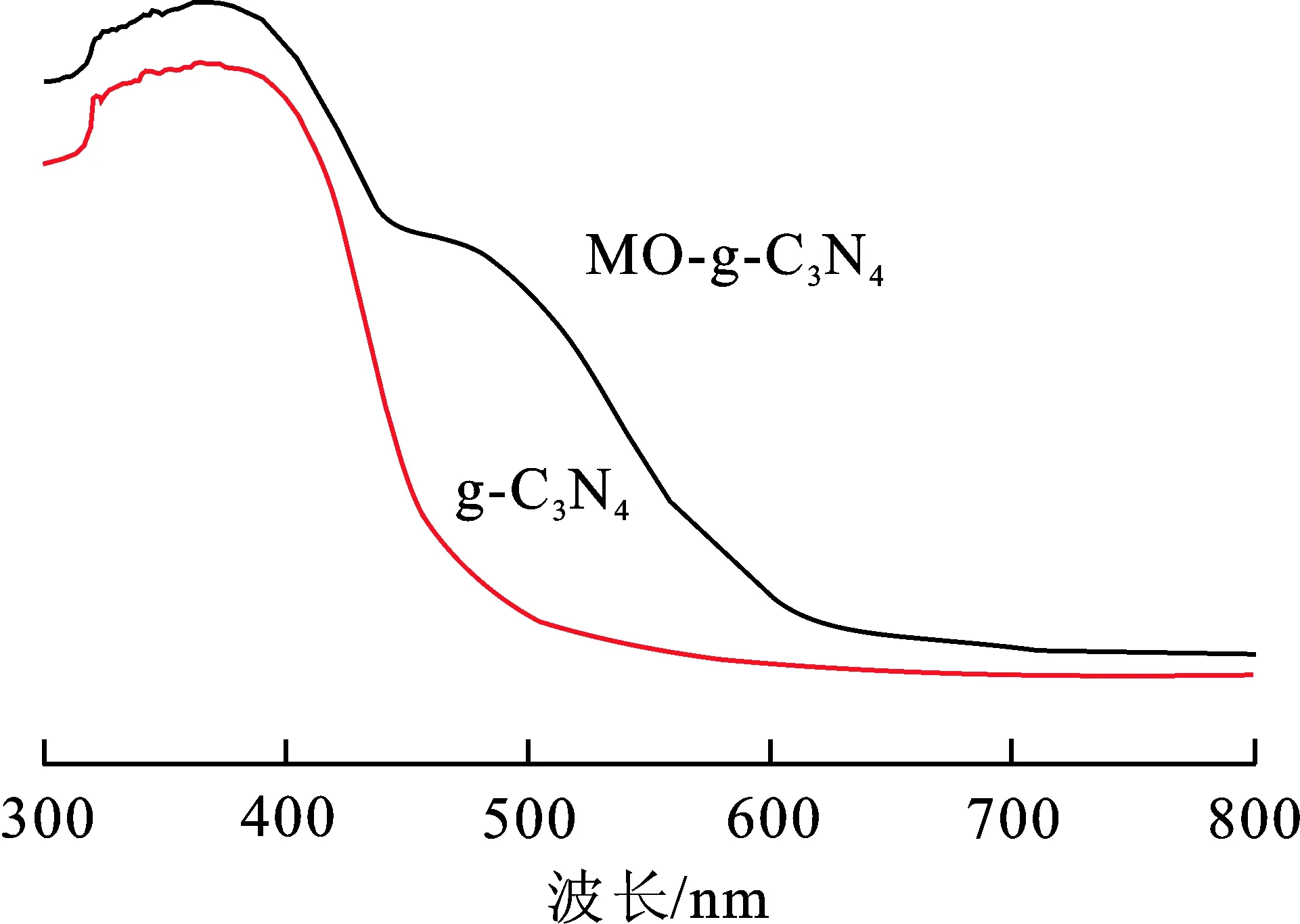
图 7 样品的紫外-可见漫反射光谱图
2.6 光催化性能分析
图8为催化剂g-C3N4和复合催化剂MO-g-C3N4在汞灯500 W照射下对MB的降解图。可看出,在同样的反应条件下,对照组MB的浓度变化很小,比较稳定。而加入催化剂对MB的吸附和降解速率有显著提升,且复合催化剂MO-g-C3N4的吸附和降解效率比单一催化剂g-C3N4更好。其中可能的机理为:MO有较好的吸光能力,敏化后在光照条件下,染料MO会激发产生光生电子。该光生电子可以快速地转移到g-C3N4导带上,增加了g-C3N4导带上的电子浓度,加快了化学反应速率,在一定程度上提高了g-C3N4的光吸收和利用率。所以染料敏化后的g-C3N4表现出更高的光催化活性。
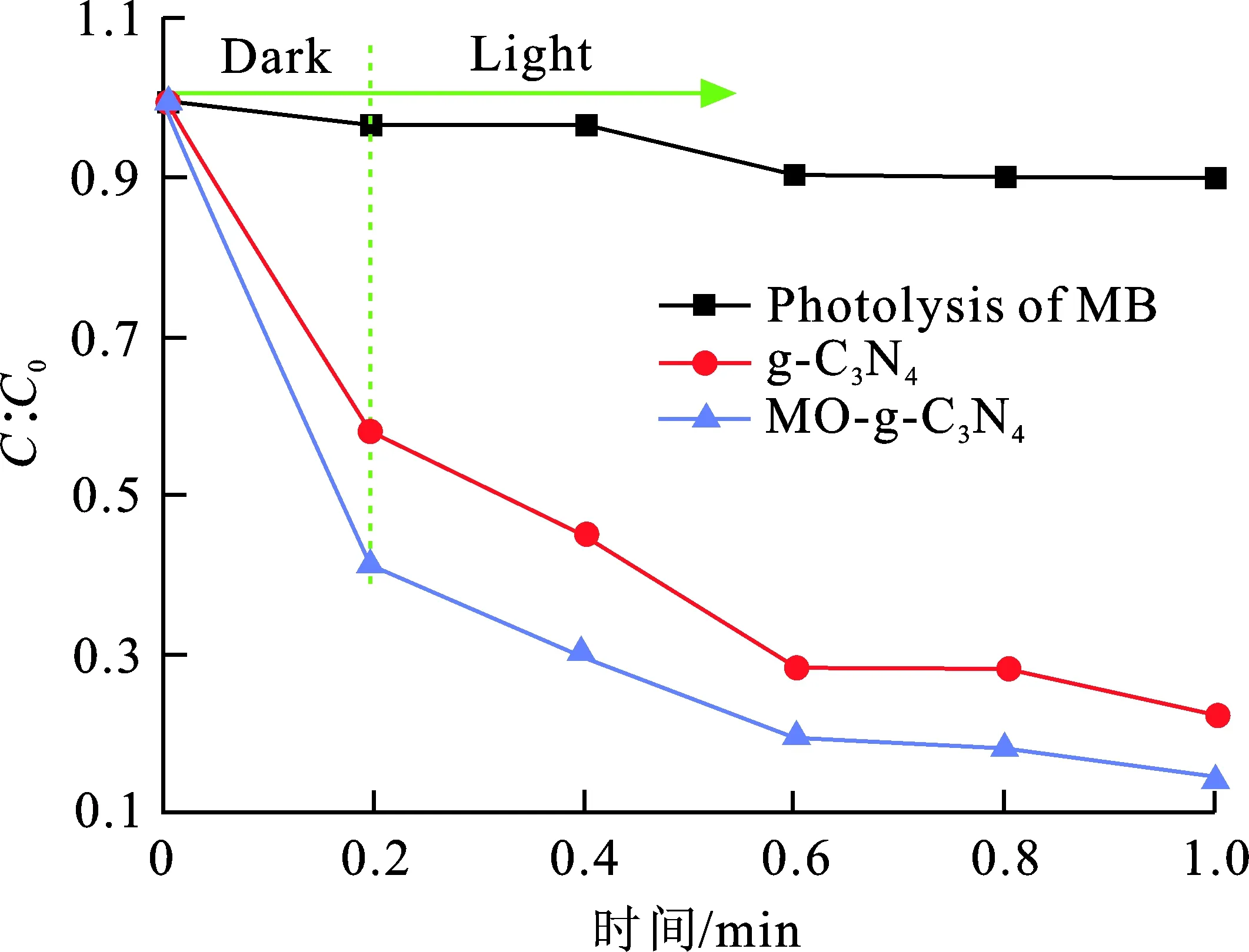
图 8 样品对MB的降解图
3 结 论
以三聚氰胺为原料采用诱导热聚合法制备g-C3N4,并用MO将其敏化,得到复合催化剂MO-g-C3N4。根据光催化实验,所制备的复合催化剂MO-g-C3N4比单一催化剂g-C3N4对MB的光催化降解效率更好,表明染料敏化g-C3N4有助于提高其光催化性能。
