基于碳纳米管组装电化学传感器测定金丝桃苷的含量
2019-08-28李小蓉刘江涛刘靖丽李佳佳张永枚
李小蓉,郭 惠,龙 旭,刘江涛,刘靖丽,李佳佳,张永枚
(陕西中医药大学药学院,陕西西安 712046)
金丝桃苷(Hyperoside),又名槲皮素-3-O-β-D-吡喃半乳糖苷,是一种黄酮醇苷类化合物,是金丝桃属药用植物的一种主要有效成分。近年来,大量文献报道其具有多种药理学活性,如抗急性肝损伤[1]、抗炎[2]、抗抑郁、抗血栓、抗氧化应激、抗菌、抗癌等。因此,对药用植物或药品中金丝桃苷的含量检测具有非常重要的意义。
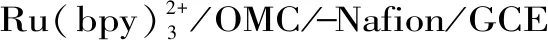
基于单壁碳纳米管(SWCNTs)具有良好的催化活性、导电性和较大的比表面积等特性,本文采用SWCNTs修饰玻碳电极(GCE),构建电化学传感器,对中药有效成分金丝桃苷的含量进行检测,建立一种简单、高灵敏的金丝桃苷的电化学检测方法,并用于实际样品疏肝解郁胶囊中金丝桃苷的测定,以期为中药有效成分检测提供新技术支持。
1 材料与方法
1.1 材料与仪器
金丝桃苷对照品(纯度≥98%) 上海源叶生物科技有限公司;N,N-二甲基甲酰胺 分析纯,天津恒兴化学试剂制造有限公司;SWCNTs 深圳市纳米港有限公司;铁氰化钾、氯化钾 分析纯,上海化学试剂有限公司;甲醇 分析纯,天津市天力化学试剂有限公司;疏肝解郁胶囊 成都康弘药业集团股份有限公司;实验用水 均为二次蒸馏水;其余试剂均为国产分析纯。
CHI660E电化学工作站 上海辰华仪器有限公司;SG8200H超声波清洗机 上海冠特超声仪器有限公司;pHS-3C型精密pH计 上海日岛科学仪器有限公司。
1.2 实验方法
1.2.1 修饰电极的制备
1.2.1.1 SWCNTs的羧基化 精密称取2 g SWCNTs置于50 mL的小烧杯中,加入一定量36%的HCl,超声6 h(40 kHz)后,用去离子水洗涤,直至洗出液的pH大于6.0为止。然后加入2 mol/L的HNO3溶液,静置1 h后,在温度为90 ℃的恒温水浴锅中放置10 h,接着超声1 h(40 kHz),最后用去离子水冲洗SWCNTs至洗出液的pH为中性。在减压真空干燥箱中于60 ℃干燥20 h,即得羧基化的SWCNTs[15]。
1.2.1.2 GCE的处理 将GCE(直径3 mm)在麂皮上用0.5 μm的Al2O3抛光至镜面,然后用二次蒸馏水清洗干净,晾干。然后将其置于1.0×10-4mol/L K3[Fe(CN)6](含0.1 mol/L KCl)溶液中,扫描循环伏安(CV)图。重复上述操作,直至得到对称且可逆的氧化还原峰,峰电位差小于80 mV,取出电极备用。
1.2.1.3 SWCNTs/GCE修饰电极的制备 称取羧基化的SWCNTs 2.0 mg,加入1 mL的N,N-二甲基甲酰胺,超声3 h(40 kHz),得到均匀的分散液,精密移取一定体积的分散液,滴在处理好的GCE表面,空气中自然晾干。
1.2.2 修饰电极的电化学表征
1.2.2.1 不同电极面积的计算 在1.0×10-4mol/L K3[Fe(CN)6](含0.1 mol/L KCl)溶液中,采用计时库仑法,得到裸GCE电极和SWCNTs/GCE电极的计时库伦曲线,根据计时库伦曲线的Q-t数值,绘制Q-t1/2曲线,得到不同电极的Q-t1/2曲线方程及线性相关系数。依据不同电极Q-t1/2曲线的斜率和Anson 公式,可以计算出不同电极的面积。Anson公式的表达式为:
式中:n是电子转移数目,对K3[Fe(CN)6]溶液,n=1;F为法拉第电解常数,F=96485C/mol,A为电极的表面积,c是溶液的浓度,D是扩散系数,在1.0×10-4mol/LK3[Fe(CN)6](含0.1 mol/L KCl)溶液中,D=7.6×10-6cm2/s;Qdl为双电层的充电量,Qads为法拉第电荷。
1.2.2.2 修饰电极的电化学性质 以浓度1.0×10-5mol/L金丝桃苷为测定液,采用CV法对裸电极和修饰电极进行表征,并和裸电极相比较,以确定修饰电极的电化学性能。
1.2.3 金丝桃苷在修饰电极表面作用机制 为了研究金丝桃苷在传感器表面的反应机制,实验中考察了扫描速度对金丝桃苷的电化学行为的影响,研究扫描速度分别为0.02、0.05、0.10、0.15、0.20、0.25、0.30时,金丝桃苷在传感器上的峰电位和峰电流的数值,得到氧化峰电流及还原峰电流与扫描速度的关系,以确定其作用机制。
1.2.4 实验条件的优化 以0.1 mol L-1的磷酸缓冲溶液(PBS)为介质,1.0×10-5mol/L金丝桃苷溶液作为测定液,固定扫描电位为-0.2~0.8 V,扫描速度为0.10 V/s,SWNTs用量为10 μL,采用CV法考察金丝桃苷溶液的pH分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0时传感器的响应信号;固定pH为6.0,考察SWCNTs用量分别为5、7、10、12、15、18 μL时对电极的修饰效果;SWNTs用量为10 μL,pH为6.0,采用i-t曲线法考察初始电位值分别为0.20、0.25、0.30、0.34、0.40、0.45 V时传感器的响应值。
1.2.5 电化学测量 实验中采用三电极系统,以SWCNTs/GCE修饰电极或GCE为工作电极、铂片为对极,饱和甘汞电极(SCE)为参比电极。选择SWCNTs用量分别为10 μL,以+0.34 V(vs. SCE)为工作电位,在0.1 mol/L PBS(pH=6.0)中记录传感器的背景电流;然后将传感器浸入含浓度分别为3.0×10-9、7.0×10-9、1.0×10-8、3.0×10-8、7.0×10-8、1.0×10-7mol/L金丝桃苷溶液中记录传感器的响应电流。两次电流的差值即为传感器对金丝桃苷的响应电流。
1.2.6 样品的处理 称取0.35 g疏肝解郁胶囊,置于50 mL小烧杯中,加入10 mL甲醇,超声45 min,然后离心10 min,取上清液,过滤,重复上述提取过程3次,合并滤液,浓缩至10 mL。取所得液体10 μL,用缓冲溶液稀释至100 mL作为待测液。
1.3 数据处理
以上实验均平行3次,所得数据经CHI660E电化学工作站记录和导入后,采用Origin 8.0绘图。
2 结果与讨论
2.1 电极面积的测定结果
电极面积的大小直接影响到对传感器的响应信号及检测的灵敏度,实验中计算了裸电极和修饰电极的面积,结果如图1所示。根据图1可得,裸GCE的Q-t1/2曲线线性方程为:Q(10-4C)=0.0279 t1/2(s1/2)+0.0104(r=0.999);SWCNTs/GCE修饰电极Q-t1/2曲线线性方程为:Q(10-4C)=0.4075 t1/2(s1/2)+2.2375(r=0.996);根据Anson公式计算出两者的电极面积分别为0.10、1.36 cm2。表明和裸GCE相比较,SWCNTs/GCE电极的面积极大地增加,可以提高金丝桃苷检测的灵敏度。
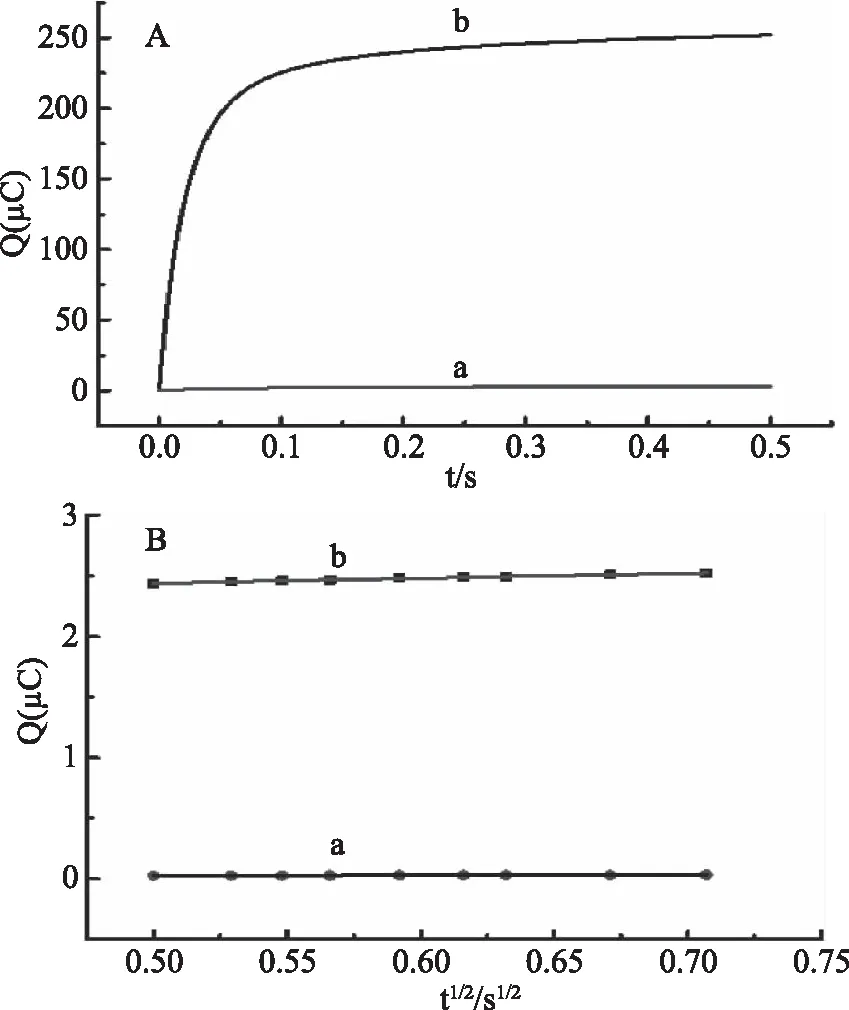
图1 1.0×10-4mol/L K3[Fe(CN)6](含0.1mol/L KCl)在GCE电极(a)、SWCNTs/GCE电极(b)上的计时库仑曲线(A)及Q-t1/2曲线(B)
2.2 金丝桃苷在不同电极上的电化学响应
本实验研究了不同电极的电化学活性,考察了不同电极在1.0×10-5mol/L金丝桃苷溶液中上的循环伏安行为,结果如图2所示。从图2中可以看出,在裸GCE电极上金丝桃苷出现了一对氧化还原峰,但峰电流较小。在SWCNTs/GCE电极上金丝桃苷的氧化峰电流和还原峰电流急剧增加,氧化峰电流大约是裸电极的56倍,还原峰电流约是裸电极的38倍。峰电流的增大表明,SWCNTs能够对金丝桃苷的电子转移起到促进作用,具有较高的电催化活性,这主要是由于SWCNTs具有优异的导电性和较大的比表面积的原因。
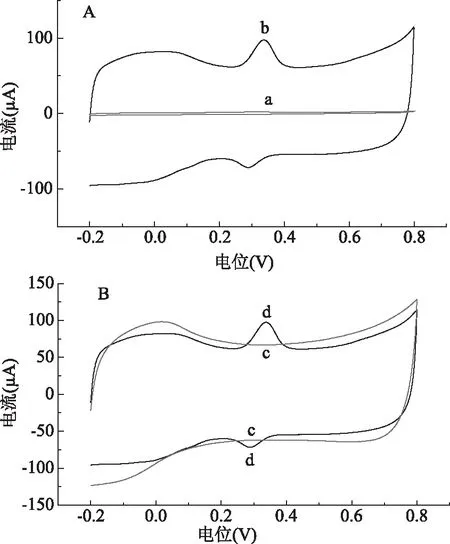
图2 1.0×10-5mol/L金丝桃苷在裸GCE(a)、SWCNTs/GCE电极(b)上的CV图(A);在SWCNTs/GCE电极上,加入1.0×10-5mol/L金丝桃苷前(c)和后(d)的CV图(B)
2.3 金丝桃苷在修饰电极表面作用机制
图3展示了不同扫描速度下金丝桃苷的CV曲线。由图3可以看出,随着扫描速度的增加,氧化峰电流和还原峰电流逐渐增加。氧化峰电流及还原峰电流在一定范围内与扫描速度的平方根成正比,其线性关系分别为:ipa=93.4v1/2-6.1624(r=0.9844)和ipc=209.46v1/2-30.023(r=0.992),表明金丝桃苷在电极上的反应是受扩散控制的过程。
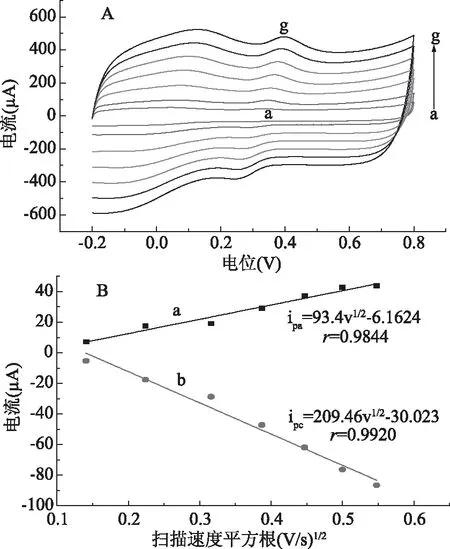
图3 1.0×10-5mol/L金丝桃苷在SWCNTs/GCE电极上不同扫描速度下的CV曲线(A)及氧化峰电流ipa-v1/2(a)和还原峰电流ipc-v1/2(b)的线性关系图(B)
2.4 实验条件的优化
2.4.1 溶液pH的选择 实验中发现,随着pH的变化,金丝桃苷在传感器表面的电化学行为也发生了变化,如图4所示,主要体现在随着溶液pH的增加,金丝桃苷的氧化峰电流先迅速增加,当pH达到6.0时,氧化峰电流达到最大值;继续增大pH,氧化峰电流又急剧降低。因此,综合考虑氧化峰电流和峰形的因素,本实验中选取pH为6.0的PBS缓冲液的作为最佳底液。而随着溶液pH的增加,氧化峰电位及还原峰电位均发生负移,说明电极反应过程有H+参与。
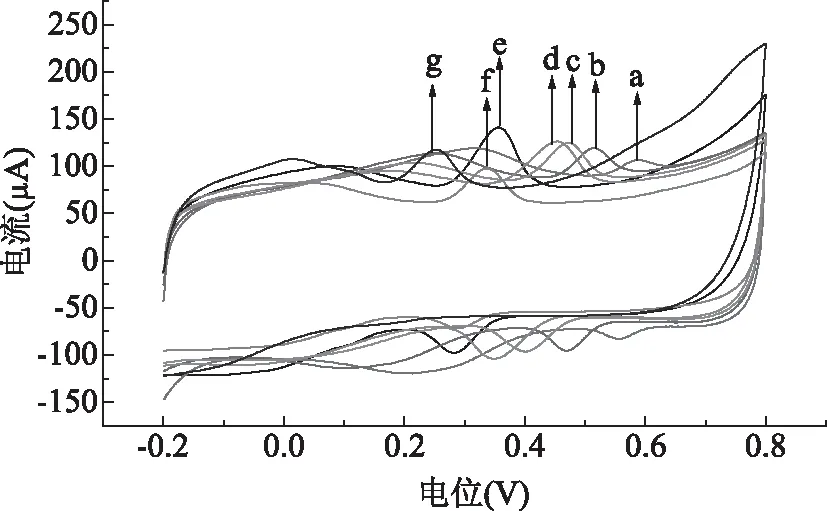
图4 1.0×10-5mol/L金丝桃苷在SWCNTs/GCE电极上不同pH时的CV叠加图
2.4.2 SWCNTs用量的选择 实验中考察了SWCNTs用量对修饰电极性能的影响。根据实验结果(图5)可知,氧化峰电流先随着SWCNTs用量的增加而增加,当SWCNTs用量为10 μL时,峰电流达到最大;随着SWCNTs用量的继续增加,氧化峰电流迅速降低,这主要是因为当SWCNTs用量过多时,修饰层的厚度就会增大,反而阻碍电子的传递。因此,实验选择SWCNTs的用量为10 μL。

图5 SWCNTs用量对金丝桃苷氧化峰电流的影响
2.4.3 电位的选择 采用i-t曲线法测量时,初始电位值对金丝桃苷的氧化电流会产生重要的影响。因此实验中在0.2~0.45 V的电位范围内,研究了电位对金丝桃苷的氧化电流的影响,结果见图6。当电位在0.2~0.34 V变化时,随着电位的增加,氧化电流也增加,在0.34 V达到最大。此后,随着电位的继续增加,氧化电流迅速降低。因此实验中选择金丝桃苷的测定电位为0.34 V。
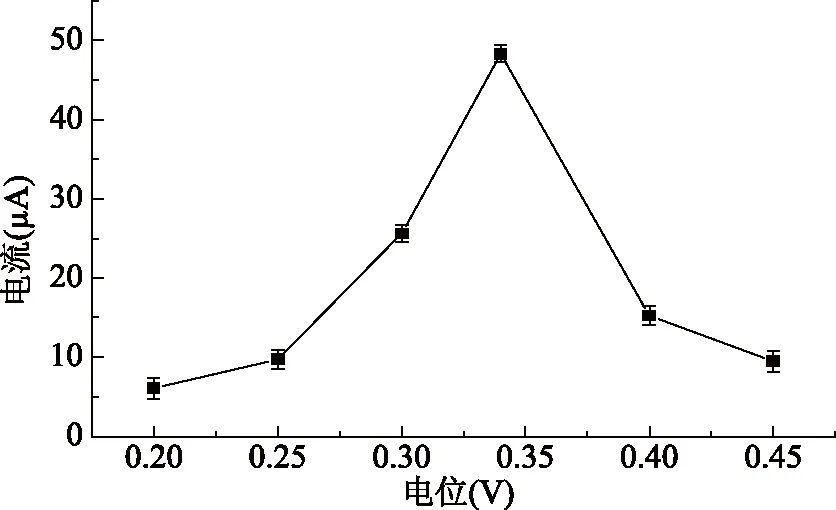
图6 电位对金丝桃苷氧化电流的影响
2.5 标准曲线和检出限
在优化实验条件下,考察了氧化电流随金丝桃苷浓度的变化情况,见图7。结果表明,随着金丝桃苷浓度的增加,氧化电流也随之增加,在3.0×10-9~1.0×10-7mol/L范围内,金丝桃苷浓度与氧化电流呈现良好的线性关系,线性回归方程为i=1.2262C+0.0105(r=0.9921),检出限(S/N=3)为2.41×10-9mol/L。与文献已报道的检测方法相比,具有较低的检出限[16]。
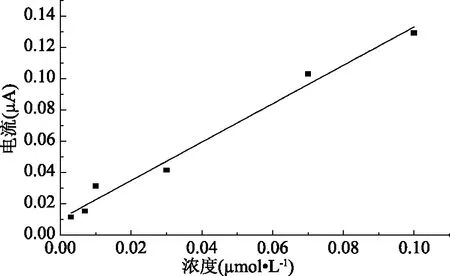
图7 金丝桃苷浓度与氧化电流的关系
2.6 重现性与稳定性
传感器的重现性和稳定性对测量结果具有重要的影响,因此在优化的实验条件下,研究了传感器的重现性和稳定性。每次使用后将该传感器放在pH=6.0的磷酸缓冲溶液中,采用CV法在电位区间-0.8~0.8 V范围内扫描10圈,使修饰电极表面重新活化。采用该修饰电极对1.0×10-8mol/L金丝桃苷进行6次重复测定,得到相对标准偏差为2.5%。用同样的方法分别制作3支修饰电极,对1.0×10-8mol/L金丝桃苷测定的相对标准偏差为1.2%,表明构筑的传感器重现性较好。通过分析该传感器在储存的过程中响应信号的变化情况来探索其稳定性,实验结果见表1。将在室温下放置15 d的电极,在同样条件测定金丝桃苷,氧化电流电流仍能达到最初的95.6%,表示该传感器具有良好的稳定性。
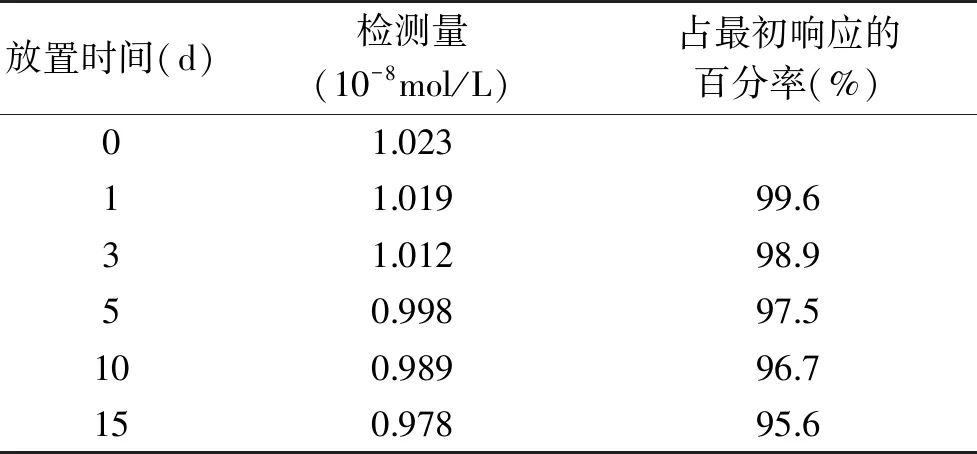
表1 不同时间传感器的响应Table 1 The response of the sensor at different time
2.7 干扰实验
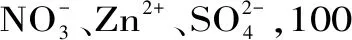
2.8 实际样品分析
利用制备的传感器对疏肝解郁胶囊中的金丝桃苷进行了加标回收检测,在相同条件下平行检测3次,取其平均值,以提高传感器检测的准确性,测定结果见表2。传感器对1.0×10-8mol/L金丝桃苷测定的回收率为103.0%~106.4%,标准偏差为1.2%~3.3%。结果表明,该传感器可用于实际样品中金丝桃苷的含量测定。
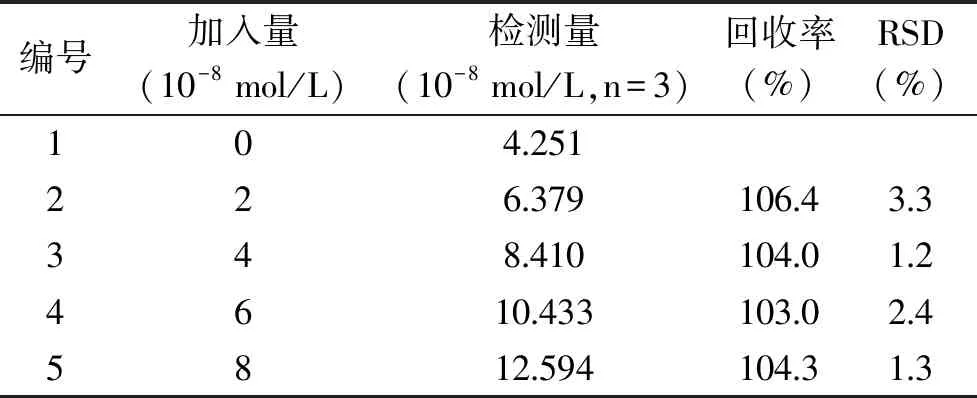
表2 疏肝解郁胶囊中金丝桃苷的检测 Table 2 Results of analysis of hyperoside in Shugan Jieyu capsule
3 结论
本文通过酸氧化法在SWCNTs表面引入功能基羧基,将其修饰在GCE表面,构建了一种电化学传感器用于金丝桃苷的检测。该传感器面积为1.36 cm2,面积较大,对金丝桃苷具有较好的电催化活性。对金丝桃苷检测的线性方程为:i=1.2262C+0.0105(r=0.9921),检出限为2.41×10-9mol/L。平均回收率为103.0%~106.4%,检测结果的RSD为1.2%~3.3%,低于5%。该传感器在金丝桃苷的检测中具有线性范围较宽、检测限较低、制作简单、成本较低等优点。本研究为金丝桃苷的检测提供了一种新的思路。
