响应面法优化苹果多酚微胶囊工艺
2019-08-28石静文马春丽梁佳祺邵伯悦亓艺洁
石静文,马春丽,梁佳祺,邵伯悦,亓艺洁
(东北农业大学食品学院,黑龙江哈尔滨 150030)
苹果多酚是苹果中所含多元酚类的总称,包含有黄酮醇、原花青素、表儿茶素等成分,具有很强的抗氧化性[1-2]。苹果多酚可以提高人体的免疫力,预防衰老以及辅助治疗心血管疾病、炎症[3],还可以用作水果饮料和果汁中的澄清剂[4]。但苹果多酚在潮湿、阳光、高温等不利条件下极易氧化[5],失去活性,这些不利因素限制了苹果多酚的应用。研究表明:微胶囊是一种能够为微生物、酶、生物活性物质提供保护,使其免受不良环境破坏的有效方法之一[6-7]。大量研究表明苹果多酚安全无毒,对人体没有任何毒副作用[8]。
目前关于微胶囊化的常见方法包括:喷雾干燥、乳化法、挤压法等[9-10]。其中挤压法多采用生物活性物质与亲水性的壁材相混合,通过喷嘴,滴加到反应进程中,是一种简单、高效、成本低廉的方法[11],挤压法在制作多酚类微胶囊的时候由于反应条件温和,能够最大程度地保存多酚的生物活性,且形成的微胶囊在模拟胃液和模拟肠液中都表现出相对较高的稳定性[12]。梁旭等[13]使用壳聚糖和玉米淀粉包埋苹果多酚,但是未对包埋后的苹果多酚微胶囊进行胃肠道中的缓释实验。
本试验采用挤压法制备苹果多酚微胶囊并对微胶囊的制备条件进行优化,旨在较低成本的条件下提高苹果多酚的包埋率,为苹果多酚抵抗不良环境提供保障。
1 材料与方法
1.1 材料与仪器
苹果多酚(食品级,含量≥75%) 上海源叶生物技术有限公司;海藻酸钠 天津市光复精细化工研究所;氯化钙 华美生物工程公司;壳聚糖、福林酚 Biotopped公司;没食子酸、磷酸氢二钾、盐酸 天津市科密欧化学试剂开发中心;碳酸钠 天津市东丽区天大化学试剂厂;乙醇 天津市天力化学试剂有限公司;胃蛋白酶(3000 IU/g) Oxoid公司;胰蛋白酶(4000 IU/g) Amresco公司;其他试剂 均为国产分析纯。
GL-12B型高速冷冻离心机 上海安亭科学仪器厂;精密pH计 北京朋利驰科技有限公司;PL403型电子天平 Mettler Toledo(上海)有限公司;UV-2401PC型紫外分光光度计 北京京科瑞达科技有限公司;DL-360A型超声清洗器 上海之信仪器有限公司;FD-5型真空冷冻干燥机 上海医用分析仪器厂;磁力搅拌器 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 微胶囊制备 本试验采用挤压法制备微胶囊[14]。按芯壁比取海藻酸钠溶液与多酚溶液混合,42 ℃水浴搅拌30 min;再取一定量的壳聚糖溶液与氯化钙溶液混合,调整pH,定容至50 mL;将配制好的壳聚糖与氯化钙混合液置于烧杯中,取海藻酸钠与多酚混合液,缓慢滴于烧杯中,低速搅拌20 min,静置20 min,过滤分离,收集滤液,经冷冻干燥得微胶囊制品。
1.2.2 单因素试验 采用1.2.1的方法对苹果多酚进行包埋,包埋条件为:氯化钙浓度0.040 g/mL、pH7.0、芯壁比2∶1,研究海藻酸钠浓度(0.010、0.015、0.020、0.025、0.030 g/mL)对苹果多酚微胶囊包埋率的影响;海藻酸钠浓度0.020 g/mL、pH7.0、芯壁比2∶1,研究氯化钙浓度(0.020、0.030、0.040、0.050、0.060 g/mL)对苹果多酚微胶囊包埋率的影响;海藻酸钠浓度0.020 g/mL、氯化钙浓度0.040 g/mL、芯壁比2∶1,研究pH(6.2、6.6、7.0、7.4、7.8)对苹果多酚微胶囊包埋率的影响;海藻酸钠浓度0.020 g/mL、氯化钙浓度0.040 g/mL、pH7.0,研究芯壁比(3∶1、2∶1、1∶1、1∶2、1∶3)对苹果多酚微胶囊包埋率的影响。
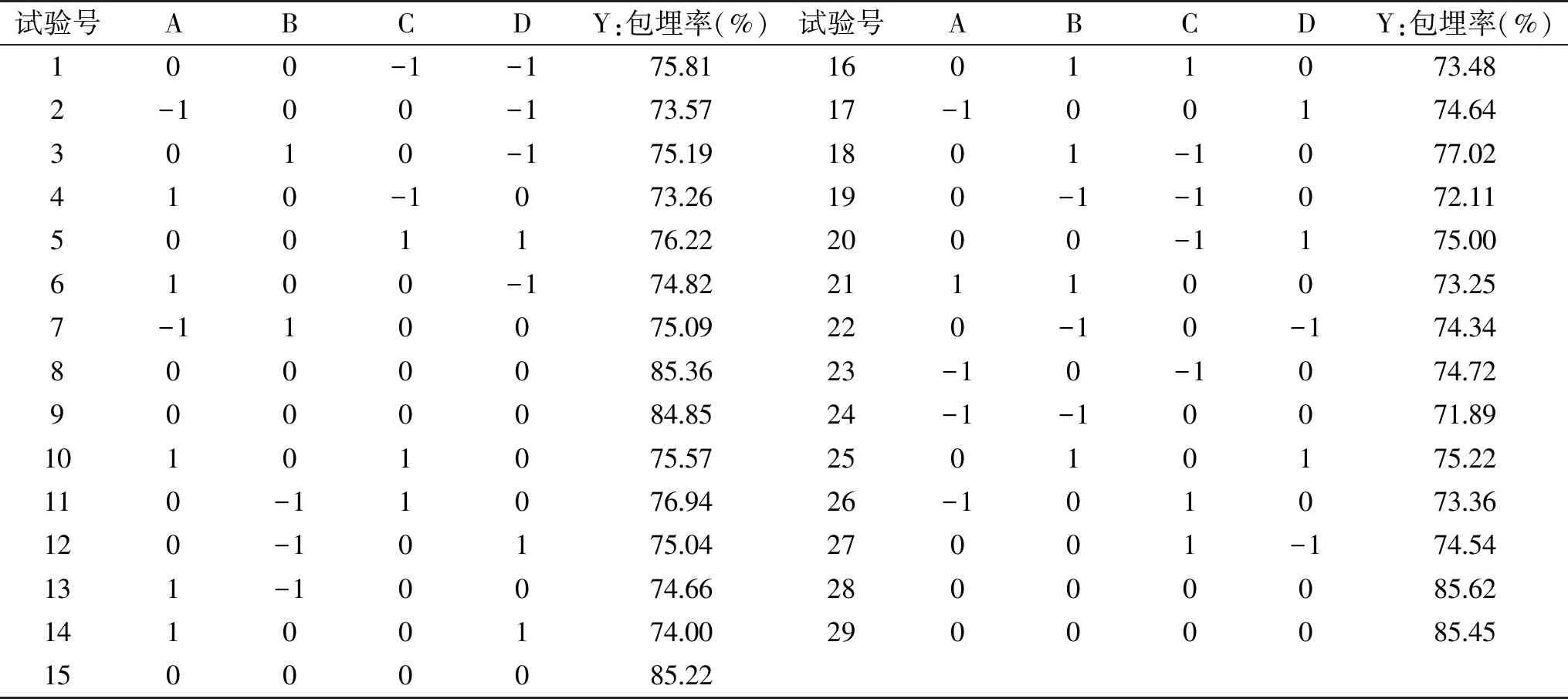
1.2.3 响应面优化试验 在单因素试验的基础上,根据响应面Box-Benhnken试验设计原理,选取海藻酸钠浓度(A)、氯化钙浓度(B)、pH(C)、芯壁比(D)四个因素,以微胶囊包埋率为响应值,设计四因素三水平的响应面优化试验,确定苹果多酚微胶囊包埋的最佳工艺(表1)。
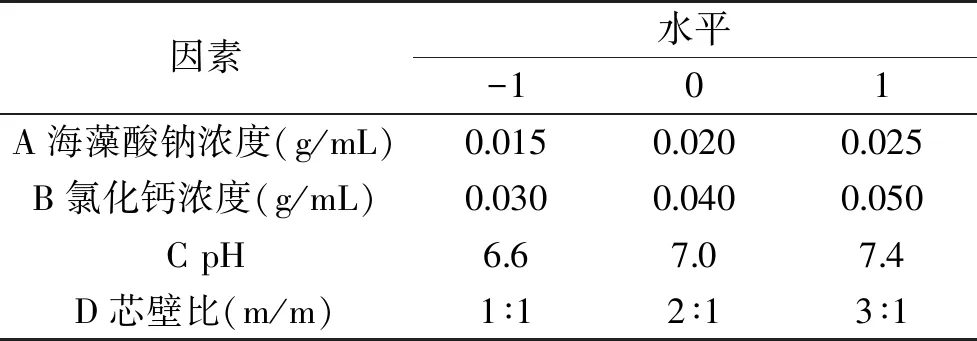
表1 响应面试验因素水平Table 1 Levels and code of independent variable used for response surface analysis
1.2.4 微胶囊包埋率测定 采用Folin-Ciocalteu测定苹果多酚含量[15],按照没食子酸当量法测定苹果多酚含量,绘制没食子酸标准曲线为Y=7.23208X-0.00417,R2=0.9994,线性范围在0~100 μg/mL。根据1.2.4.3公式计算出各工艺条件下苹果多酚的微胶囊包埋率,并对结果进行比较分析。
1.2.4.1 微胶囊表面苹果多酚含量测定 称取1.0 g微胶囊成品,定容在100 mL容量瓶中,混匀10 min,用移液管取1 mL上清液定容在25 mL容量瓶中,10 min后在760 nm处测定吸光值,利用标准曲线计算微胶囊表面苹果多酚的含量。
1.2.4.2 微胶囊内部苹果多酚含量测定 称取1.0 g微胶囊样品,用30 mL无水乙醇溶液溶解壁材,超声清洗30 min,取1 mL溶解液,定容在25 mL容量瓶中,10 min后在760 nm处测定吸光值,利用标准曲线计算微胶囊内部苹果多酚含量[16]。
1.2.4.3 微胶囊包埋率计算

式(1)
式中:m1为微胶囊表面苹果多酚的含量,mg;m2为微胶囊内苹果多酚的含量,mg。
1.2.5 微胶囊在人工胃液和肠液中稳定性的测定 模拟人工胃液[17]:盐酸溶液16.4 mL,胃蛋白酶10 g,加去离子水搅拌均匀后,定容至100 mL,此时pH约为2,备用。
模拟人工肠液:称取磷酸二氢钾6.8 g,胰蛋白酶10 g,加去离子水使之溶解,定容至1 L,用氢氧化钠调节pH=6.8备用。
取0.5 g微胶囊分别加入装有100 mL人工胃液、人工肠液的三角瓶中,于37 ℃摇床中振荡处理0.5、1、1.5、2、2.5 h;分别取样,测定苹果多酚含量,并计算微胶囊缓释率[18]。
微胶囊缓释率计算公式:
微胶囊缓释率(%)=释放的苹果多酚含量(mg)/包埋的苹果多酚含量(mg)×100
式(2)
1.2.6 数据统计分析 每个试验重复3次,采用Design Expert 8.0.6软件对中心组合试验设计进行相关性和差异显著性统计分析,并采用Origin 8.5进行作图,并进行多元统计学分析。
2 结果与分析
2.1 海藻酸钠浓度对苹果多酚微胶囊包埋率的影响
海藻酸钠浓度对苹果多酚微胶囊包埋率的影响见图1。
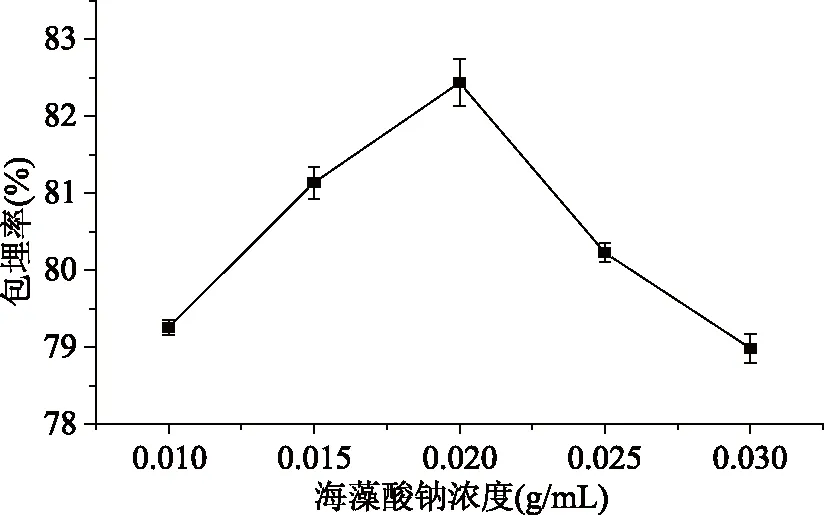
图1 海藻酸钠浓度对苹果多酚微胶囊包埋率的影响
由图1可知苹果多酚微胶囊的包埋率随着海藻酸钠浓度的增加而显著升高(p<0.05),当海藻酸钠浓度达到0.020 g/mL时,微胶囊包埋率达到最大,为82.44%,海藻酸钠浓度继续增加,微胶囊包埋率反而逐渐下降,这可能是因为当海藻酸钠浓度过低时,溶液粘度较小,形成的微胶囊壁材较薄,导致包埋率降低;当海藻酸钠浓度过大时,海藻酸钠的粘度也随之增大,苹果多酚溶液没有与壁材均匀混合以及形成的微胶囊壁较厚,导致苹果多酚微胶囊的包埋率降低[19-20]。
2.2 氯化钙浓度对苹果多酚微胶囊包埋率的影响
氯化钙浓度对苹果多酚微胶囊包埋率的影响见图2。
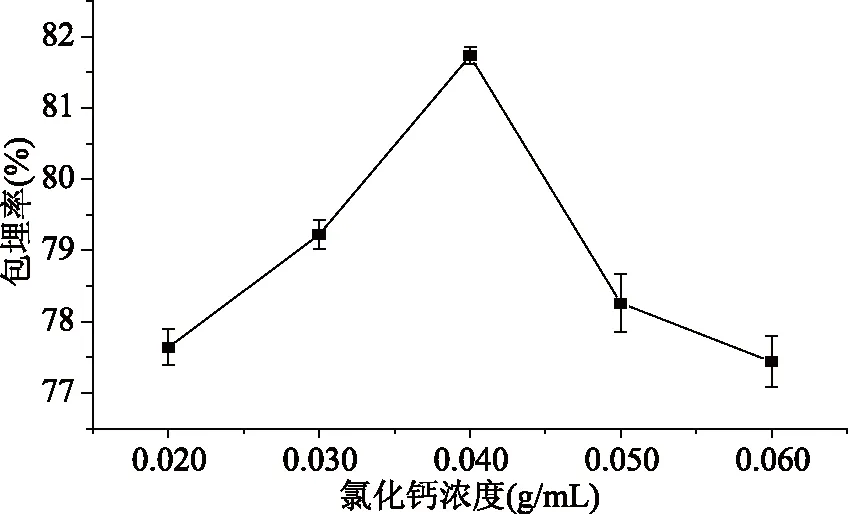
图2 氯化钙浓度对苹果多酚微胶囊包埋率的影响
由图2可知苹果多酚微胶囊的包埋率随着氯化钙浓度的增加而显著增加(p<0.05),当氯化钙浓度到达0.040 g/mL时,微胶囊包埋率达到最大值,随着氯化钙浓度的继续增加,包埋率逐渐降低。溶液中Ca2+浓度过低时,不利于海藻酸盐沉淀的形成,降低苹果多酚微胶囊包埋率;Ca2+浓度逐渐增大,增加了Ca2+与海藻酸钠之间的凝胶化反应[21],有利于微胶囊的形成,包埋率也随之增大;Ca2+浓度过大时,溶液中大量的Ca2+增加了微胶囊的表面张力,海藻酸钠无法再与氯化钙进行凝胶反应,导致微胶囊的包埋率逐渐下降[22]。
2.3 pH对苹果多酚微胶囊包埋率的影响
pH对苹果多酚微胶囊包埋率的影响见图3。

图3 pH对苹果多酚微胶囊包埋率的影响
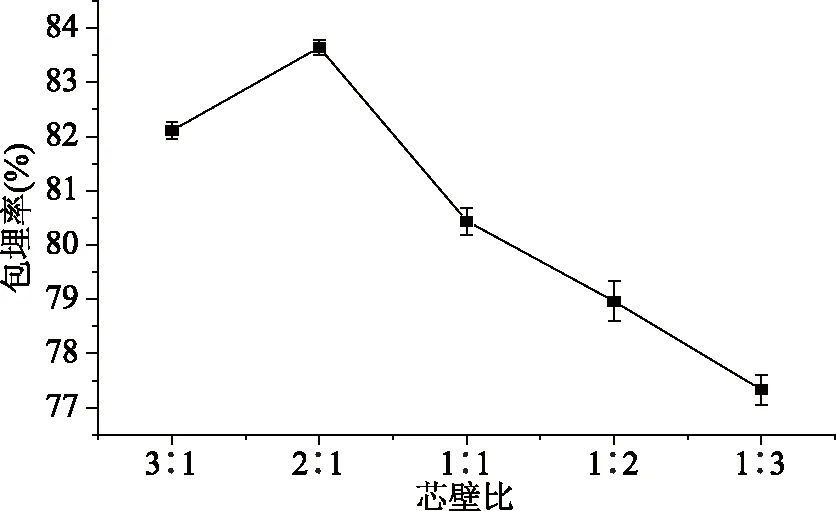
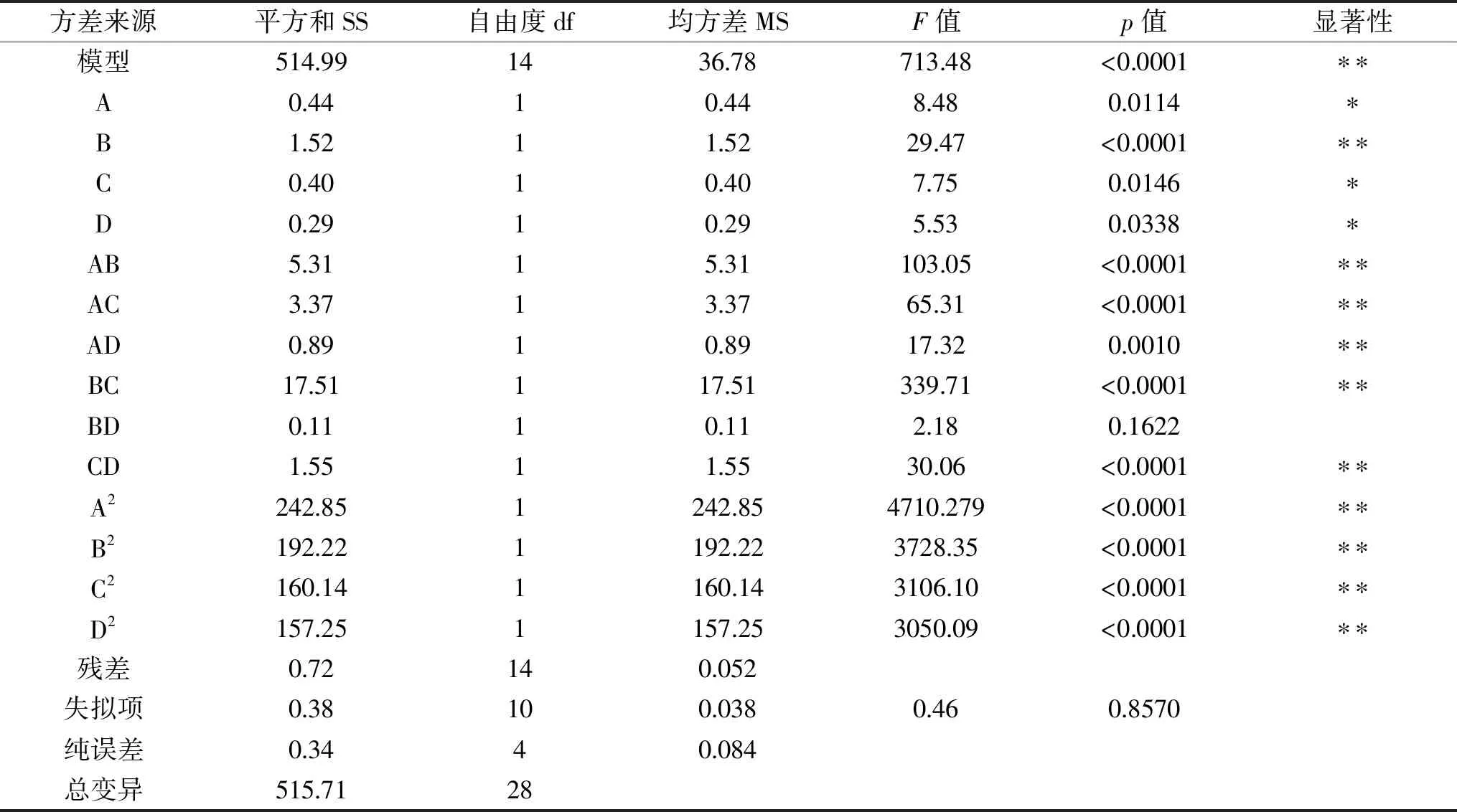
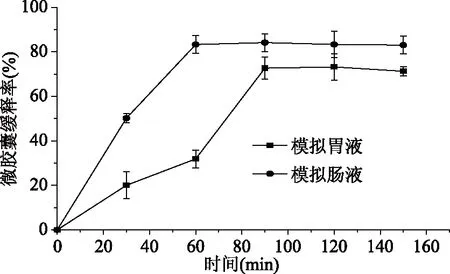
由图3可知pH<6.2时,微胶囊无法形成,pH>7.8时,微胶囊相互粘连,成囊效果差,成囊后粒径变大,考虑苹果多酚在过酸过碱的环境下自身结构会遭到破坏,影响微胶囊的包埋率,苹果多酚微胶囊的包埋率在pH=7时达到最大。因此在6.2 芯壁比对苹果多酚微胶囊包埋率的影响见图4。 图4 芯壁比对苹果多酚微胶囊包埋率的影响 由图4可以看出苹果多酚微胶囊的包埋率随着芯壁比的增加逐渐增大,当芯壁比为2∶1时,苹果多酚微胶囊的包埋率最大。芯壁比过高和过低造成微胶囊成囊不均、无法成囊,且包埋率也受到影响。芯壁比超过2∶1时,包埋率显著降低(p<0.05)。 2.5.1 模型的建立及显著性检验 根据响应面Box-Benhnken试验设计,以包埋率为响应值,选择海藻酸钠浓度、氯化钙浓度、pH、芯壁比四个因素进行29组试验,响应面分析方案及试验结果见表2。 表2 响应面试验设计方案及结果Table 2 Experimental scheme and results of response surface method 采用Design Expert 8.0.6软件对表2中的数据进行多元线性拟合,可得出苹果多酚包埋率(%)与各因素编码值之间的多元二次回归模型:Y=85.30+0.19A+0.36B+0.18C+0.015D-1.15AB+0.92AC-0.47AD-2.09BC-0.17BD+0.62CD-6.12A2-5.44B2-4.97C2-4.92D2。 对模型方程进行显著性检验,见表3。 表3 回归方程的显著性检验及方差分析Table 3 Significance test of regression equation and variance analysis(ANOVA) 由表3可知,模型中全部二次项对响应值Y(包埋率)的影响都极显著(p<0.01);一次项中A、C、D对响应值Y影响显著(p<0.05),B对响应值Y影响极显著(p<0.01);交互项除BD外对Y的影响全都极显著(p<0.01),BD对Y的影响不显著(p>0.05)。由此可知,各实验因素对响应值的影响具有交互作用,并非是单纯的线性关系。 2.5.2 各因素交互作用的响应曲面和等高线图分析 通过Design Expert 8.0.6软件对回归方程进行拟合,得各因素间交互作用的响应曲面图和等高线,见图5。响应曲面中各因素对应曲线的陡峭程度与其响应值影响程度呈正相关。 响应面中的等高线图、曲线图都反映了两个不同条件相互交互作用对苹果多酚微胶囊包埋率的影响,曲线图反映的更为直观,研究表明,等高线的形状越接近圆形,表明两个因素相互交互作用越弱,越接近椭圆形相互交互作用越强,影响越显著[11,23]。 图5中等高线图形接近椭圆形,表明两个变量的交互作用对苹果多酚微胶囊包埋率有显著影响。其中(1)和(4)的等高线图为椭圆形,这也体现了两种壁材浓度的交互作用对微胶囊包埋率的影响显著,当一种壁材浓度不变时,微胶囊的包埋率随另一种壁材浓度的增加而增加,随后逐渐平缓。壁材与pH之间的交互作用也对微胶囊包埋率的影响显著,当壁材浓度不变时,微胶囊包埋率随pH升高而增大随后不变;当pH不变时,微胶囊的包埋率随壁材浓度的增加而增加,随后平缓[24]。 2.5.3 最优条件的确定及验证 通过软件分析得出的使用海藻酸钠和壳聚糖包埋苹果多酚的最佳工艺参数为:海藻酸钠浓度为0.020 g/mL,氯化钙浓度为0.040 g/mL,pH为7.01,芯壁比为2.02∶1,此时苹果多酚的微胶囊包埋率为85.31%。为了实际操作中的便捷,将最佳工艺参数调整为:海藻酸钠浓度为0.020 g/mL,氯化钙浓度为0.040 g/mL,pH为7.0,芯壁比为2∶1。在此条件下进行三次平行试验,测得苹果多酚的包埋率为85.13%,与预测值相对误差为0.21%,结果稳定,预测值可信。因此采用响应面Box-Benhnken试验优化得到的苹果多酚微胶囊的工艺条件准确可靠,具有实用价值。 优化后苹果多酚微胶囊在模拟胃肠液中释放曲线如图6。 图6 优化后苹果多酚微胶囊体外释放曲线 由图6可知微胶囊在模拟胃液中,壁材受胃液影响,逐渐被破坏,释放苹果多酚,在1.5 h时达到最大释放量,为73.18%。在0~1.5 h内微胶囊释放率逐渐增加,说明苹果多酚含量逐渐增多,1.5 h后苹果多酚的浓度趋于稳定(p>0.05)。微胶囊在模拟肠道中,1 h时苹果多酚的释放量达到最大,1 h后苹果多酚的浓度趋于稳定,最大释放率为83.00%(p>0.05),并且从图6中可以明显看出,微胶囊在模拟肠液中的释放时间小于模拟胃液,释放率大于模拟胃液,这是由于在pH>5.5的环境中,Ca2+与磷酸根的结合能力比海藻酸钠的结合能力要强[25],对微胶囊的破坏大于模拟胃液,且在胃液环境中,Ca2+的交联作用要大于肠液。 在单因素基础上,利用响应面的方法进行分析,得出的制备苹果多酚微胶囊的最佳工艺条件:海藻酸钠浓度为0.020 g/mL,氯化钙浓度为0.040 g/mL,pH为7.0,芯壁比为2∶1。在此条件下,获得的苹果多酚的包埋率为85.13%。此条件下微胶囊成囊率高,在模拟胃液和模拟肠液中缓释效果良好,肠液中的最大释放率为83.00%。该方法简便可行,是一种制备苹果多酚微胶囊的有效方法,并且微胶囊产品在模拟胃肠液中有良好的释放能力。微胶囊化的苹果多酚改善了多酚不稳定易被破坏的缺点,并且增加苹果多酚的缓释特性,为苹果多酚的广泛应用提供了一种新的途径。2.4 芯壁比对苹果多酚微胶囊包埋率的影响
2.5 响应面试验
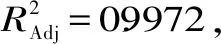
2.6 优化后的微胶囊模拟胃肠道测定
3 结论
