响应面法优化金花葵花水溶性黄酮和总多糖提取工艺
2019-08-28张晓娇孙立权罗爱芹杨学东
张晓娇,孙立权,罗爱芹,杨学东,张 蕊
(北京理工大学生命学院,北京 100081)
金花葵(Aureahelianthus),又名菜芙蓉、野芙蓉,一年生草本锦葵科秋葵属植物,在200多个秋葵植物中最具食用、药用、保健功能[1]。金花葵被誉为“植物界的大熊猫”,营养和开发价值较高。金花葵籽油中富含人体必需的不饱和脂肪酸[2-3],此外还具有多种生物活性成分和其他有益的微量元素,如黄酮、多糖、核苷和有机酸等[4-6]。曹东怡等[7]对金花葵不同部位有效成分进行分析,研究发现金花葵花的水溶性黄酮、总多糖、总皂苷、甘露醇含量均普遍高于其他部位,特别是水溶性黄酮和总多糖含量丰富。冯朵等[8]研究发现,金花葵花中有以芦丁、金丝桃苷、异槲皮苷、槲皮素为特征指标性成分的黄酮类物质16种,并建立了金花葵花特征图谱的质量评价体系。这些黄酮和多糖类物质已显示出潜在的体外生物活性作用,如镇痛抗炎[9]、抗氧化[10-11]、免疫调节[12]、降血脂[13]、抑制肿瘤细胞[14]等,具有较高的药用价值和广阔的市场发展潜力。
金花葵的花瓣菲薄,室温下其有效成分极易溶出,经加工烘干、揉捻、干燥,可制成具有保健功能的茶类饮品。常见的黄酮或多糖的提取方式主要有溶剂回流提取法[15]、超临界流体提取法[16]、超声波辅助提取法[17]以及微波辅助提取法[18]等。金花葵花黄酮类化合物大多数为溶于水的黄酮苷类物质,主成分棉皮素-8-O-葡萄糖醛酸苷由于含有多个羟基和糖基,在水中的溶解性较大。因此,本研究以水为提取剂,采用浸泡法同时提取金花葵花的黄酮和多糖,探究提取方式、提取时间、提取温度和料液比对金花葵花中水溶性黄酮和多糖提取量的影响。在单因素实验的基础上,采用响应曲面法优化工艺条件,并利用高效液相色谱对金花葵花中黄酮和多糖类成分进行定性分析,为金花葵花黄酮和多糖类物质的化学结构解析、生物活性评价和构效关系研究提供理论基础。
1 材料与方法
1.1 材料与仪器
金花葵花 中农本草农业科技服务有限公司,经北京理工大学肖盛元教授鉴定为金花葵(Aureahelianthus)的干燥花冠,粉碎后过60目筛备用;芦丁、金丝桃苷、异槲皮苷、棉皮素-3-O-葡萄糖醛酸苷、杨梅素、槲皮素标准品(分析纯) 北京伊诺凯化学有限公司;D-葡萄糖、D-阿拉伯糖、D-果糖、D-甘露糖、D-半乳糖、L-盐藻糖、L-鼠李糖标准品(分析纯) 阿拉丁试剂有限公司;亚硝酸钠、硝酸铝、氢氧化钠、苯酚、浓硫酸和三氟乙酸(TFA) 北京化学试剂厂;甲醇和乙腈(色谱级) 北京伊诺凯化学有限公司。
岛津UV-1800型紫外可见分光光度计 日本岛津公司;ALC-210.4型电子分析天平 德国赛多利斯科技有限公司;水浴锅 巩义市予华仪器有限责任公司;MCR-3型微波化学反应器 北京瑞成伟业仪器设备有限公司;N-1200BV-WD型旋转蒸发仪 日本东京理化器械EYELA;Waters高效液相色谱仪(配有515型双泵系统、717型自动进样器、996型二极管阵列检测器和Empower色谱工作站) 美国沃特世科技有限公司;高效液相色谱仪系统(配有P1010双泵系统和UV1000D紫外检测器) 天津博纳艾杰尔科技有限公司;ELSD-UM4800型蒸发光散射检测器(配有XWK-III型空气发生器) 上海通微技术有限公司。
1.2 实验方法
1.2.1 标准溶液制备 精密称取芦丁标准品53.10 mg,置于50 mL容量瓶中,用甲醇定容,即得芦丁标准品溶液(1.062 mg/mL);精密称取葡萄糖标准品51.50 mg,置于50 mL容量瓶中,加蒸馏水定容,即得葡萄糖标准品溶液(1.030 mg/mL);精密称取22.00 mg芦丁、14.10 mg金丝桃苷、17.50 mg异槲皮苷、10.80 mg棉皮素-8-O-葡萄糖醛酸苷、15.50 mg杨梅素和22.50 mg槲皮素置于50 mL容量瓶中,用甲醇定容,即得混合黄酮类标准溶液(芦丁0.440 mg/mL、金丝桃苷0.282 mg/mL、异槲皮苷0.350 mg/mL、棉皮素-8-O-葡萄糖醛酸苷0.216 mg/mL、杨梅素0.310 mg/mL和槲皮素0.450 mg/mL);精密称取一定量52.5 mg葡萄糖、92.7 mg阿拉伯糖、25.1 mg果糖、80.9 mg甘露糖、86.4 mg半乳糖、83.0 mg盐藻糖、81.7 mg鼠李糖置于50 mL容量瓶中,加蒸馏水定容,即得混合单糖类标准溶液(葡萄糖1.05 mg/mL、阿拉伯糖1.854 mg/mL、果糖0.502 mg/mL、甘露糖1.618 mg/mL、半乳糖1.728 mg/mL、盐藻糖1.606 mg/mL和鼠李糖1.634 mg/mL)。
1.2.2 提取方式对比 加热回流法:精密称取金花葵花粗粉0.5 g,以料液比为1∶100,提取溶剂为水,提取温度80 ℃为条件,加热回流提取120 min,抽滤,得到金花葵花残渣和上清液,将金花葵花残渣按照上述条件重复提取两次,分别收集上清液,置于4 ℃保存备用。
微波提取法:精密称取金花葵花粗粉0.5 g,以料液比为1∶100,提取溶剂为水,提取温度80 ℃为条件,微波提取10 min,抽滤,得到金花葵花残渣和上清液,将金花葵花残渣按照上述条件重复提取两次,分别收集上清液,置于4 ℃保存备用。
常温浸泡法:精密称取金花葵花粗粉0.5 g,以料液比为1∶100,提取溶剂为水,提取温度80 ℃为条件,室温下静置120 min,抽滤,得到金花葵花残渣和上清液,将金花葵花残渣按照上述条件重复提取两次,分别收集上清液,置于4 ℃保存备用。
1.2.3 单因素实验 通过单因素实验考察提取时间、提取温度和料液比对金花葵花水溶性黄酮和总多糖提取量的影响,以确定各参数范围,为优化浸泡法提取金花葵花水溶性黄酮和总多糖提取量的工艺参数提供依据。
1.2.3.1 提取时间对提取效果的影响 分别称取金花葵花干燥粗粉末0.5 g于锥形瓶中,加入50 mL事先预热的80 ℃蒸馏水提取金花葵花水溶性黄酮和总多糖提取量,混匀后,室温下静置5、10、15、30、60、120、180、240、300 min,抽滤,收集上清液,试验平行三次,探究提取时间对金花葵花水溶性黄酮和总多糖提取量的影响。
1.2.3.2 提取温度对提取效果的影响 分别称取金花葵花干燥粗粉末0.5 g于锥形瓶中,加入50 mL事先预热的(25、40、60、80、100 ℃)蒸馏水提取金花葵花水溶性黄酮和总多糖提取量,混匀后,室温下静置120 min,抽滤,收集上清液,试验平行三次,探究提取温度对金花葵花水溶性黄酮和总多糖提取量的影响。
1.2.3.3 料液比对提取效果的影响 分别称取金花葵花干燥粗粉末0.5 g于锥形瓶中,按料液比1∶30、1∶50、1∶100、1∶200、1∶300加入事先预热的80 ℃蒸馏水提取金花葵花水溶性黄酮和总多糖提取量,混匀后,室温下静置120 min,抽滤,收集上清液,试验平行三次,探究提取温度对金花葵花水溶性黄酮和总多糖提取量的影响。
1.2.4 响应面试验 在单因素实验基础上,根据Box-Behnken-design 实验设计原理,选取提取时间(A)、提取温度(B)和料液比(C)为独立变量,金花葵花水溶性黄酮(Y1)和总多糖(Y2)提取量为响应值,利用软件Design-Expert 8.0.6进行响应面试验,优化浸泡法提取金花葵花水溶性黄酮和多糖的工艺参数,表1为实验因素水平与编码表。
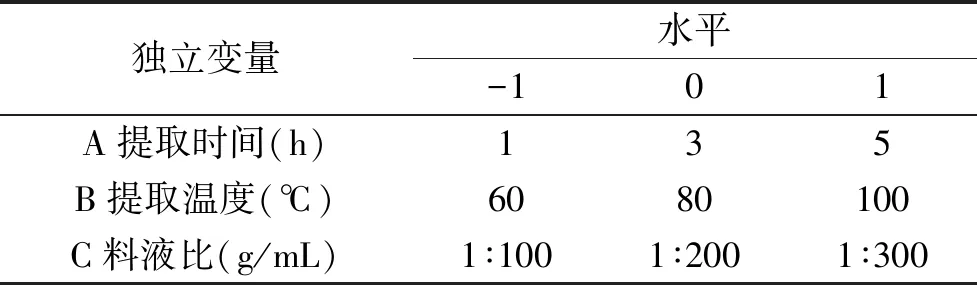
表1 Box-Behnken实验因素水平表Table 1 Factors and levels for Box-Behnken experiment
1.2.5 指标测定及方法
1.2.5.1 水溶性黄酮的测定 水溶性黄酮含量的测定采用亚硝酸钠-氯化铝法,分别精密吸取芦丁对照品溶液0.1、0.2、0.5、1.0、2.0、5.0 mL于10 mL容量瓶中加甲醇定容至刻度。分别吸取上述溶液5.0 mL于试管中,滴加5% NaNO2溶液0.3 mL,摇匀后放置5 min,加入10% Al(NO3)3溶液0.3 mL,摇匀后放置6 min,加1.0 mol/L NaOH溶液2 mL,摇匀后放置15 min,按照上述方法制备空白对照溶液,在510 nm波长处测定吸光度[19]。以芦丁浓度(x,mg/mL)为横坐标,吸光度(y)为纵坐标绘制标准曲线,得线性回归方程:y=5.8831x+0.0163,R2=0.9991,结果表明芦丁浓度在0.0106~0.5310 mg/mL内呈现良好的线性关系。
取1.2.4中的样品溶液适量按上述方法测定水溶性黄酮含量,平行3次,按照下列公式计算水溶性黄酮提取量:
式中:C1为样品的水溶性黄酮浓度,mg/mL;V1为测定样品溶液体积,mL;M为样品质量,g。
1.2.5.2 总多糖的测定 总多糖的测定采用苯酚-硫酸法,分别精密吸取葡萄糖对照品溶液0.1、0.3、0.5、1.0、2.0、5.0、7.0 mL,置于10 mL容量瓶中加蒸馏水稀释至刻度。分别吸取上述溶液0.2 mL,加入0.4 mL 50 mg/mL苯酚溶液,混匀后迅速加入2 mL浓硫酸,摇匀后室温放置30 min,按照上述方法制备空白对照溶液,在490 nm波长处测定吸光度[20]。以葡萄糖浓度(x,mg/mL)为横坐标,吸光度(y)为纵坐标绘制标准曲线,得线性回归方程:y=3.6768x+0.1908,R2=0.9998,结果表明葡萄糖浓度在0.0103~0.7210 mg/mL内呈现良好的线性关系。
精密量取1.2中的样品溶液2 mL于10 mL量瓶中加溶剂稀释至刻度,取各样品溶液适量按上述方法测定总多糖含量,平行3次,按照下列公式计算总多糖提取量:
式中:C2为样品的总多糖浓度,mg/mL;V2为测定样品溶液体积,mL;M为样品质量,g。
1.2.6 高效液相色谱法分析金花葵花水溶性黄酮的组成 综合Lai等[21]和Pan等[22]的分析方法,对混合黄酮对照品溶液和金花葵花提取液进行HPLC分析,获得各色谱峰的保留时间,对混合对照品与样品保留时间的比较,分析金花葵花水溶性黄酮的组成成分,所采用的色谱条件如下:色谱柱:COSMOSIL C18反相色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈-0.1%甲酸溶液梯度洗脱(0~18 min,15∶85~16∶84 (V/V);18~26 min,16∶84~20∶80 (V/V);26~35 min,20∶80~40∶60 (V/V);35~40 min,40∶60 (V/V);40~50 min,40∶60~15∶85 (V/V));流速为 1.0 mL/min,检测波长为360 nm,进样量10 μL,柱温为25 ℃。
1.2.7 高效液相色谱-蒸发光散射法分析金花葵花多糖的组成 参考Zheng等[23]和张淋洁等[24]对金花葵多糖的组成进行分析,取一定量上述金花葵花的水提液,在80 ℃下减压浓缩,加入95%乙醇预先沉淀并静置过夜(12 h,4 ℃),收集沉淀物并依次用无水乙醇、丙酮和乙醚洗涤,将沉淀物在80 ℃下真空干燥后得到金花葵花粗多糖。取50.0 mg粗多糖加入10.0 mL 2 mol/L TFA溶液,在100 ℃下密封加热水解3 h,将水解液在80 ℃下减压浓缩至干,再加入1 mL甲醇,在80 ℃下蒸干,重复上述操作3次以除尽TFA,加入1 mL蒸馏水溶解残渣,获得金花葵花多糖全水解液,置于4 ℃保存备用。
对混合单糖标准溶液和金花葵花粗多糖全水解液进行高效液相色谱-蒸发光散射法(HPLC-ELSD)分析,比较混合对照品与样品保留时间,分析金花葵花粗多糖的单糖组成,所采用的色谱条件如下。色谱条件:色谱柱:Welch XBridge Amide氨基柱(4.6 mm×250 mm,5 μm);流动相:乙腈/水=78/22 (V/V);流速:1 mL/min;ELSD条件:漂移管温度70 ℃,气体流速2.5 mL/min。
1.3 数据处理
采用Design-Expert. 8.0.6软件进行试验设计,采用OriginPro 8.0软件进行作图和数据分析,显著水平p<0.05,极显著水平p<0.01。所有数据均重复测定三次,结果取平均值。
2 结果与分析
2.1 提取方式对比
以蒸馏水为提取溶剂,对加热回流法、微波提取法和常温浸泡法提取金花葵花水溶性黄酮和多糖进行比较,结果如图1所示。从图1中可以看出,相比加热回流法和微波提取法,常温浸泡法对于提取水溶性黄酮和总多糖提取量略有下降,但差异不大,分别为(38.07±1.63) mg/g和(119.03±2.56) mg/g。常温浸泡工艺操作简单,成本低,且避免了长时间受热破坏生物活性成分,可用于提取金花葵花中水溶性较好的生物活性成分。图1中可以看出,提取1次后金花葵花中黄酮和多糖已基本浸出,故采用提取次数为1次。
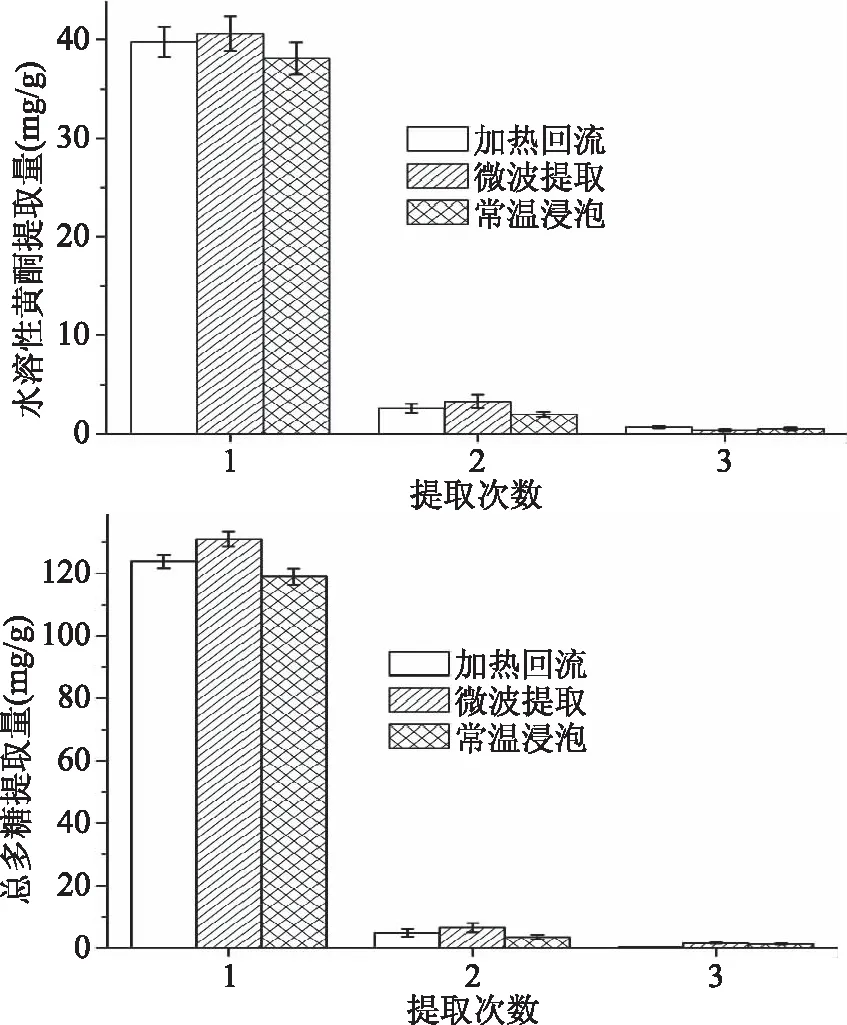
图1 提取方式对水溶性黄酮和总多糖提取量的影响
2.2 单因素实验结果
2.2.1 提取时间对水溶性黄酮和总多糖提取量的影响 图2表示提取时间对金花葵花水溶性黄酮和总多糖提取量的影响。从图2可以看出,水溶性黄酮和总多糖提取量随提取时间的增加呈急速上升趋势,提取时间超过120 min,水溶性黄酮提取量上升不明显,而总多糖提取量随着时间的增长持续增加,提取时间为120 min左右,水溶性黄酮提取量达最大值,为(38.08±1.63) mg/g,提取时间为300 min,总多糖提取量达到最大值,为(133.16±2.65) mg/g,故选取提取时间为60、180、300 min三水平进行响应曲面实验。
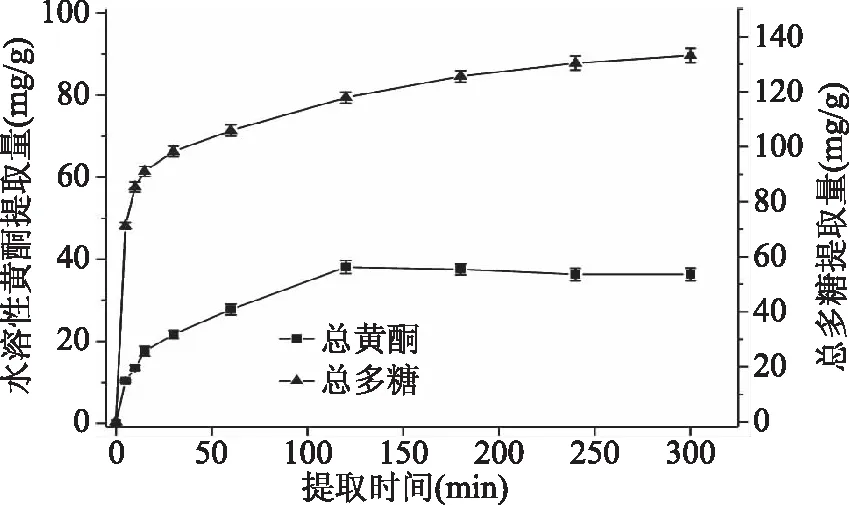
图2 提取时间对水溶性黄酮和总多糖提取量的影响
2.2.2 提取温度对水溶性黄酮和总多糖提取量的影响 图3分别表示提取温度对金花葵花水溶性黄酮和总多糖提取量的影响。如图3所示,水溶性黄酮提取量在提取温度为80 ℃时达到峰值,为(38.75±1.62) mg/g,温度升高,有助于黄酮的提取,但温度过高可能引起黄酮结构被氧化破坏,导致黄酮浸出率降低,因此,80 ℃是提取水溶性黄酮的最适提取温度。而总多糖提取量随提取温度的增大而增长,当提取温度为100 ℃时,总多糖提取量可达最大值,为(130.25±2.33) mg/g,这是因为高温有利于多糖的浸出。因此,选择提取温度为60、80、100 ℃进行后续响应曲面实验。
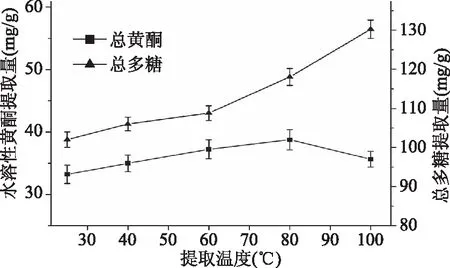
图3 提取温度对水溶性黄酮和总多糖提取量的影响
2.2.3 液料比对水溶性黄酮和总多糖提取量的影响 图4表示料液比对金花葵花水溶性黄酮和总多糖提取量的影响。从图4可以看出,水溶性黄酮和总多糖提取量在料液比为1∶200时达到峰值,分别为(43.23±1.55)、(119.13±1.85) mg/g,因此,选择料液比为1∶100、1∶200和1∶300进行后续响应曲面实验。
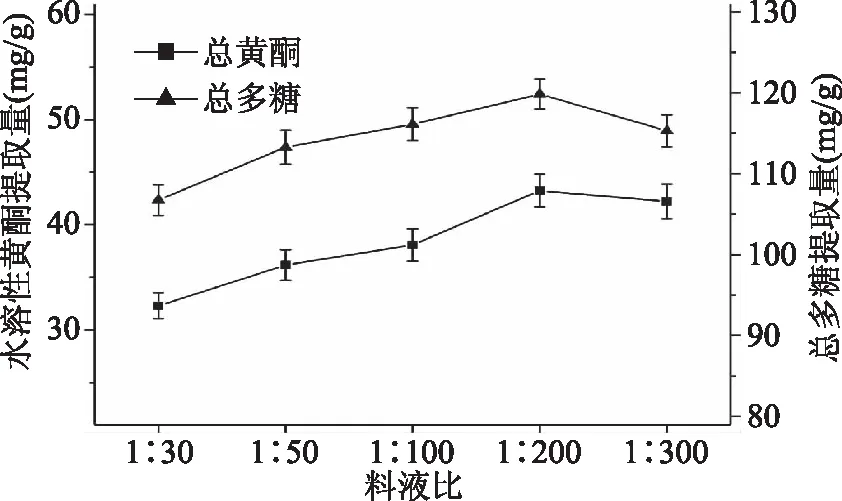
图4 料液比对水溶性黄酮和总多糖提取量的影响
2.3 响应面法优化浸泡法提取金花葵水溶性黄酮和多糖的工艺
2.3.1 响应面试验结果 在单因素实验结果的基础上,采用Box-Behnken实验设计优化浸泡法提取金花葵花水溶性黄酮和多糖的最佳条件,实验结果见表2。二次回归模型的方差分析结果见表3。利用Design-Expert 8.0.6 软件对各因素进行二次回归拟合,得到以下二次回归方程:水溶性黄酮提取量Y1(mg/g)=-71.22+4.05A+2.18B+0.13C+0.04AB+0.007AC-0.009BC-1.13A2-0.01B2-0.0004C2;总多糖提取量Y2(mg/g)=-31.95+27.02A+2.14B-0.09C-0.06AB+0.02AC+0.001BC-3.28A2-0.009B2-0.00005C2。
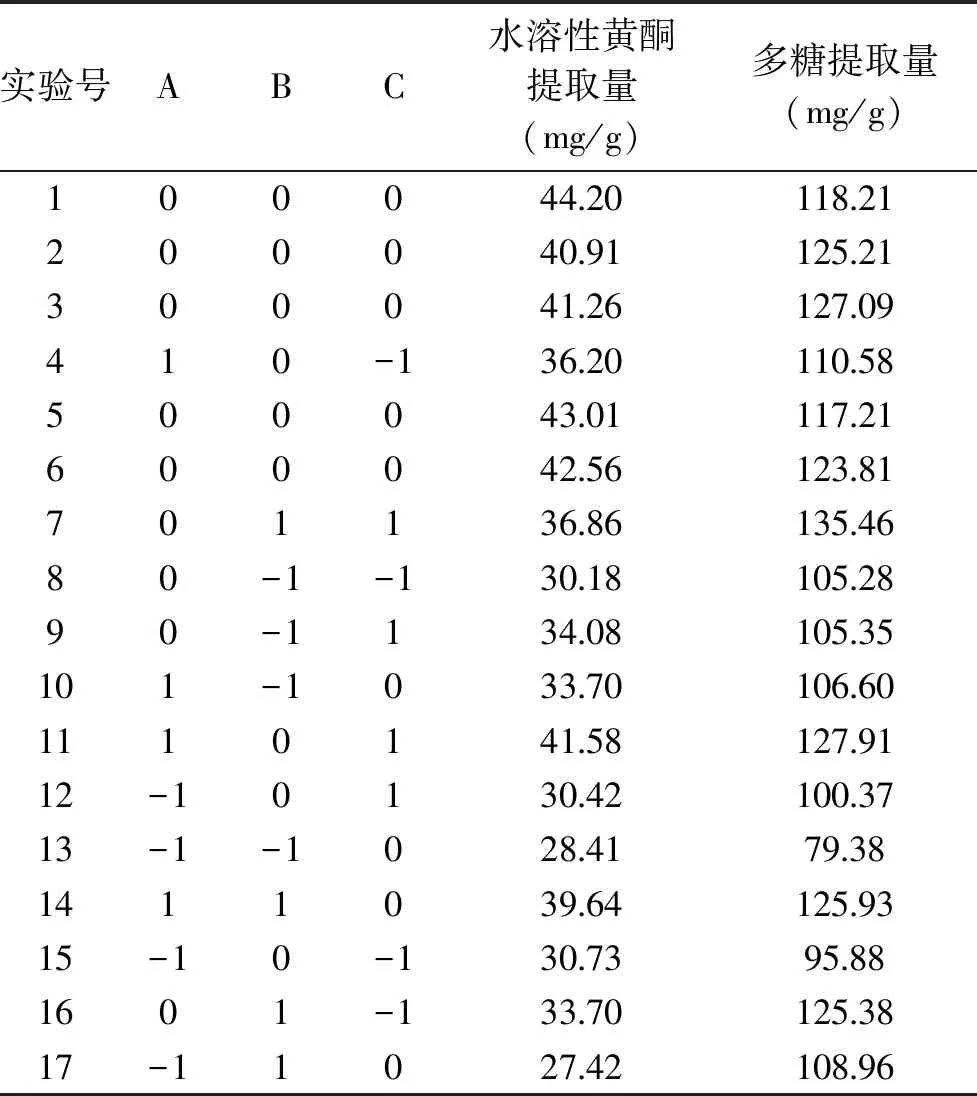
表2 Box-Behnken设计方案及实验结果Table 2 Design and results for Box-Behnken experiment
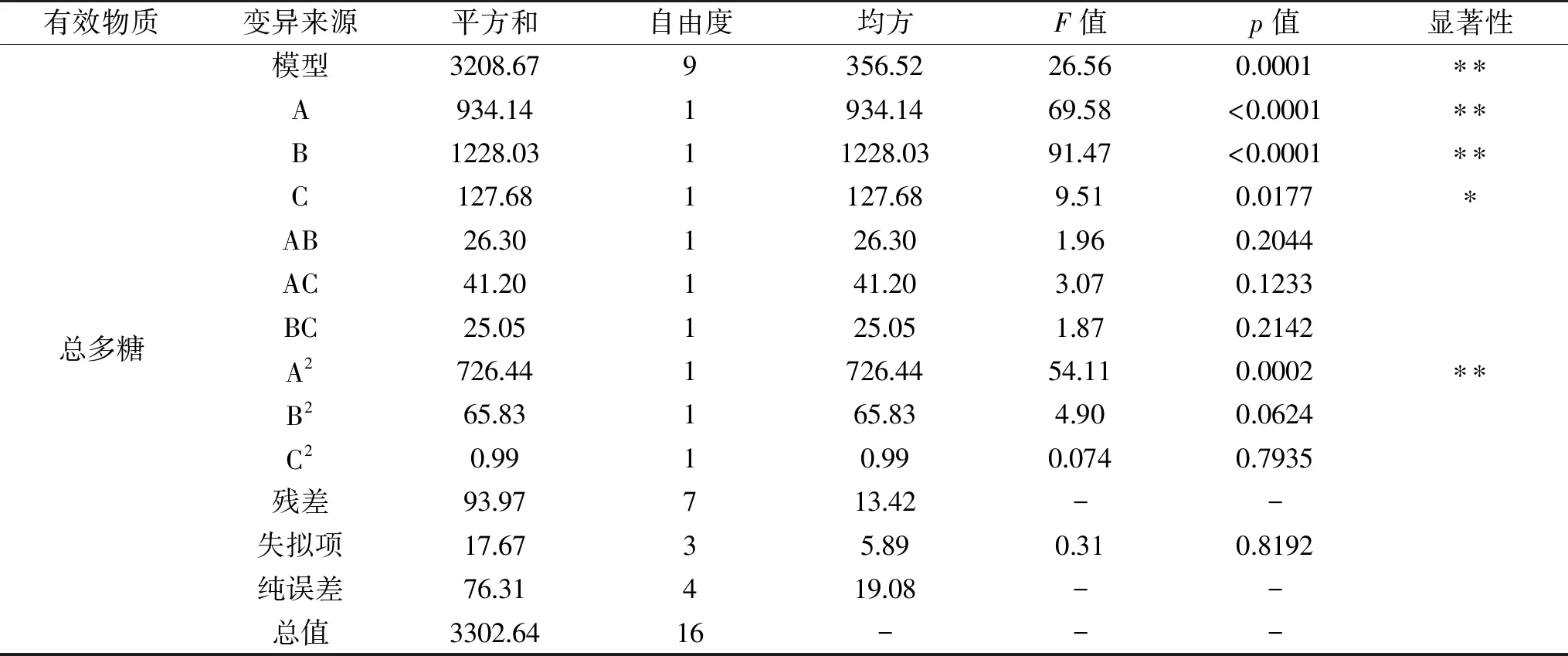
续表
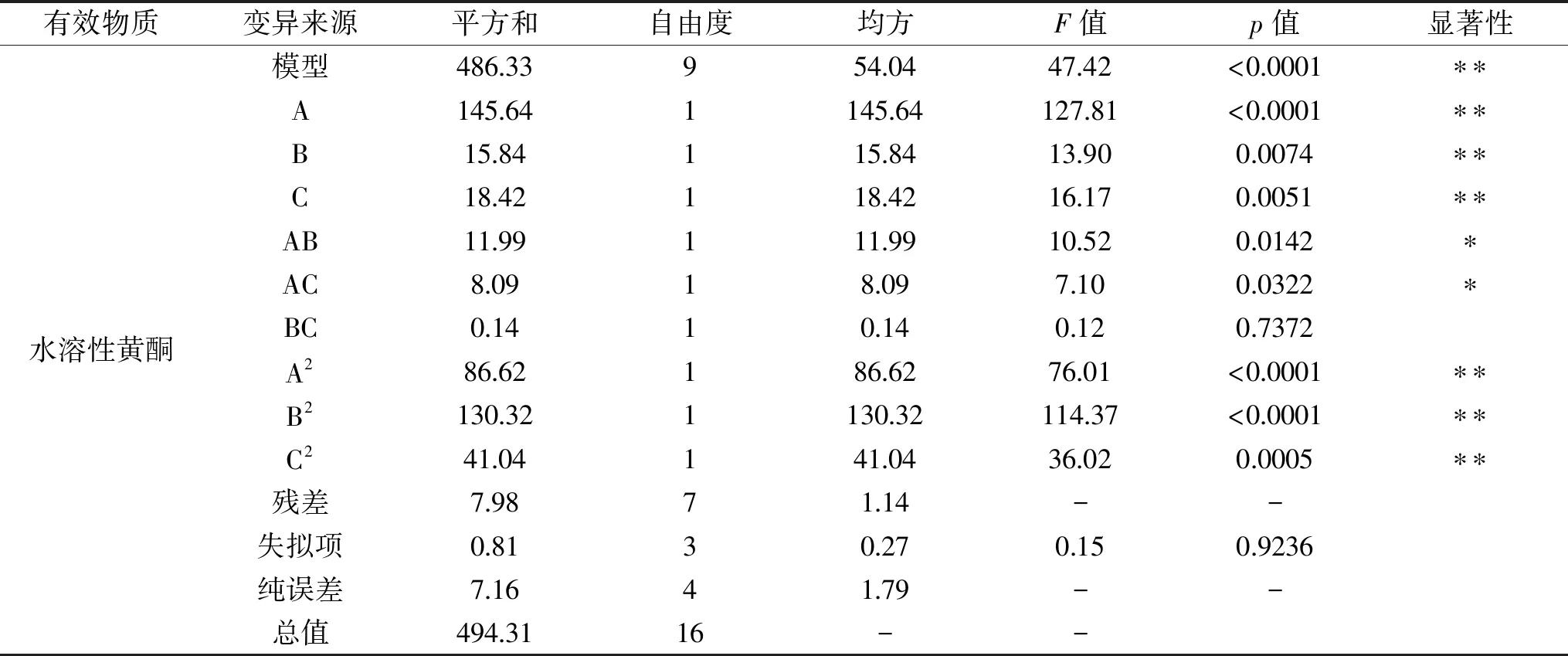
表3 二次回归模型的方差分析结果Table 3 Analysis of variance for quadric regression model
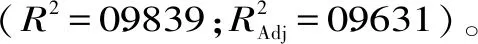
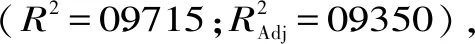
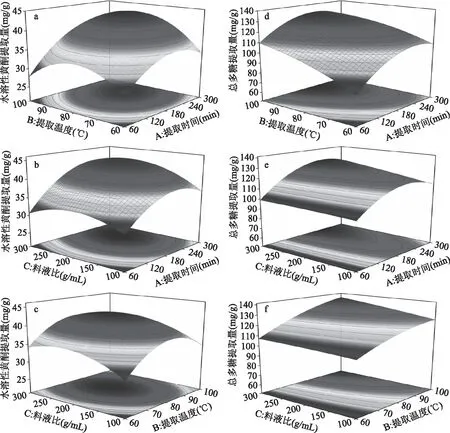
图5 不同因素交互作用对金花葵花水溶性黄酮和总多糖提取量的响应面图
2.3.4 模型的验证性实验 基于回归模型分析,浸泡法提取金花葵花水溶性黄酮和总多糖提取量的最佳工艺为提取时间247.2 min,提取温度89.94 ℃,料液比为1∶265.80,水溶性黄酮提取量的理论值可达(43.42±1.55) mg/g,总多糖提取量的理论值可达(133.68±2.03) mg/g。为验证该方法的可靠性,根据实际操作条件,将最佳提取工艺修正为:提取时间240 min,提取温度90 ℃,料液比为1∶270,实测水溶性黄酮和总多糖的提取量分别为(43.23±0.56)、(134.60±1.45) mg/g,实际值与预测值之间的相对误差分别为0.44%和0.69%,验证了该响应面模型的有效性。
2.4 高效液相色谱分析金花葵花黄酮类化合物的组成
综合Lai等[21]和Pan等[22]的HPLC分析方法,对金花葵花中黄酮类化合物的组成进行分析,图6和图7分别为4种黄酮标准品和金花葵花水提液在360 nm检测条件下的液相色谱图。对比发现,金花葵花中的黄酮类化合物主要是芦丁、金丝桃苷、异槲皮苷、棉皮素-8-O-葡萄糖醛酸苷和杨梅素。其中,棉皮素-8-O-葡萄糖醛酸苷的含量最高,已有研究表明,棉皮素-8-O-葡萄糖醛酸苷有望成为抗炎、抗增殖[25]或治疗阿尔茨海默病[26]的潜在药物。棉皮素-8-O-葡萄糖醛酸苷在水中的溶解性较好,可利用这一特性快速、高效地纯化棉皮素-8-O-葡萄糖醛酸苷,进一步对其进行研究,挖掘金花葵的潜在价值。

图6 混合黄酮标准液的HPLC色谱图
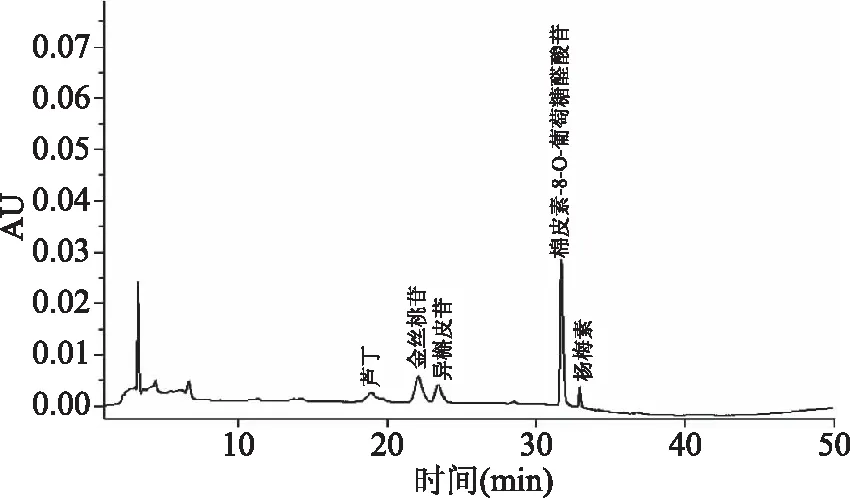
图7 金花葵花水提液的HPLC色谱图
2.5 高效液相色谱-蒸发光散射法分析金花葵花多糖类化合物的单糖组成
参考Zheng等[23]和张淋洁等[24]对天然多糖的分析方法并进行适当调整,采用HPLC-ELSD法检测对金花葵花粗多糖的单糖组成进行分析,图8和图9分别为7种单糖混合标准品和金花葵花多糖水解产物的液相色谱图。图9对比图8混合单糖标准品的保留时间,发现金花葵花多糖主要由鼠李糖、岩藻糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖组成,其中鼠李糖、葡萄糖和半乳糖含量较高,而岩藻糖、阿拉伯糖和甘露糖含量较低,具有潜在的抗肿瘤和免疫调节的特性[23,27]。

图8 混合单糖标准液的HPLC-ELSD分离色谱图

图9 金花葵花多糖水解产物的HPLC-ELSD 色谱图
3 结论
本实验以金花葵干花为原料,水为溶剂浸泡提取金花葵花水溶性黄酮和多糖类成分,探讨了提取条件、提取温度、提取时间和料液比对金花葵花中水溶性黄酮和总多糖提取量的影响。在此基础上,采用响应面设计优化和筛选最佳提取条件,模型具有良好的显著性,最终得出常温浸泡法提取金花葵花水溶性黄酮和总多糖的最佳提取工艺为:提取时间240 min,提取温度90 ℃,料液比为1∶270,水溶性黄酮和总多糖的提取量分别达到为(43.23±0.56)、(134.60±1.45) mg/g,实际值与预测值之间的相对误差分别为0.44%和0.69%,为提取工艺改进提供了一定理论依据。进一步采用高效液相色谱法定性金花葵花中黄酮类化合物,主要包括芦丁、金丝桃苷、异槲皮苷、棉皮素-8-O-葡萄糖醛酸苷和杨梅素,其中棉皮素-8-O-葡萄糖醛酸苷含量最高。多糖主要由鼠李糖、葡萄糖和半乳糖组成,同时含有少量的岩藻糖、阿拉伯糖和甘露糖,为金花葵花黄酮和多糖类物质的化学结构解析、生物活性评价和构效关系的研究提供理论基础,旨在进一步开发利用该植物资源,促进金花葵资源产业链的发展。
