螺内酯联合补钾治疗非酸中毒低钾型周期性瘫痪的疗效观察
2019-08-28李博方毅袁良津
李博,方毅,袁良津
周期性瘫痪是神经内科常见的神经肌肉接头疾病,根据肌无力发作时血清钾浓度被分为3型:低钾型、高钾型和正常血钾型。部分周期性瘫痪系继发,病因有:甲状腺功能亢进、代谢性疾病、肾小管酸中毒、肾衰竭等。当血清钾较低时可累及呼吸肌[1]和心脏,可能危及生命。螺内酯可作用于远曲小管和集合管,阻断 Na+-K+和 Na+-H+交换,结果 Na+、Cl-和水排泄增多,K+、Mg2+和H+排泄减少,故螺内酯保钾时可引起或加重酸中毒。螺内酯可用于周期性麻痹慢性期,但对病情较重的急性期患者目前尚缺乏研究[2]。故本研究选择非酸中毒低钾型周期性瘫痪(hypokalemic periodic paralysis,HypoPP)急性期患者,了解螺内酯的有效性和安全性。
1 资料与方法
1.1 一般资料
收集2015年2月到2018年7月我科收治的非酸中毒HypoPP患者78例,肌无力发作<12 h,无好转趋势,动脉血PH≥7.35者;排除肾脏及其他器官严重疾病患者。HypoPP诊断标准:急性或亚急性起病的四肢或双下肢弛缓性瘫痪,以近端为主,无意识、感觉、膀胱功能障碍,无病理征及颅神经功能受损表现;血清钾<3.5 mmol/L,补钾后瘫痪好转;心电图可见低钾性改变,肌电图可有运动电位波幅低、运动诱发试验可见复合肌肉动作电位(compound muscle action potential,CAMP)减低。
1.2 方法
将患者随机分为治疗组和对照组,各39例。所有患者均予以静脉及口服补钾治疗。治疗组在入组时予以螺内酯20 mg口服1次,同时联合静脉及口服补钾;如24 h、48 h复查血钾<3.5 mmol/L可临时分别口服螺内酯20 mg。每4~12小时复查电解质1次。参照相关资料[3]制定补钾方案:血钾2.5~3.5 mmol/L时,口服10%KCL 15 mL,每4~6小时1次,静脉补10%KCL 15 mL、每24小时1~2次;血钾<2.5 mmol/L时,口服10%KCL 15 mL,每4小时1次,同时静脉补10%KCL 7.5 mL/h;根据复查的血钾水平调整方案,对血氯增高者同时补充枸橼酸钾或门冬酸钾镁;血钾<3 mmol/L时予以心电监护。
收集2组的性别、年龄、发作诱因等资料。入院后急查动脉血气分析、肾功能、电解质、尿常规、心电图等,完善病因学检查,包括甲状腺功能、自身抗体谱、醛固酮、皮质醇等。记录2组患者肌力恢复时间、血清K+正常时间(≥3.5 mmol/L)。入组前部分患者(治疗组20例,对照组18例)予以了肌电图检查小指展肌CAMP(5 min,每30秒休息1次),然后患者放松,计算其运动前和运动放松后10 min的CAMP递减率。
1.3 统计学处理
采用SPSS 23.0软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验;计数资料以率表示,组间比较采用χ2检验;P<0.05为差异有统计学意义。
2 结果
本组患者中入院时间为6~9月者41例(52.56%)。原发病或诱因有:甲状腺功能亢进28例(35.9%),上呼吸道感染12例(15.4%),饱餐9例(12%),疲劳3例(4%),醛固酮增多症2例(2.7%),眩晕2例(2.7%),使用利尿剂1例(1.3%),腹泻1例(1.3%)。2组均无高血钾出现。治疗前对照组小指展肌CAMP递减(41.69±10.34)%,治疗组小指展肌CAMP递减(42.91±8.16)%,差异无统计学意义(t=0.573,P=0.568)。2组年龄、性别、甲亢人数,治疗前尿PH值、血清K+、血清CL-、CO2-CP差异无统计学意义,见表1;治疗组治疗后肌力恢复时间及血清K+恢复正常时间均短于对照组,见表1。
3 讨论
HypoPP是一组与钾离子代谢有关的离子通道疾病,与Ca2+通道和Na+通道相关[4],为常染色体显性遗传;其中CACNA1S基因突变占80%、SCN4A基因突变占10%[5];国外报道周期性麻痹有家族史,按家系计算CACNA1S基因突变占60%家系、SCN4A基因突变占20%家系[6]。在我国以及本研究中本病以散发性HypoPP多见。临床表现为反复发作的驰缓性骨骼肌瘫痪或无力,持续数小时至数周,发作间歇期完全正常。极严重者可有呼吸肌麻痹,呼吸困难及心律失常等。继发性多因甲状腺功能亢进、代谢性疾病、肾小管酸中毒、肾衰竭等引起。本研究中继发于甲状腺功能亢进者最多、入组时还排除了2例Sjögren综合征合并酸中毒患者。电生理检查发现HypoPP患者运动电位时限短、波幅低;小指展肌运动诱发试验CMAP会减低。
在本研究中甲状腺毒性周期性瘫痪(Thyrotoxic periodic paralysis,TPP)患者比例为35.9%,与之前报道相近。TPP[7]是一种对生命有潜在威胁的甲状腺毒症并发症,与家族性低钾型周期性瘫痪不同,TPP患者罕有阳性家族史且发病较晚,临床特征为低钾血症和肌肉麻痹。TPP机制复杂,与K+通道相关[4];基因异常影响Na+-K+-ATP酶功能,甲状腺激素、胰岛素、睾酮增高可使该酶功能上调而发病。国人甲状腺功能亢进患者TPP发病率1.8%。有学者[8]通过超声检查发现TPP患者股四头肌厚度超过单纯甲状腺功能亢进患者。本研究中个别TPP患者的诱因还存在未遵嘱持续使用普萘洛尔。研究中TPP患者的处理除调节血清钾预防严重的心肺并发症之外,还包括非选择性β-肾上腺素能阻滞剂、改善甲状腺功能亢进状态(如手术或I131治疗),同时避免诱发因素。
本研究通过动脉血气分析排除了2例Sjögren综合征患者,但对照组有1例甲状腺功能亢进合并Sjögren综合征的患者入组。Sjögren综合征可引起肾小管酸中毒和HypoPP[9],自身抗体抗-SSA或抗-SSB阳性可提示该病。动脉血气分析可以明确是否存在酸中毒,有助于排出螺内酯禁忌症。本研究中的该例患者动脉血气PH正常,提示HypoPP患者有必要病因学检查以防止漏诊Sjögren综合征累及肾脏不严重者。部分酸中毒患者会出现CO2CP明显降低、尿PH值升高、血CL-升高。故本研究采用前述常规急诊开展的筛查项目,同时进行病因学检查。HypoPP病因筛查项目还有24 h尿钾、肾素、醛固酮、皮质醇、甲状腺功能、自身抗体谱等项目,需要开展但检验时间较长。除前述病因筛查外,部分HypoPP患者还需要与延髓内侧梗死进行鉴别[10]。
本研究的男女比例为6.8∶1,与其他资料HypoPP患者男性发病率高一致;其原因不明。研究显示,一个家系的3例CACNA1SR900S基因突变男性患病而3例女性携带者肌力正常;而另两个家系研究表明大约50%的CACNA1SR528H、1/3的CACNA1SR1239H突变的女性无症状,而>90%的携带CACNA1S基因突变的男性表现出症状[5]。
对于反复发作的患者,预防发作治疗同样重要:研究显示双氯苯二磺酰胺[11]可减少HypoPP患者的发作。控制发作的其他药物有乙酰唑胺,但部分基因型无效。HypoPP急性发作期常出现心脏受累可表现为心电图异常(U波、QT间期延长、T波低平或倒置)、心律失常(室性或室上性心律失常、传导延缓、窦性心动过缓)、心肌酶标志物升高、肠梗阻、恶心、呕吐,严重时可威胁生命。见诸研究的HypoPP心律失常患者有27例,且有9例患者死亡[12]。故而除了预防复发,发作时快速升高血清钾很关键,有时甚至需要双通道输液[13]。本研究中使用的肌无力发作时补钾方案较一些资料[2,6]中具体,同时联合使用了螺内酯,加快了HypoPP患者的恢复。
本研究的另一优势在于流程中利用动脉血气PH值分析快速将HypoPP患者分为螺内酯可处理者和非螺内酯处理者,快速提升血钾防止出现心脏并发症而危及生命;即使在基层医院也具有很强的操作性,值得推广。本研究不足之处在于样本量少,需要继续收集病例。本研究无相关利益冲突。
综上所述,HypoPP是离子通道异常引起的以发作性瘫痪和血清钾减低为主要临床表现的一组疾病;螺内酯治疗非酸中毒HypoPP患者能促进血钾恢复正常、加快肌力恢复;加强血钾监测可规避高钾风险。
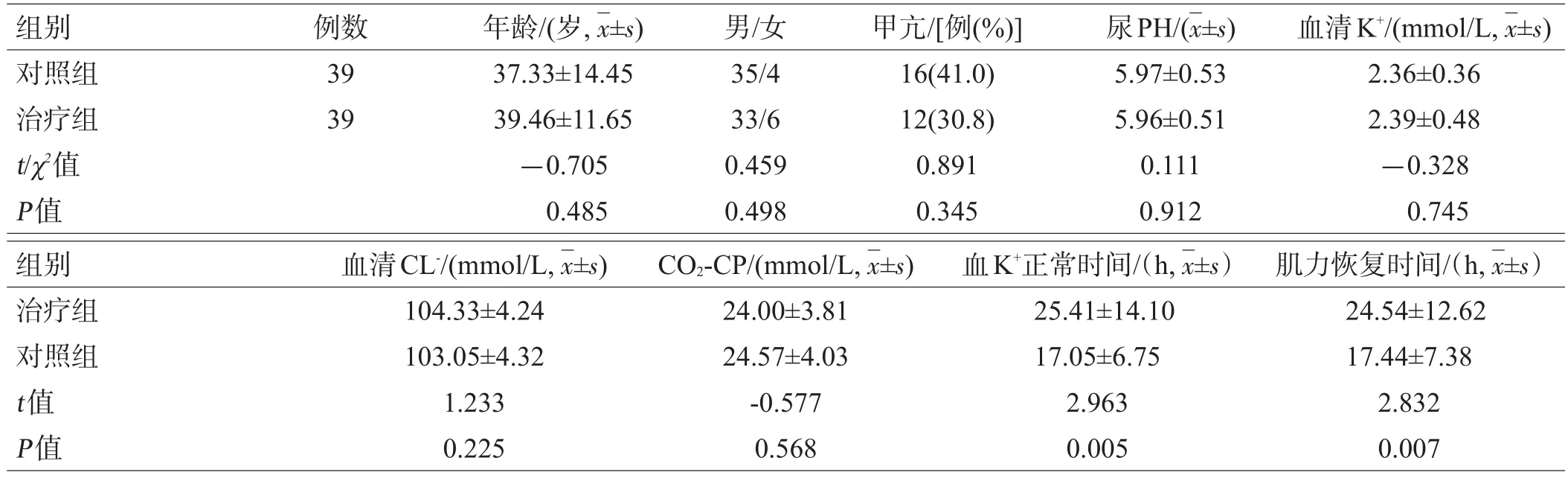
表1 2组各观察指标比较
