皮肤E2F6蛋白表达水平与糖尿病周围神经病变患者预后的相关性研究
2019-08-28杨敏慧刘爱群李金海向光红
杨敏慧,刘爱群,李金海,向光红
糖尿病周围神经病(diabetic peripheral neuropathy,DPN)是糖尿病(diabetes mellitus,DM)常见的并发症之一,主要表现为手套长袜样分布的肢端疼痛、麻木、无力等,晚期可致残[1]。慢性高血糖引起活性氧水平增高,导致机体处于氧化应激状态,损伤神经元和轴突,促进DPN发生[2]。E2F是转录因子,参与细胞周期控制、增殖分化和凋亡等。E2F6是E2F家族成员,可能与低氧诱导的细胞凋亡有关[3]。本研究通过检测皮肤的E2F6表达,探讨E2F6蛋白表达水平与DPN预后的相关性。
1 资料与方法
1.1 一般资料
选择2016年1月至2017年12月我科收治的2型DM患者160例,均符合WHO关于DM的诊断标准[4],根据有无周围神经病变将DM患者分为无病变DM组和DPN组。无病变DM组80例,男38例,女42例;年龄41~79岁,平均(55.34±8.56)岁;平均病程(8.97±2.21)年。DPN组80例,男37例,女43例,年龄42~80岁,平均(54.64±5.82)岁;平均病程(16.67±3.81)年。同期在本院就诊疑似小纤维神经病变后排除疾病的健康人80例纳入对照组,男40例,女40 例;年龄43~78岁,平均(56.01±7.71)岁。DPN组纳入标准:DM诊断明确;存在周围神经病变的临床和(或)电生理证据[4];缓慢进展型周围神经病变。排除标准:营养障碍、化学物质损害、药物中毒等所引起周围神经病变;慢性炎症性脱髓鞘性多发性周围神经病;结缔组织病;并发DM急重并发症;恶性肿瘤。各组年龄、性别等一般资料差异无统计学意义(P>0.05);DPN组的病程长于无病变DM组,差异有统计学意义(P<0.05)。
1.2 方法
1.2.1 血液指标 采集所有研究对象的清晨空腹血,采用全自动生化分析仪(西门子ADVIA 2400)检测空腹血糖(fasting blood sugar,FBS)、糖化血红蛋 白(glycated hemoglobin,GHb)、甘 油 三 酯(triglyceride,TG)、总胆固醇(total cholesterol,TC);采用化学发光法(DADE-AR全自动分析仪)检测胰岛素水平;采用二硫代硝基苯甲酸比色法检测谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px);采用黄嘌呤氧化酶法检测超氧化物歧化酶(superoxide dismutase,SOD);采用硫代巴比妥法检测丙二醛(maleic dialdehyde,MDA)。
1.2.2 皮肤E2F6蛋白定性和定量表达测定 常规皮肤消毒,切至真皮组织,取长约为0.5 cm,厚约0.2 cm的皮肤组织。采用免疫组化SP法检测皮肤组织的E2F6蛋白,羊抗人E2F6单克隆抗体(美国Santa Cruz公司),E2F6阳性染色为黄色或棕黄色,表达部位在细胞质和(或)细胞核。阳性细胞的染色强度按无色、浅黄色、黄色和棕黄色分别计为0、1、2、3分;阳性细胞数计分:无阳性细胞0分,1%~10%计1分,11%~50%计2分,51%~80%计3分,≥81%计4分;染色强度和阳性细胞数的乘积0~3分为阴性,≥4分为阳性。采用CMIAS真彩色病理图像分析系统进行形态学定量分析表达强度。
1.3 统计学处理
2 结果
2.1 各组生化指标情况
无病变DM组及DPN组的FBS、GHb、空腹胰岛素、TG和TC水平均明显高于对照组(均P<0.05)。DPN组的GHb、空腹胰岛素、TG、TC水平均高于对照组(均P<0.05),无病变DM组及DPN组FBS差异无统计学意义(P>0.05),见表1。
表1 各组的生化指标比较(±s)

表1 各组的生化指标比较(±s)
注:与对照组比较,①P<0.05;与无病变DM组比较,②P<0.05
组别对照组无病变DM组DPN组例数80 80 80 FBS/(mmol/L)4.31±1.22 11.66±3.39①12.89±4.51①GHb/%4.28±0.54 9.79±2.31①13.84±3.35①②组别对照组无病变DM组DPN组TC/(mmol/L)4.34±1.33 6.38±1.28①7.85±1.60①②空腹胰岛素/(mIU/L)8.89±2.75 12.96±3.11①15.97±3.41①②TG/(mmol/L)1.28±0.32 3.79±1.19①4.95±1.74①②
2.2 各组氧化应激指标及皮肤E2F6蛋白表达比较
与对照组比,无病变DM组、DPN组的SOD、GSH-PX和E2F6蛋白水平较低,MDA水平较高(P<0.05);与无病变DM组比,DPN组的SOD、GSH-PX和E2F6蛋白水平较低,MDA水平较高(P<0.05),见表2、图1。
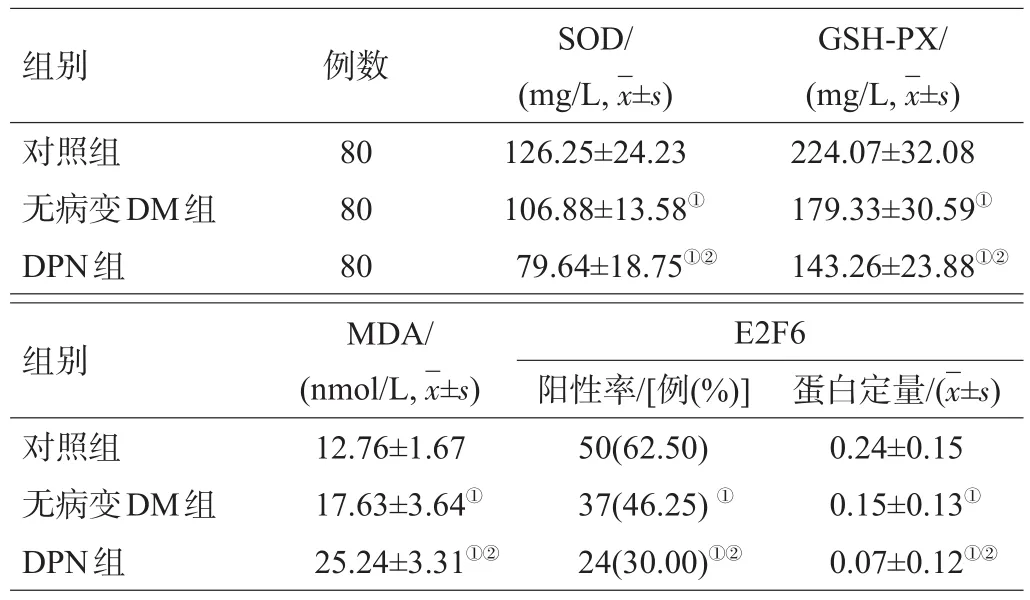
表2 各组氧化应激指标及E2F6蛋白比较
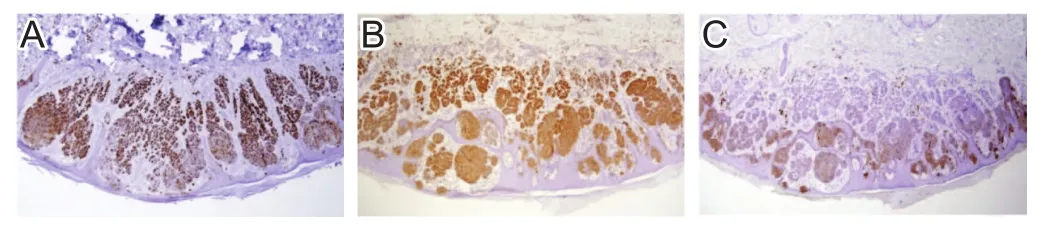
图1 各组皮肤的E2F6蛋白比较
3 讨论
由于长期未控制高血糖,引发微循环改变、神经营养因子缺乏、自身免疫异常和过量氧化自由基产生等因素而导致DPN[5]。DM患者产生大量的活性氧簇,激活应激反应元件细胞凋亡通路,并抑制细胞色素氧化酶,影响葡萄糖代谢[6]。研究表明[7],醛糖还原酶抑制剂可减轻氧化应激,改善DPN。
核转录因子E2Fs家族可调控细胞有丝分裂,并结合一系列下游基因启动子,与细胞增殖分化、凋亡等重要生命活动有关[8]。E2F6是E2Fs家族的一员,其可抑制DNA损伤诱导的细胞凋亡作用。相关研究显示,缺氧条件下,E2F6 mRNA和/或蛋白表达降低[9]。但E2F6在DPN的表达尚未见报道。在本研究中,对照组、无病变DM组、DPN组皮肤的E2F6阳性率分别为62.50%、46.25%和30.00%,呈递减趋势,提示E2F6表达下调使下游基因受到影响,引起细胞周期调控异常。在本研究中,与对照组比,DM患者外周血的SOD和GSH-PX水平较低,MDA水平较高;与无病变DM组比,DPN组外周血SOD和GSH-PX水平较低,MDA水平较高,提示DPN患者的机体氧化应激反应增强。DM患者的氧化应激反应增强,E2F6蛋白水平降低,引起微循环障碍,造成神经营养失调,从而导致DM神经损伤,继而出现典型神经病变症状[10]。因此,皮肤组织的E2F6和外周血的SOD、GSH-PX和MDA水平有助于判断DPN患者的病情。但皮肤组织E2F6蛋白检测具有侵入性,较难推广,关于皮肤组织E2F6蛋白与DPN的机制仍需进一步研究。
