一氧化碳还原氧化铁实验的一体化设计
2019-08-27裴锐张灵丽
裴锐 张灵丽

摘要: 在分析一氧化碳还原氧化铁反应原理的基础上,针对实验过程中存在的问题,将一氧化碳的制备、一氧化碳与氧化铁的反应、产物的检验和尾气的处理进行一体化设计,使多个反应置于同一个封闭体系中进行;同时改进热源装置,优化生成物——铁的检验方法,利用万用瓶并设置安全线排除爆炸风险等,大大提高了实验的成功率和安全性。
关键词: 一氧化碳还原氧化铁; 实验一体化设计; 实验改进 文章编号: 1005-6629(2019)6-0070-04 中图分类号: G633.8 文献标识码: B
1 问题提出
一氧化碳与氧化铁的反应在九年级化学教学中具有十分重要的地位,现行人教版、沪教版、湘教版、粤教版、鲁教版等不同版本的教材中,都安排了一氧化碳还原氧化铁的演示实验并将其定性为教学重点。一氧化碳还原氧化铁作为九年级化学中唯一的一个固体和气体在高温条件下反应的演示实验,既是理解工业上高炉炼铁原理的基础性实验,也是体现化学原理对实际生产指导作用的重要例证[1]。重视该实验并确保实验成功,是充分发挥其教学功能和价值的重要前提。然而,从课堂教学现状看,关于一氧化碳还原氧化铁的实验教学采用观看视频或动画模拟代替演示实验的现象普遍存在,甚至画实验、讲实验的情况也时有发生,究其原因,主要与以下几个方面因素有关。
1.1 气体制备与储存
实验用一氧化碳需要提前制备和安全储存,不仅费时费事,而且对气体的储存装置要求较高。一方面,因为许多学校没有符合条件的储气装置,为了做一氧化碳还原氧化铁的实验,需要对装置进行改进或者自制装置;另一方面,不少教师考虑到一氧化碳有毒且容易爆炸,制备和储存过程中存在一定的安全隐患,如有不慎,则可能造成较为严重的安全事故,因而产生畏惧心理。
1.2 高温条件及热源
一氧化碳还原氧化铁的反应需要高温,反应温度在600℃以上[2],普通酒精灯的温度达不到实验要求,必须使用酒精喷灯。但酒精喷灯使用很不方便,不仅需要提前在托盘上倒酒精,明火预热引燃,耗时较多,而且在实际使用过程中,酒精喷灯还极易损坏,经常是上一个班级用得好好的,到了下一个班级却点不着火了,从而导致实验无法正常演示。
1.3 通气时间与尾气处理
首先,实验加热前必须要先通一氧化碳排尽装置内空气,而一氧化碳是无色气体,所以不知道何时装置内空气被排尽,因此,为了安全起见,实验过程中经常要多通一会儿一氧化碳,这样既加大了药品的用量[3, 4],也会花费较长时间。其次,实验过程中对含有一氧化碳的尾气处理也十分令人纠结,由于进行该实验时,常用点燃的方式来处理尾气,但是何时点燃,却很难有效把控,点早了,存在爆炸的危险,点迟了,又会造成空气污染。
1.4 生成物的检验
一氧化碳还原氧化铁的生成物分别是二氧化碳和铁,用澄清石灰水检验二氧化碳,方法简单,现象明显,但另一生成物——铁的检验则相对要复杂一些。如果检验反应后的黑色粉末既能被磁铁吸引,又能通过黑色粉末与稀盐酸反应,观察到有气体生成,则将使铁的检验具有更强的说服力。但由于还原生成的铁温度较高,如果等冷却后再取出来与稀盐酸反应,会耗费较多的时间,但如果为了节约时间,没有充分冷却就将铁取出,很容易在空气中被氧化,导致其与稀盐酸反应的现象不明显,影响实验效果。
为了解决以上演示实验时遇到的实际问题,笔者对该实验进行了大胆的改进,设计了一套集一氧化碳制备、一氧化碳与氧化铁反应、产物检验和尾气处理于一体的装置,将多个反应置于同一个封闭体系中进行;同时,改进热源装置,优化生成物——铁的检验方法,利用万用瓶并设置安全线排除爆炸风险。该装置在实际应用中取得了令人满意的效果,现将该一体化的实验设计介绍如下。
2 实验改进
2.1 实验装置
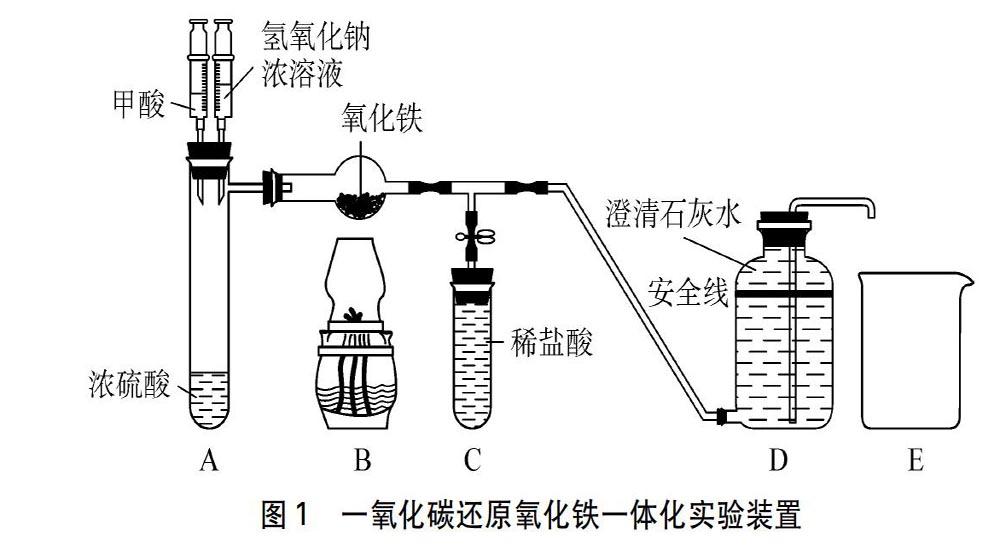
如图1所示,实验所用仪器及药品分别如下: 注射器2支、具支试管1支、石英球形干燥管一个、自制简易高温酒精灯一个、定制万用瓶一个、500mL烧杯一个、小烧杯一个、配套的双孔橡皮塞、单孔橡皮塞、磁铁、三通管一个、止水夹一个、乳胶管若干等;甲酸、氢氧化钠浓溶液、浓硫酸、氧化铁粉末、稀盐酸、澄清石灰水、80℃热水
2.2 实验操作
(1) 检查装置气密性: 按照图1所示连接装置,在D处的万用瓶中装满水,然后推A处的任意一支空注射器,若观察到万用瓶里有水排出,则说明装置不漏气。
(2) 装入药品: 在石英球形干燥管的球內平铺一药匙氧化铁,C处试管中装入稀盐酸,D处万用瓶中装满澄清石灰水,分别取5mL浓硫酸于A处具支试管中,2mL甲酸和6mL氢氧化钠浓溶液于两支注射器中。
(3) 进行反应: 用小烧杯盛80℃热水,给A处具支试管内的浓硫酸水浴加热,然后轻轻推动注射器,将甲酸逐滴加入浓硫酸中。当万用瓶里澄清石灰水的液面下降到安全刻度线处,点燃简易高温酒精灯(自制),加热氧化铁。先均匀预热石英球形干燥管,再移置药品处集中加热。当红棕色粉末全部变黑后,再继续加热2~3分钟,熄灭高温酒精灯,此时由于A处一氧化碳仍在源源不断地产生,所以C、 D处液体不会出现倒吸现象。稍冷却后打开C处的止水夹,用磁铁将黑色粉末吸引迁移到盛有稀盐酸的试管里,黑色粉末和稀盐酸反应,多余的尾气收集在万用瓶中。
(4) 后续处理: 实验结束时,可直接打开万用瓶的瓶塞,将收集在万用瓶里的尾气点燃。然后向盛有浓硫酸的具支试管里注入氢氧化钠浓溶液,中和剩余的酸。再拆开实验装置,清洗并整理实验用品。
2.3 注意事项
(1) 因甲酸有较强的腐蚀性,用注射器抽取甲酸的时候,要带橡胶手套,防止皮肤与甲酸的接触。
(2) 定制万用瓶的体积要尽量大一点,保证多余的一氧化碳能完全被收集起来。
(3) 当红棕色粉末变黑时,不能马上停止加热,要继续通入一氧化碳2~3分钟,防止反应只生成四氧化三铁,导致反应后固体在被磁铁吸引进入到稀盐酸中观察不到气泡的产生,检验不出铁的生成。
3 优点分析
3.1 无需提前制备和储存一氧化碳
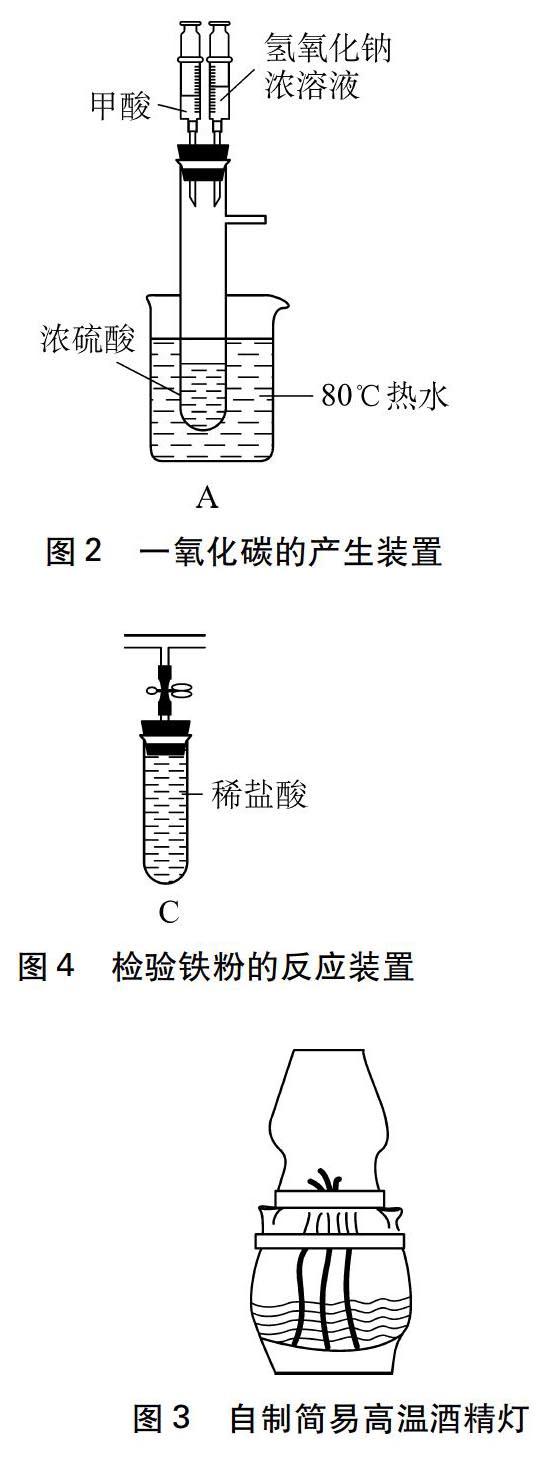
根据浓硫酸和甲酸的反应原理: CH2O2浓硫酸H2O+CO↑,将浓硫酸盛放在A处具支试管里,甲酸盛放在注射器里。浓硫酸的沸点是338℃,远远高于甲酸的沸点100.5℃。用小烧杯盛80℃热水,给具支试管内的浓硫酸水浴加热(见图2),然后逐滴加入甲酸,就会产生大量一氧化碳。甲酸和浓硫酸的体积比为1∶5为宜,注射器分别盛2mL甲酸和6mL浓氢氧化钠溶液,具支试管里盛有5mL质量分数为98%的浓硫酸。所以本实验不需要提前制备和储存一氧化碳,可以随时到教室演示实验,既无需为存储装置犯愁,又节省了大量的准备时间。
3.2 为满足反应条件提供热源保障
根据CO和Fe2O3的反应需要高温,且Fe2O3是分步还原的,有关反应的化学方程式如下: 3Fe2O3+CO400~500℃2Fe3O4+CO2, Fe3O4+CO500~600℃3FeO+CO2, FeO+CO600℃以上Fe+CO2[5],为了保证反应后的黑色固体是铁,而不是四氧化三铁或氧化亚铁,所以要使用酒精喷灯,但是酒精喷灯使用不方便,而且极易损坏,所以笔者受酒精喷灯燃烧能产生高温的原理启发,制作了简易高温酒精灯,用三根灯芯同时燃烧,再利用灯罩拉风加快空气流动速度,使单位时间内酒精的燃烧量加大,释放的热量增多,从而产生较高温度,实现了维持高温的目的。笔者用温度传感器多次检测发现: 简易高温酒精灯的温度可恒定在900℃以上,较好地满足了一氧化碳还原氧化铁600℃以上的高温条件。同时,相比酒精喷灯使用更加方便,不需要在灯体外面倒酒精引燃,直接点燃就可以,熄灭时,只需取下灯罩直接用烧杯罩灭即可,而且耐用性远远高于酒精喷灯。
自制簡易高温酒精灯(见图3)是用玻璃瓶作为灯体,在玻璃瓶的铁皮盖子上钻三个小孔,用铝管(取自英雄钢笔的笔管套)包裹的三根棉灯芯穿过小孔制成灯头,铁皮盖子上配置定制的三脚罩座和耐高温的石英玻璃灯罩。
3.3 产物铁的检验快捷可靠
待球形干燥管里粉末完全变黑再稍冷却后,打开止水夹,将磁铁贴在玻璃管外壁上移动游走,将热的黑色粉末吸入到C处试管里和稀盐酸接触反应(见图4)。当观察到试管里有气泡产生,溶液变成浅绿色,证明黑色粉末是铁粉。该操作巧妙利用磁铁的磁性,磁铁在玻璃管、试管外壁移动,可以将球形干燥管内温热的铁粉带着一起迁移,让温热的铁粉和稀盐酸接触反应。一方面加快了反应速率,现象明显,节约了课堂宝贵的时间,另一方面温热的铁粉在封闭的无氧环境下与稀盐酸接触,可防止生成的铁以及氯化亚铁被氧化。
3.4 定制万用瓶的功能
定制万用瓶如图5。
功能1: 根据加热石英球形干燥管前后澄清石灰水的变化,可以检验二氧化碳,证明反应的发生;功能2: 密闭体系,把反应过程产生的气体全部收集起来,防止了一氧化碳的散逸,又可避免一开始用酒精灯点燃尾气容易爆炸的危险;功能3: 设置安全线,可准确估算加热氧化铁的时间,巧妙地解决何时加热的困惑,既安全,又直观(安全刻度线设置的方法是: 根据一氧化碳的爆炸极限,将具支试管、石英球形干燥管、橡皮管、乳胶管装满水,测量它们盛放水的总体积记为V1,安全线就是3V1的位置,见图5);功能4: 处理尾气,方便安全。
由于尾气从下端通入,打开橡皮塞点燃一氧化碳时,火苗不会回火到前面的装置里。实验结束点燃尾气时,可以清楚地看到一氧化碳在瓶内安静燃烧,产生漂亮的蓝色火焰。
总之,本套一体化实验装置,不仅减少了课前准备负担,更主要的是提高了一氧化碳还原氧化铁实验的安全性和成功率,为该实验在课堂教学的有效落实提供了保障。
参考文献:
[1]中学化学国家课程标准研制组. 义务教育课程标准实验教科书·化学(九年级上册)[M]. 上海: 上海教育出版社, 2011: 124.
[2][5]刘怀乐. 一氧化碳还原氧化铁的实证探索与教学思考[J]. 化学教学, 2007, (11): 13~16.
[3]魏海, 周良, 李德前. 一氧化碳还原氧化铁实验装置新设计[J]. 化学教学, 2017, (9): 53~56.
[4]王宝权. 一氧化碳与氧化铁的反应实验的再改进[J]. 实验教学与仪器, 2014, (7): 27~28.
