基于光谱法和计算模拟研究PFBSK与HSA的相互作用
2019-08-27魏雨晨易忠胜王海洋
魏雨晨, 易忠胜, 徐 婕, 赵 赛, 王海洋
(桂林理工大学 化学与生物工程学院,广西 桂林 541006)
0 引 言
人血清白蛋白(human serum albumin, HSA)是人体血液中含量最为丰富的载体蛋白质,约占人血浆总蛋白含量的60%[1-2]。由于HSA具有多个结合位点,使得HSA能够结合许多的内源性、外源性物质及不同大小分子的化合物,也能与难溶于水和易溶于水的物质相结合,具有十分重要的生理意义[3]。HSA在人体血浆中起着重要的储存和运输作用,配体小分子进入人体内,经蛋白质转运到达靶器官,发挥其生物学效应[4]。与人体其他的蛋白质分子相比,HSA稳定性好,溶解性也较好,与配体小分子具有良好的亲和性[5-6]。由于HSA大分子具有无毒性、再生性、良好的生物相容性和生物可降解性等特点[7],人血清白蛋白作为一种广泛使用的模型蛋白被应用于各种生物化学、生命物理和药物学等生命科学的研究中[8-10]。
全氟化合物(perfluorinated compounds, PFCs)是进入20世纪以来一类含有高能量C—F键的新型的环境污染物,逐渐引起科研工作者的关注[11]。由于PFCs的C—F键的键能比C—H键的键能大,从而使PFCs分子在环境中具有持久性,在经受强热、光照、化学作用、微生物作用以及高等脊椎动物的代谢作用时依然很难被降解[12]。这类污染物在一定的剂量下会使生物体出现体重降低、线粒体受损、肝组织增重、基因诱导等不良生物学效应[13],且具有全球普遍存在的特点,甚至于存在于人体的血液之中[14]。因此,开展PFCs小分子与HSA生物大分子的相互作用研究,阐明污染物小分子在人体内的运输、吸收、代谢以及毒性机理有着重大的意义,也能为环境科学、化学、毒理学以及生命科学等领域提出可靠的理论依据和分析手法。
全氟化合物主要分为全氟羧酸类(perfluoroalkyl sulfonates, PFAS)和全氟磺酸类(perfluoroocatanoatc, PFCA)[15]。 全氟羧酸类化合物具有不易分解性和高沉积性, 容易随着食物链进行传递,并在生物体内富集和放大, 其所造成的环境污染遍及全球的生态系统[16-18]。 也有研究表明,在许多的动物组织和人体中发现了PFCA[19-20], PFCA已经成为了一类备受关注的环境污染物。 本文以全氟磺酸类化合物中的全氟丁基磺酸钾(PFBSK, 结构式如图1)为例, 从计算模拟和实验分析两方面探究PFBSK与HSA相互作用的机制。

图1 PFBSK的结构式Fig.1 Structure of PFBSK
1 实验部分
1.1 实验仪器及试剂
仪器: RF-5301PC荧光光度计(日本岛津公司); PHS-3CS精密pH计(上海雷磁仪器厂); EL204电子分析天平(上海梅特勒托利多仪器有限公司)。
试剂:三羟甲基氨基甲烷盐酸缓冲溶液(Tris-HCl, pH=7.4); HSA(purity>97%, 美国Sigma公司)用Tris-HCl 缓冲溶液配制成浓度为1.0×10-5mol·L-1储备液; 全氟丁基磺酸钾(购于瑞士AD公司)用Tris-HCl缓冲溶液配制成浓度为1.0×10-3mol·L-1储备液,摇匀, 放置于4 ℃的冰箱中,备用。除非有其他说明,否则所用试剂均为分析纯,实验用水均为二次蒸馏水。
本文所有的计算工作均通过DELL服务器上RedHat Linux 6.4系统完成。通过Sybyl X1.1软件和 GROMACS 4.6.5软件分别进行分子对接与分子动力学模拟,用LigPlus软件进行分子图形展示和结果分析。HSA晶体结构从Brookhaven蛋白质数据库(http://www.rcsb.org/pdb)获得(代码为1n5u,结构相对完整)。
1.2 实验方法
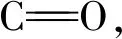
分子动力学模拟(MD):运用GROMOS96 43a1力场和周期性边界条件,采用三点型的水模型SPC并对HSA体系和PFBSK-HSA体系建立水盒子,添加离子和溶剂使体系平衡。通过最陡下降法进行最大步数10 000步的能量最小化,随后采用正则系统(NVT)和等温等压系统(NPT)平衡体系进行50 ns的MD模拟。
光谱法:将1 mL 1.0×10-5mol·L-1HSA溶液加入10 mL的比色管中, 然后用pH=7.4 Tris-HCl缓冲溶液定容至刻度线,摇匀。 之后依次加入一定量浓度为1.0×10-6mol·L-1PFBSK溶液。 在恒温下反应8 min后,于λex=280 nm处进行扫描,激发光栅和发射光栅的狭缝宽度分别为3.0/5.0 nm,测定体系荧光光谱。同时,检测Δλ=15 及60 nm时的同步荧光光谱。
2 结果讨论
2.1 分子对接分析
分子对接可以直观明显地观察出小分子与HSA的结合情况和作用力类型。 HSA由585个氨基酸残基组成, 主要有2个结合药物的位点, 位点Ⅰ和位点Ⅱ(也被称为华法林位点与布洛芬位点)[3], 大部分药物小分子都是结合在这两个位点上。 通过运用Sybyl X1.1软件中的Surflex Dock模块对PFBSK与HSA进行分子对接分析。 对接的方式采用盲接,探针可自动探测结合位点。 Total-Score为Surflex Dock得分, 表达为亲和力-logKd,该函数包含对极性作用、疏水作用、静电作用和氢键作用等综合因素的考虑,数值越大,表示形成的复合物越稳定[23]。
模拟结果显示位点Ⅱ的Total-Score函数得分较高(Site Ⅰ:3.564 1, Site Ⅱ:4.492 2),说明在位点Ⅱ对接形成的复合物更加稳定。图2a表示PFBSK在1n5u位点II处的分子对接图。图2b显示PFBSK与HSA结合后PFBSK周围5Å(0.5 nm)范围内的氨基酸残基,PFBSK与ARG485、SER342和ARG348之间形成了6个氢键,从而大大提高了复合物的稳定性。图2c为活性位点在3Å(0.3 nm)范围内疏水作用的氨基酸二维图,参与疏水作用的氨基酸有VAL344、ALA449和ILE388等,且分布在氟原子周围,说明PFBSK中氟原子有很强的极性。由于PFBSK的分子体积不大,能够较容易进入到HSA的疏水腔中。图2d为PFBSK在HSA空腔内的静电引力作用图,可见PFBSK进入HSA位点Ⅱ的疏水空腔中并与HSA残基间形成了较强的静电力。-logKd反映的是受体与配体之间的亲和力, 分子对接的结果显示该值较大,表明PFBSK与HSA之间形成的复合物具有良好的稳定性。
2.2 分子动力学模拟
分子动力学模拟可以研究复合物在水溶液中的稳定性和动力学特征。本文对游离的HSA与HSA-PFBSK形成的复合物进行50 ns动力学模拟。均方根偏差(RMSD)常用于表述构象偏差的统计值,是衡量系统稳定性的重要参数[24]。图3a为模拟时间为50 ns的PFBSK-HSA复合物与游离HSA的均方根偏差变化情况, 可以看出在约13 ns后复合物体系和HSA体系趋于稳定。 对比游离HSA,PFBSK与HSA形成的复合物在整个模拟过程RMSD平均值较小,因此可以说明PFBSK与HSA形成的复合物更加稳定。均方根波动(RMSF)可用于描述两个体系氨基酸残基柔性的变化情况。图3b为 PFBSK-HSA复合体系与游离HSA体系的均方根波动的变化趋势,可以看出360~500号位置残基发生异常波动,这表明PFBSK的结合位置位于HSA这些位置的残基处,所得结果与分子对接相吻合。回转半径(Rg)可用来衡量蛋白质结构的紧凑程度。 从50 ns的回转半径的变化情况(图3c)中可以看出每个系统的Rg值在10 ns后达到相对稳定,表示动力学模拟在10 ns后很快达到平衡。而PFBSK-HSA复合体系的Rg值低于HSA体系,这表明PFBSK的加入使HSA结构缩小,导致其空腔变小,进而引起其二级结构发生变化[25]。
2.3 结合自由能分析
结合自由能分析可以有效地预测生物大分子的结构和功能,利用MM-PBSA程序计算PFBSK-HAS体系在生理条件下的结合自由能(ΔGbind)。 本文忽略熵变对ΔGbind的影响,通过提取PFBSK-HSA复合物在MD模拟平衡(45 ~50 ns)的构象轨迹求平均值并计算得到各个能量,结果如图4a所示, 总体的结合自由能ΔGbind为负值, 且范德华作用力EvdW、 静电能Eelec、 非极性溶剂化能ΔGnp也均为负值, 充分表明真空中的静电能、 范德华作用能、 非极性溶剂化能都有利于PFBSK和HSA的结合。 由于静电溶剂化能ΔGpb对静电作用能Eelec的抑制作用使得总体的静电作用不利于小分子和蛋白质的结合。范德华作用能在PFBSK和HSA的结合过程中贡献很大,此时范德华作用力是结合的主要动力。
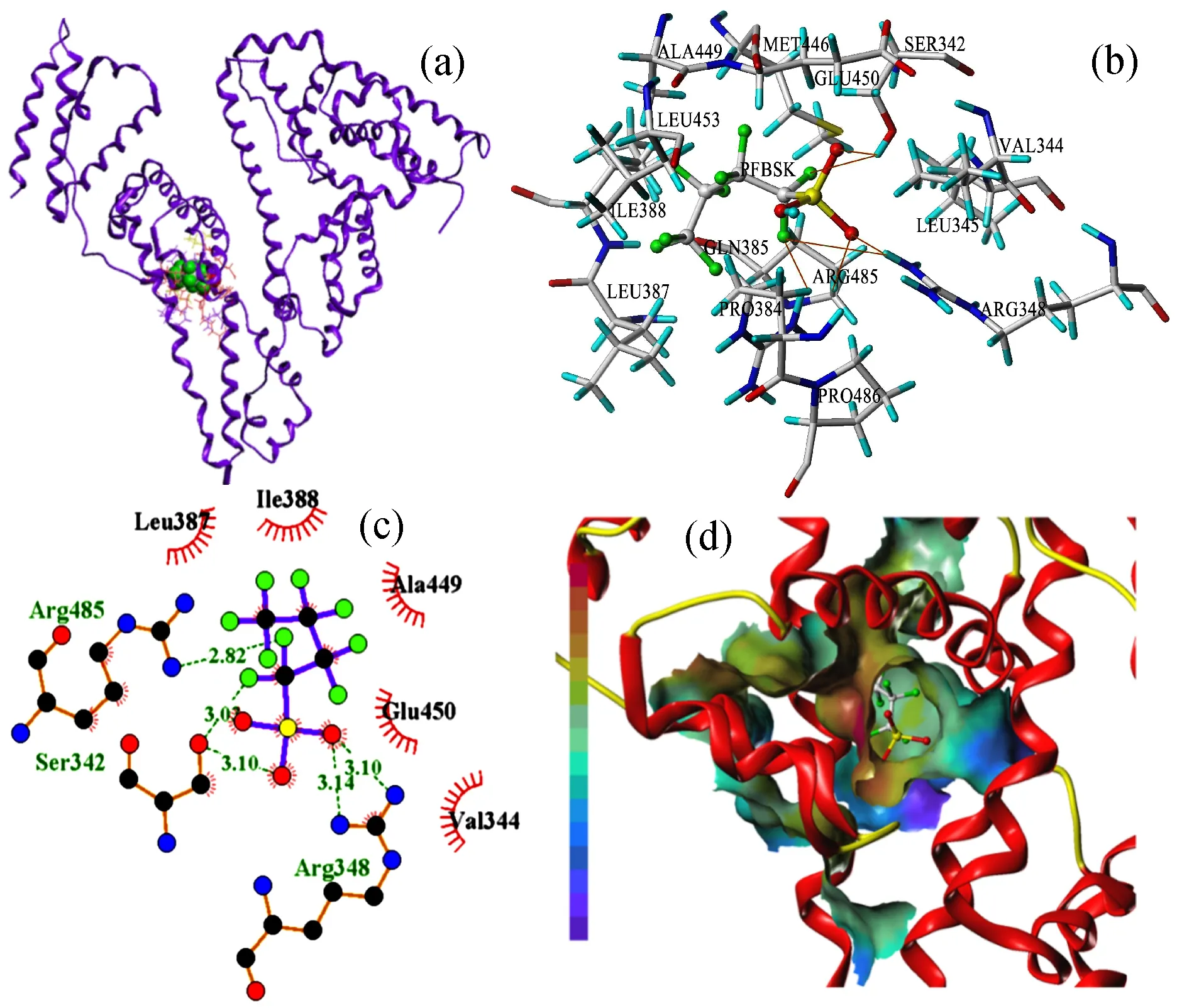
图2 PFBSK在HSA位点II的分子对接图Fig.2 Molecular docking and detailed view of the interactions of PFBSK and HSA

图3 PFBSK与HSA的分子动力学模拟Fig.3 Molecular dynamics of PFBSK and HSA
对每个氨基酸残基在结合过程中对结合自由能的贡献进行分析如图4b所示。其中ARG348、ARG484、ARG485、ALA449等对两者的结合有显著的贡献。结合分子对接分析,残基ALA449表现的疏水作用使其对结合自由能的贡献较大;而残基ARG348和ARG485形成的氢键也是对结合自由能的贡献较大的原因之一。
2.4 PFBSK-HSA的同步荧光光谱
同步荧光具有灵敏度高和选择性好的优点,由于氨基酸残基的最大荧光波长与其所处周围环境的极性和疏水性有关,所以可以用其来探讨蛋白质的二级结构变化及部分氨基酸的光谱特征。荧光光谱的激发和发射波长差值Δλ=15和60 nm分别为酪氨酸和色氨酸残基的光谱特征。
图5为PFBSK和HSA相互作用的同步荧光光谱图, 随着PFBSK浓度的逐渐增加, 蛋白质的酪氨酸残基和色氨酸残基的荧光强度不断下降, 说明PFBSK对HSA的荧光发生了一定程度的淬灭作用。 色氨酸残基(Δλ=60 nm)荧光峰的最大发射波长位置随PFBSK浓度的增加发生了微弱的蓝移(图5b, 蓝移1 nm), 而酪氨酸残基(Δλ=15 nm)荧光峰的最大发射波长始终保持在309 nm处(图5a),说明虽然PFBSK结合在HSA位点II的空腔, 但是并没有对酪氨酸产生太大影响, 而是对色氨酸附近的微环境产生了较大的影响, 它破坏了色氨酸残基附近的微环境, 增加了疏水性, 进而影响了HSA的构象, 所得结果与动力学模拟结果相吻合。
2.5 PFBSK-HSA的荧光淬灭机理
荧光光谱是一种检测蛋白质结构变化和推断其与小分子结合的有效手段。 当小分子与蛋白质结合的时候, 色氨酸的荧光强度会发生明显的变化,HSA的位点Ⅰ中只存在一个色氨酸, 是HSA内源性荧光的主要来源。

图5 PFBSK-HSA的同步荧光光谱Fig.5 Synchronous fluorescence spectra of PFBSK-HSA

图4 PFBSK-HSA之间的结合自由能(a)与单个氨基酸残基对结合自由能贡献值(b)Fig.4 Binding free energies of PFBSK-HSA complex(a)and binding free energy contribution of each residue in the complex(b)
图6是298 K下PFBSK和HSA的荧光淬灭图。 HSA的荧光强度出现了明显的蓝移现象, 说明PFBSK在进入HSA的疏水腔时, 引起构象变化导致HSA的荧光发生淬灭。
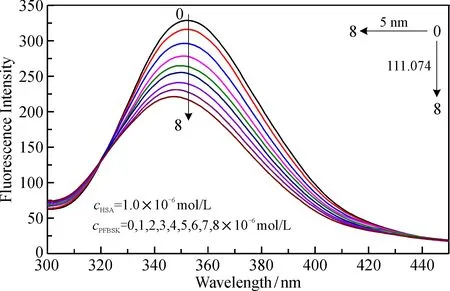
图6 PFBSK-HSA的荧光淬灭图Fig.6 Fluorescence quench titration of HSA with increasing PFBSK concentrations
PFBSK和HSA的淬灭遵循Stern-Volmer方程[26-27]:
F0/F=1+Ksv[Q]=1+Kqτ[Q];
(1)
log((F0-F)/F)=logKa+nlog[Q],
(2)
其中,F0和F分别为PFBSK加入前、后的荧光强度;Q是PFBSK的浓度;Kq是HSA的淬灭速率常数; 而Ksv是Stern-Volmer的淬灭常数;τ表示没有淬灭剂存在下荧光分子平均寿命, 生物大分子的荧光的荧光寿命约为10-8s;Ka是蛋白质和淬灭剂的结合常数。
蛋白质的荧光淬灭机制主要分为动态淬灭(分子间的碰撞)、 静态淬灭(淬灭剂和蛋白质形成复合物)和非辐射能量转移等几种机制,分别在温度为291、298和310 K时加入PFBSK,HSA-PFBSK体系的荧光强度的变化如图7a所示。可见,随着温度升高,Ksv减小,Kq大于各类淬灭剂对蛋白质大分子的最大分散碰撞常数(2×1010L·mol-1·s-1),淬灭剂与具有荧光物质的HSA在基态时发生了配合反应,PFBSK进入了HSA的空腔,蛋白质原有的微环境和二级结构产生了变化,从而导致的静态淬灭。
用修正的Stern-Volmer方程(式(2))可以得到不同温度下PFBSK浓度对HSA-PFBSK体系荧光强度的双对数曲线,由该直线的斜率和截距可求出PFBSK与HSA结合位点数n及表观结合常数Ka(图7b)。
由表1可知,PFBSK浓度对HSA-PFBSK体系荧光强度的双对数曲线在不同温度下都具有良好的线性关系。它们相互作用的结合常数在105L·mol-1数量级以上,结合较稳定。结合位点数n约等于1,说明在PFBSK与HSA作用时只存在1个结合位点。这与分子对接和动力学模拟结果都存在高度的一致性。
2.6 PFBSK与HSA能量转移的研究
Förster偶极-偶极非辐射能量转移理论常被用于研究大分子体系中两个发光基团间的距离。理论方程[28-29]可计算能量供给体和受体间的结合信息

图7 PFBSK浓度与F0/F及lg((F0-F)/F)的关系Fig.7 Q-F0/F and lg Q-lg((F0-F)/F) diagrams

表1 PFBSK与HSA体系在不同温度下的表观结合常数Ka、荧光淬灭常数Ksv及结合位点n
(3)
(4)
J=(∑F(λ)ε(λ)λ4Δλ)/(∑F(λ)Δλ),
(5)
式中:E为PFBSK与HSA二者间的能量转移效率;R0为能量转移距离;K2=2/3;N为介质的折射常数(取水和有机物的平均值1.336);Φ为荧光量子产率(0.15);J为荧光发射光谱与受体吸收光谱的重叠积分。
图8是PFBSK的紫外吸收光谱和HSA的荧光发射光谱的重叠图,根据Förster偶极-偶极非辐射能量转移机理通过式(3)~(5)计算得出给体与受体间能量转移的效率E、重叠积分J和结合距离r。由表2依据式(3)~(5)求出的给体与受体之间的距离r值等于3.71 nm(小于7 nm), 且0.5R 图8 PFBSK紫外吸收光谱与HSA荧光光谱的重叠图Fig.8 Overlap of fluorescence spectrum of HSA and absorbance spectrum of PFBSK J/(cm3·L·mol-1)ER/nmr/nm2.11×10-140.01822.883.71 小分子与生物大分子之间结合的相互作用力包括静电引力、氢键、范德华力和疏水作用力等。通过热力学方程[30] lnK2/K1=ΔH(1/T1-1/T2)/R; (6) ΔG=-RTlnK; (7) ΔS=-(ΔG-ΔH)/T, (8) 可计算反应的焓变(ΔH)、熵变(ΔS)和吉布斯自由能变化(ΔG), 并由此判断小分子和生物大分子之间的主要作用力类型。 其中,K为结合常数,R=8.314 51 J·mol-1·K-1。 根据热力学参数可以判断作用力的类型,当ΔG<0时表示反应可以自发进行,若ΔH>0,ΔS>0时,主要表现为疏水作用力;若ΔH<0,ΔS<0时,则是氢键和范德华力起主要作用;若ΔH<0,ΔS>0时,则静电作用处于主导地位。计算不同温度下(T=291、 298、 310 K),PFBSK与HSA相互作用时的体系热力学参数,如表3所示。 表3 不同温度下PFBSK与HSA相互作用的热力学常数 当温度变化不大时,可认为焓变ΔH是一个常数。该体系ΔG<0,ΔH<0,ΔS<0,说明PFBSK与HSA的相互作用的主要类型为氢键和范德华作用力,这与分子对接和结合自由能分析所得的结论相一致。 本文通过分子对接和动力学模拟从分子水平上对PFBSK与HSA的相互作用进行计算模拟和理论推测。分子对接结果和关键氨基酸残基分析表明PFBSK与HSA主要结合在位点Ⅱ处,其相互作用力主要体现为氢键和范德华作用力并伴有疏水作用力与静电引力。分子动力学模拟各种参数的结果显示:PFBSK与HSA之间形成的复合物比游离的HSA具有更好的稳定性,同时PFBSK与HSA的结合使得HSA原本的微环境发生变化,从而导致HSA的二级结构发生变化,所得的结果与分子对接相吻合。结合自由能分析中贡献较大的是范德华作用力和疏水作用力。实验和模拟结果表明HSA与PFBSK结合是由疏水作用力、静电引力并伴随着氢键和范德华力共同作用的结果。荧光光谱法得出PFBSK导致HSA的荧光淬灭机制为静态淬灭并发生非辐射能量转移;通过对热力学参数的计算,焓变和熵变均为负值,说明PFBSK与HSA之间的主要作用力为氢键和范德华作用力;同步荧光和能量转移实验表明PFBSK与HSA的相互作用使HSA的构象发生改变,实验结果与分子对接和动力学模拟所得的结论高度一致,为今后探究全氟磺酸类化合物与HSA的研究提供了可靠的参考信息与分析手法。

2.7 PFBSK与HSA作用力类型的确定

3 结 论
