玉米中黄曲霉毒素B1测定的不确定度评定
2019-08-27王春艳聂绪恒袁毅蒋雁向西
王春艳,聂绪恒,袁毅,蒋雁,向西
(1.贵州省粮油产品质量监督检验站,贵州 贵阳 550003;2.云南省粮油科学研究院,云南 昆明 650000)
黄曲霉毒素可以由黄曲霉、寄生曲霉、集峰曲霉和伪溜曲霉4 种曲霉菌产生,是一组化学结构类似的二呋喃香豆素的衍生化合物[1]。黄曲霉毒素B1是已知的最强致癌物之一[2-3],对人和动物具有极强的致癌、致畸、致突变作用,并且对肝脏的急性毒性也很高[2-7]。粮食在种植、收获、储存、运输过程中如保存不当极易受潮霉变而污染黄曲霉毒素[8]。中华人民共和国国家标准GB 2761-2017《食品安全国家标准食品中真菌毒素限量》[9]对食品中真菌毒素已明确限量规定。
不确定度是表征合理地赋予被测量值的分散性,与测量结果相联系的参数[10]。一个完整的定量分析结果应该包含测量值(表示被测量集中性的参数又称最优估计值)和测量不确定度(表示被测量分散性的参数)两个指标[11-13]。不确定度是对测量结果质量的定量评定,测量结果是否有用,很大程度上取决于不确定度的大小,所以测量结果必须有不确定度说明时才是完整和有意义的[14]。目前,已有大量的研究文献对高效液相色谱法测定食品中常见的真菌毒素不确定度进行评定[15-20],而采用超高效液相色谱法-无衍生器(大流通池直接检测)-荧光检测器测定粮食中真菌毒素不确定度评定的文献资料较少,试验采用GB 5009.22-2016[21]《食品安全国家标准食品中黄曲霉毒素B 和G 族的测定》测定玉米中黄曲霉毒素B1(aflatoxin B1,AFB1)的含量,根据JJF1059.1-2012[11]《测量不确定度评定与表示》要求及CNAS-GL006-2018[10]《化学分析中不确定度的评估指南》,评定试验过程引入的不确定度,对测定过程中产生的不确定度分量进行计算,计算出合成标准不确定度及各分量的相对贡献[8],以期为评价测定结果的准确性和可靠性提供依据。
1 材料与方法
1.1 材料与试剂
玉米样品:贵州省储备粮管理有限公司;AFB1标准品(CAS:1162-65-8,纯度 99%,25.01μg/mL,不确定度为±0.03 μg/mL):新加坡 Pribolab 公司;甲醇、乙腈均为色谱纯:美国Tedia 公司;AFB1免疫亲和柱:江苏苏微生物研究有限公司;玻璃纤维滤纸:英国Whatman 公司;屈臣氏蒸馏水。
1.2 仪器与设备
ACQUITY UPLC H-Class 超高效液相色谱仪(配大体积流通池荧光检测器):美国Waters 公司;LT202E型分析天平:常熟市天量仪器有限责任公司;HY-4 型多用调速振荡器:江苏省金坛市荣华仪器制造有限公司;N-EVAP111 型氮吹仪:美国Organomation 公司;S0200 漩涡振荡器:美国莱伯特公司;3310 型实验磨:瑞典 Perten 公司;Researchplus 手动移液器:德国eppendorf 公司。
1.3 方法
1.3.1 样品前处理
参照GB5009.22-2016[21]“第三法高效液相色谱-柱后衍生法”大流通池直接检测,并结合江苏苏微生物研究有限公司提供的黄曲霉毒素B1免疫亲和柱说明书进行:将玉米样品清杂后,磨粉机粉碎,准确称取5.00 g 试样于150 mL 具塞锥形瓶中,加入1.0 g 氯化钠及25 mL 70%的甲醇水溶液,振荡20 min,用快速定性滤纸过滤,移取15 mL 滤液,用30 mL 水将滤液稀释混匀,再经玻璃纤维滤纸过滤,并收集滤液作为上样液;移取15 mL 上样液过免疫亲和柱,用去离子水淋洗免疫亲和柱2 次,每次10 mL,待液体排干后,用1.5 mL 甲醇洗脱。收集全部洗脱液,在50 ℃下用氮气缓缓地将洗脱液吹至近干,用初始流动相复溶定容至1.5 mL,用 0.22 μm 微孔滤膜,待测。
1.3.2 色谱条件
C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温 35 ℃;流动相:A 为水,B 为乙腈-甲醇(50+50);等度洗脱:洗脱程序为 65%A,洗脱时间 6 min;进样量:2 μL;流速:0.3 mL/min;检测器:荧光检测器,激发波长:365 nm;发射波长:436 nm。
1.3.3 建立数学模型
根据测定原理及方法,样品中AFB1含量计算见公式[21](1):

式中:X 为样品中 AFB1含量,μg/kg;C 为试样中AFB1含量,ng/mL;V 为最终甲醇洗脱液体积,mL;W为最终净化洗脱液所含试样质量,g;m 为试样称取质量,g;V1为样品和提取液总体积,mL;V2为稀释用样品滤液体积,mL;V3为稀释液体积,mL;V4为通过亲和柱的样品提取液体积,mL。
2 结果与分析
2.1 不确定度的来源分析
根据[10-11]CNAS-GL006-2018《化学分析中不确定度的评估指南》、JJF1059.1-2012《测量不确定度评定与表示》,从试样的检测过程及数学模型分析,玉米中AFB1测定结果的不确定度主要来源有:1)玉米样品非均匀性因素引入的相对标准不确定度urel(fhom);2)AFB1标准溶液校准过程带入的相对标准不确定度urel(cal),包括标准品储备液浓度引入的相对标准不确定度urel(cs),标准溶液质量浓度Cs 由温度变动引入的相对标准不确定度urel(C),标准中间液配置urel(V1)和urel(V2)、标准工作液配置引入的相对标准不确定度urel(Vs);标准工作曲线的拟合产生的相对标准不确定度urel(c);3)玉米样品称量相对标准不确定urel(m);4)回收率引入的相对标准不确定度玉米样品处理液定容引入的不确定度urel(V);6)AFB1含量重复性测量引入的相对标准不确定度urel(ωrep)。根据JJF1059.1-2012[11],将各分量相对标准不确定度进行合成,得到合成相对标准不确定度计算公式(2):

2.2 不确定度的评定
2.2.1 由样品非均匀性因素引入的相对标准不确定度urel(fhom)
由于玉米颗粒较小麦、稻谷大,AFB1在试样不同籽粒间分布极不均一,通常只有少部分颗粒受到黄曲霉菌污染,但经染的籽粒上却有较高的AFB1含量,所以感染严重的籽粒通常可以左右测定结果[22-23],因此样品非均匀性引入的不确定度分量应该包含在被测量的计算公式中。为了保证试样均匀性和检测结果的代表性,需要大量取样以制备样品,主要过程包括混合、粉碎、混匀、缩分等[23-24]。本试验制样过程如下:1)将待检测原粮样品(约2 kg)至于钟鼎式分样器反复混匀分样10 次;2)分别将单侧1/2 样(约1 kg)再次经钟鼎式分样器反复混匀5 次;3)随机分别取两侧1/4 样(约0.5 kg)经钟鼎式分样器分样,得到1/8 样(约0.25 kg);4)随机取两测1/8 样混合,得到约500 g试样,经波通水分磨粉碎,装入比试样体积大3 倍的自封袋,将自封袋充满空气封口合上,手动上下左右摇匀约1 min,即得到待测玉米粉试样。为了评定该不确定度分量,本试验从待测玉米粉试样平行称取10 份样品,分别测定含量,测定结果见表1,其不确定度按A类评定。

表1 不同样品AFB1 含量检测结果Table 1 Analytical results for the determination of AFB1 in different samples
10 个试样测定结果平均值X=3.60 μg/kg,标准偏差
因此,含量平均值X 的相对标准不确定度为urel(fhom)=
2.2.2 校准不确定度
校准过程中的不确定度包含两种不确定因素:一是标准溶液配制的相对标准不确定度,二是标准曲线拟合时带入的相对标准不确定度。
2.2.2.1 标准溶液配制的相对标准不确定度
1)不同厂家生产的标准物质的纯度不同,由其所导致的不确定度也不同,查找AFB1标准物质的出厂证书可以知道其浓度为(25.01±0.03)μg/mL,置信水平为95%,按B 类评定,属于正态分布,其标准不确定度u(cs)和相对标准不确定度urel(cs)分别为

2)标准溶液质量浓度Cs 由温度变动引入的相对标准不确定度
AFB1标准溶液的溶剂为乙腈,20 ℃时乙腈的膨胀系数为 1.37×10-3℃-1,而实验室的温度为(20±5)℃,按B 类评定,服从均匀分布,包含因子区间半宽度为:α(Cs)=5 ℃×1.37×10-3℃-1=6.85×10-3,引入的相对标准不确定度为:

3)中间标准溶液配制的相对标准不确定度:吸取400 μL 黄曲霉毒素 B1标准储备液(25.01±0.03)μg/mL,用初始流动相定容到10mL 容量瓶,得到浓度为1 μg/mL的标准中间液,配制过程中使用移液器吸取标准储备液时,会引入一定的不确定度,依据JJG 646-2006[25]移液器检定规程中相应的最大允差(maximum permissible errors,MPE),并根据矩形分布计算可以得到

同样可以根据JJG 196-2006[26]规程得到,配制过程中使用的 10 mL 容量瓶的允差为±0.020 mL,u(V2)和urel(V2)分别为

4)标准工作液配制的相对标准不确定度:把黄曲霉毒素B1标准中间液1 μg/mL 用初始流动相稀释得到 0.1、0.5、2、5、10、20 ng/mL 的校准曲线溶液。配制过程中使用了大小不同的移液器,由此产生的不确定度如表2所示,依据JJG 646-2006[25]移液器检定规程中应的MPE,计算得到:

综上可知,标准溶液配制带入的相对标准不确定度为:

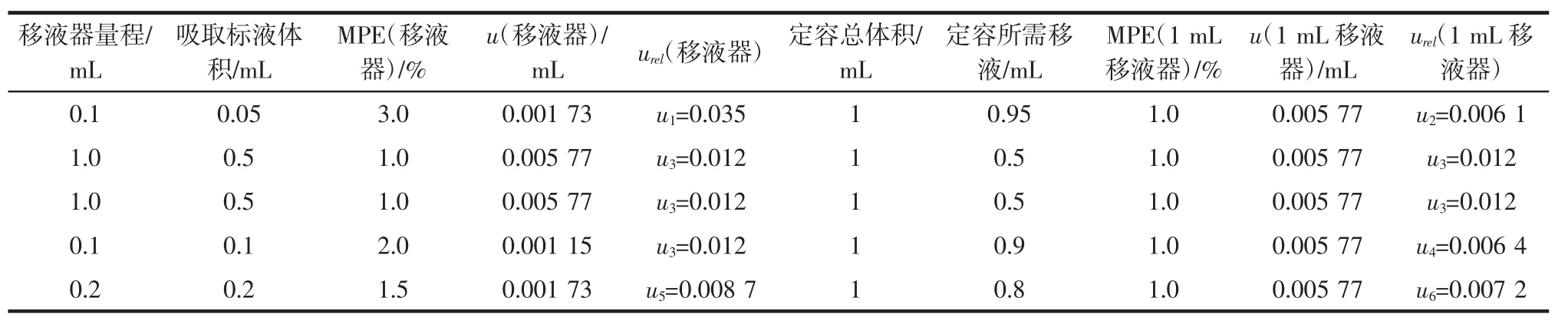
表2 使用不同量程移液器时的不确定度Table 2 Uncertainty in the use of different range pipettes
2.2.2.2 标准工作曲线拟合产生的相对标准不确定度
样品中AFB1浓度测定过程采用所配制的0.1、0.5、2、5、10、20 ng/mL 的标准工作液,分别取以上 6 种不同质量浓度的标准溶液2 uL 重复测定3 次,得到3次对应的峰面积A1~A3,根据最小二乘法计算,通过Excel 软件拟合,求得标准工作曲线的一元一次方程A=129 055.5C+8 152.7,结果见表3。

表3 标准曲线结果Table 3 Calibration curve fitting
将得到的6 次样品峰面积值代入标准曲线方程中,求得6 次测定的平均浓度C=3.74 ng/mL,样品中AFB1的浓度根据标准曲线求得,而标准曲线的拟合过程中存在着一定的不确定度,其u(c)值为u(c)=式中:s(A)表示标准溶液峰面积残差的标准差7 419;A 表示标准溶液峰面积;C 表示标准溶液浓度;表示标准溶液的平均浓度ng/mL;Sss表示标准溶液浓度残差的平方和表示标准溶液的测定次数,本试验取n=18;P 表示试样的测定次数,本试验取P=3。标准曲线的拟合过程中存在的urel(c)值为:

综上所述,校准过程带入的不确定度为:

2.2.3 样品称量相对标准不确定
用精确至0.01 g 的电子分析天平称取玉米样品,称量过程所引入的不确定度来自天平校准。天平校准的允许误差极值为±0.01 g,不确定度按B 类评定,服从均匀分布,包含因子称样量为5.00 g,则称量样品时天平引入的相对标准不确定度:

2.2.4 回收率引入的相对标准不确定度
玉米试样的前处理包括提取溶剂萃取、过滤、稀释、净化、浓缩、复溶等步骤,不确定度的影响因素较多,各环节的不确定度难以评定,该不确定度属A 类评定,利用添加3.0 ug/kg 水平6 次样品进行平行加标测定,测定的Rec 分别为92.0%、93.5%、89.5%、94.0%、95.0%、94.5%。平均回收率=93.1%,标准偏差SR=2.04%,计算得到分别为:

2.2.5 样品处理液定容引入的相对标准不确定度
根据JJG 646-2006[25],5 mL 移液器允许最大误差为±1.0%,按B 类评定,属于均匀分布则5 mL移液器的相对标准不确定度:

2.2.6 AFB1含量测量重复性引入的相对标准不确定度urel(ωrep)
重复性引入的不确定度,主要受操作人员的熟练程度及仪器本身性能等因素的影响,并包含了C、V、m测量时的重复性不确定度的分量,该不确定度属A 类评定[24]。随机选取2.2.1 节中AFB1试样1 进行6 次独立重复测定,结果分别为 3.78、3.82、3.80、3.82、3.79、3.79 μg/kg,平均值=3.79 μg/kg,标准偏差,计算测定过程中伴随的随机效应导致的和urel(ωrep)分别为

2.3 相对合成标准不确定度
由上述各相对标准不确定度合成玉米中AFB1含量测定的相对合成标准不确定度为:

2.4 主要相对标准不确定度分量对相对合成不确定度的贡献
主要相对标准不确定度分量对相对合成不确定度的贡献见表4。

表4 主要不确定度分量的相对贡献Table 4 The relative contribution of uncertainty components
由表4可知,样品非均匀性引入的不确定度相对贡献最大,回收率、校准过程、样品处理液定容等次之,样品称量及重复测定引入的相对贡献最小。
2.5 相对扩展不确定度
试验玉米中AFB1的含量为3.60 μg/kg,则其标准不确定度为:

在没有特殊要求的情况下,按照国际惯例,取扩展因子k=2,置信概率p=95%,则AFB1测量结果的相对扩展不确定度为:

因此,高效液相色谱法测定玉米中AFB1含量测量结果可表示为(3.60±0.14)μg/kg,包含因子 k=2,置信概率p=95%。
2.6 讨论
从表4各主要不确定度分量的相对贡献可知,试验过程中样品均匀性所引入的不确定度分量(52.08%)最大,黄曲霉毒素B1在样品中分布不均匀性问题已是客观存在,提示检测人员在实际工作中,应该重视真菌毒素的混样、取样步骤,同时扦样人员在入库扦样时应注意所扦样品是否具有代表性,扦样点少无代表性,扦样点多增加工作人力,且耗时,对于不同大小粮仓,应扦取多少个样品点,还有待深入研究。
3 结论
试验采用超高效液相色谱法测定玉米中AFB1的含量,通过分析和量化各分量相对标准不确定度对测定结果的影响,并对测定结果的不确定度来源和各分量相对贡献进行比较,得出如下结论。
1)通过计算各分量的标准偏差,得到各分量的相对标准不确定度,得知玉米中AFB1不确定度主要来源于样品非均匀性,其次是样品前处理回收率、校准过程及样品处理液的定容,样品称量及重复测定引入的相对标准不确定度贡献最小。
2)试验结果的不确定度可表示为(3.60±0.14)μg/kg。在测定过程中,由于真菌毒素在样品中分布极不均。因此,在样品制备过程中,颗粒样品的粉碎和进一步混匀至关重要,检测为了使检测结果客观、真实,检测人员应多次混匀样品,平行测定2 个以上样品,尽量减小由样品不均匀因素引入的不确定度;同时,检测人员应严格按照规范配置标准溶液,定期做加标回收试验,或对质控样品进行测试,尽可能减少系统和偶然误差;并定期参加不同单位间的能力比对验证活动,发现新问题,解决问题,只有这样,才能把不确定度控制在可接受的范围内。
