动物细胞培养技术在人造肉研究中的应用
2019-08-27张国强赵鑫锐李雪良孙秀兰周景文堵国成陈坚
张国强,赵鑫锐,李雪良,孙秀兰,周景文,堵国成,陈坚
动物细胞培养技术在人造肉研究中的应用
张国强1,2,赵鑫锐2,李雪良2,孙秀兰3,周景文1,2,堵国成2,陈坚1,2
1 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122 2 江南大学 生物工程学院,江苏 无锡 214122 3 江南大学 食品学院,江苏 无锡 214122
人造肉作为2018年全球十大突破和新兴科技之一,因其来源可追溯、食品安全性和绿色可持续等优势得到广泛的关注。欧美等国家已经投入大量资源开展细胞培养人造肉研究,未来将对我国的肉制品及食品市场造成一定的冲击。现阶段,细胞培养人造肉生产的挑战在于如何高效模拟动物肌肉组织生长环境,并在生物反应器中实现大规模的生产。尽管动物细胞组织培养技术已经得到深入的研究,并取得了不同程度的成功应用,但由于现有动物细胞组织培养成本与技术要求较高,仍不能实现大规模的产业化培养。因此,对于人造肉的生产来说,开发高效、安全的大规模细胞培养技术是亟需解决的问题,可以有效降低生产成本,实现产业化应用。文中通过介绍基于人造肉生物制造的动物细胞组织培养技术研究现状,具体阐述了目前的挑战和关键技术问题,并初步探讨了其可能的解决策略和应用前景。
人造肉,植物蛋白肉,细胞组织培养,干细胞,无血清培养基
随着人类经济社会发展水平的不断提升,全球肉制品消耗量快速增长。到2050年,全球人口数量预计将增长至90亿,肉类制品消耗预计将超过30 000亿美元。这将会加重传统养殖业的负担,带来越来越多的环境与社会问题[1]。近年来,人造肉由于在营养、健康、安全、环保等方面均较传统养殖肉类有显著优势,引起广泛的关注。通常所说的“人造肉”,一般可以分为“植物蛋白肉”和“细胞培养肉”两大类,是未来农产品生产的重要发展趋势(表1)[2-3]。例如,美国Impossible Foods公司以植物组织蛋白为基础,通过添加血红素生产的植物蛋白肉制品,已经获得了近5亿美元的投资,并实现了在美国、中国香港等地的销售。
植物蛋白肉由于植物蛋白来源广泛、加工工艺相对成熟,已经逐步开始商业化生产,但在口感、风味与营养等方面与传统肉制品仍然存在较大差距,还有一系列关键问题有待深入研究,主要集中在植物蛋白品质改良、纤维化结构加工和营养风味物质添加等。
近年来,细胞培养人造肉(Cultured meat) 因其来源可追溯、绿色安全、口感更接近传统肉类等特性引起了广泛的关注[4-5]。科研人员选择具有最佳遗传基因的动物,通过提取可高效增殖的干细胞或组织并放入培养皿中繁殖,进而分化成肌肉组织的原始纤维(图1)。细胞培养肉在生产过程中不耗费饲料和水,不需要进行垃圾废物处理,在满足人类对肉类的需求同时也解决了传统养殖业带来的社会环境问题,包括无激素抗生素、环境可持续性、是否友好地对待动物等。细胞培养肉在营养、口感和风味方面更接近真实肉制品,是未来人造肉的主要研究发展方向,但是在理论与技术层面,特别是大规模肌肉细胞低成本获取与食品化等方面,还存在诸多挑战。
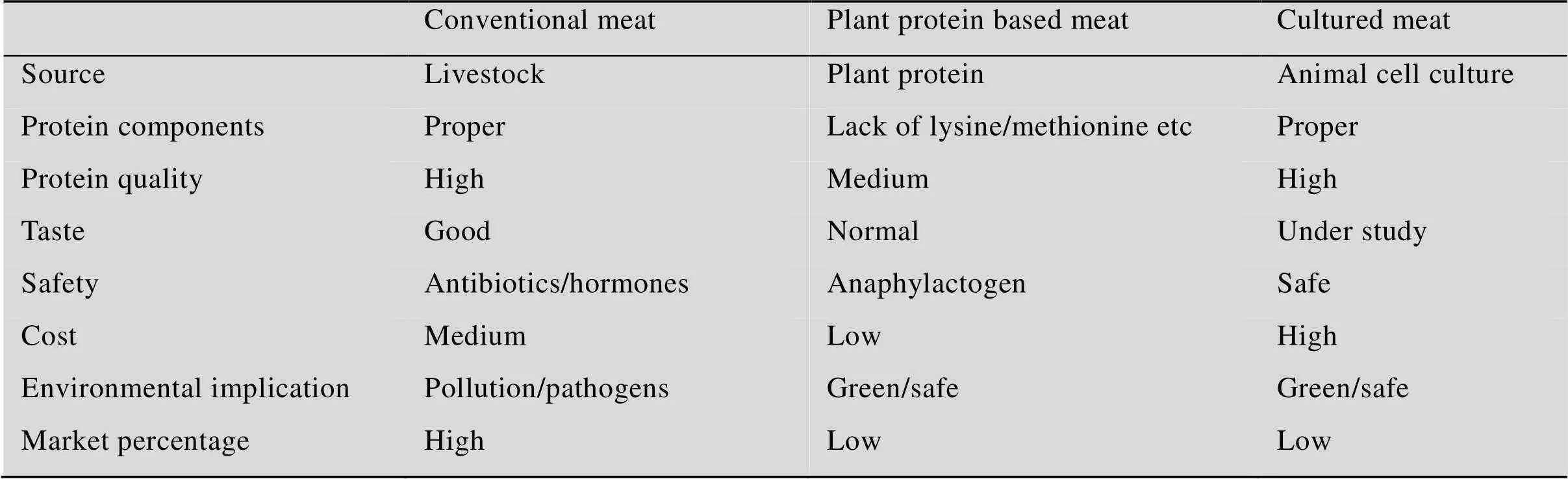
表1 传统养殖肉、植物蛋白肉和细胞培养肉总结
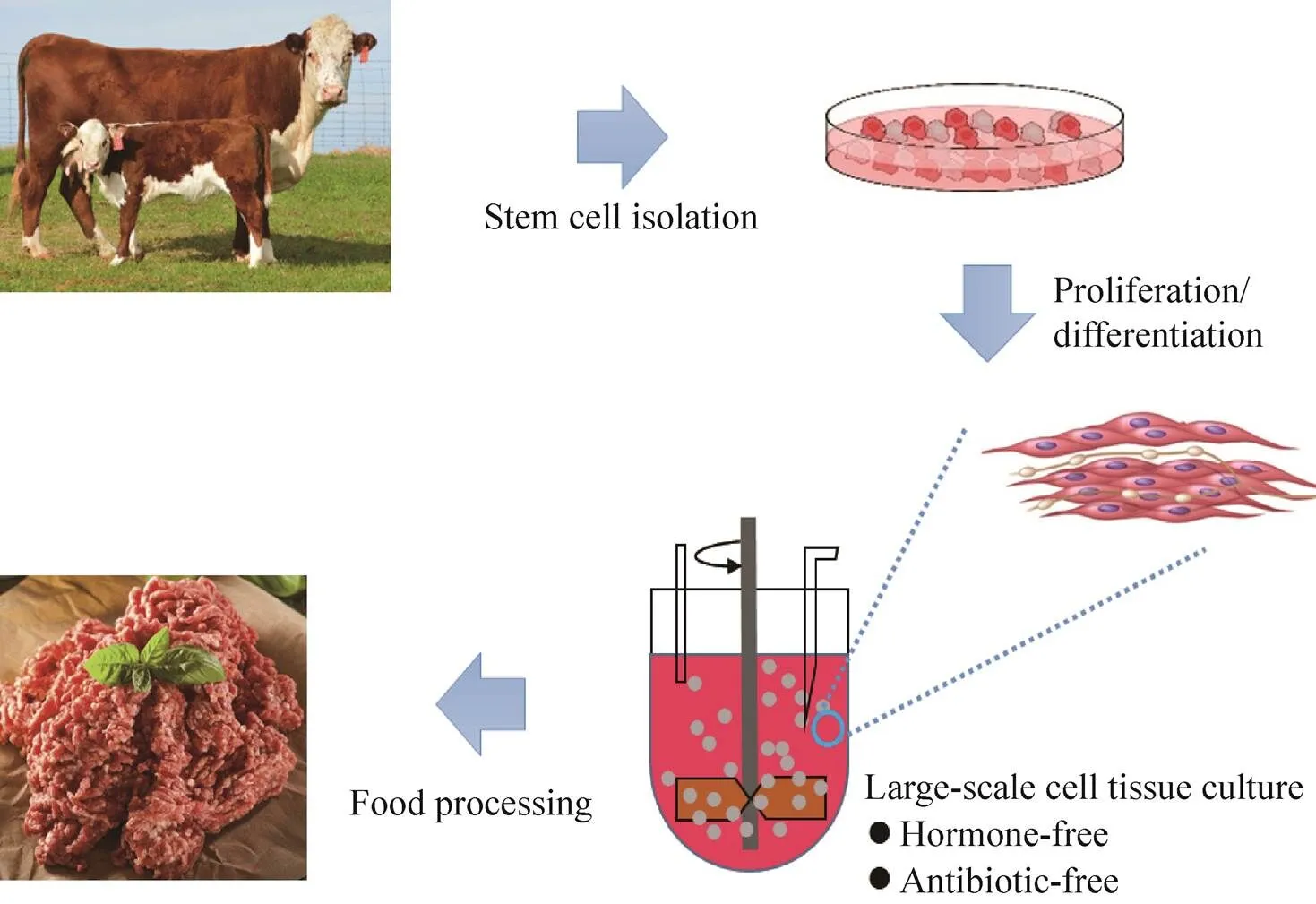
图1 细胞培养肉的生物制造流程图
目前人造肉细胞组织工程培养的挑战在于如何高效模拟动物身上的肌肉组织生长环境,并在生物反应器中实现大规模的生产。由于国内人造肉的相关研究开展相对不足,缺少对国内外人造肉生产研究进展的综述介绍与分析。因此,本文基于人造肉动物细胞组织培养技术的研究、开发与应用现状,对其在人造肉安全、高效生产中所面临的挑战与关键问题进行阐述,并对其应用前景作了初步探讨。
1 细胞培养技术在人造肉生产中应用
细胞培养肉也被称为体外肉,这个概念最早是由Winston Churchill于1932年提出,但研究进展相对缓慢。直至2000年,欧美等国家开始开展食品级人造肉组织培养的相关研究[6-7]。2013年,荷兰生物学家Mark Post用动物细胞组织培养方法生产出有史以来的第一整块人造肉,引起广泛的关注[2]。动物细胞培养人造肉主要由含不同细胞的骨骼肌组成,这些骨骼肌纤维是通过胚胎干细胞或肌卫星细胞的增殖、分化、融合而形成[8]。他们首先分离出了可生长分化的原始干细胞,通过添加富含氨基酸、脂质、维生素的培养液,加速细胞增殖分化,获得大量牛肌肉组织细胞。随后,Memphis Meat、日本日清等多家国外公司也都利用类似细胞培养策略生产新型人造肉。但是目前通过细胞组织培养获得的人造肉的产量还很低,成本较高,还不足以形成大体积的肌肉组织作为食品出售。因此,开发高效、安全、低成本的动物细胞培养技术,构建牛或其他动物的肌肉细胞组织生长环境将成为人造肉产业化生产的关键问题。
2 人造肉细胞培养中关键技术
传统动物组织培养技术始于20世纪90年代美国实验室,早期动物细胞的培养是为了研究细胞的代谢和生长特征,之后细胞培养技术不断成熟,得到更广泛的应用,已经实现从实验室走向工业化生产。
目前,动物组织工程的研究在很大程度上集中在生物学和医学方面,比如再生医学、药物开发和毒理研究等。虽然人造肉细胞培养所利用的技术原则与医学上是一致的,但是由于人造肉是一种食品而不是医疗产品,所以它的监管要求不需要那么严格,并且原材料纯度可能不需要像生物医学应用那么高,因此,对于人造肉类来说,如何实现快速、安全的大规模生产更为重要,这可以有效降低生产成本,实现技术的推广应用[9]。为实现动物组织的大规模安全培养,包括初始细胞来源、细胞增殖分化能力、体外动物细胞组织的形成以及培养体系优化等问题将成为研究的关键。
2.1 初始细胞来源
在动物细胞组织培养过程中如何选择合适的初始细胞来源一直是研究的热点和难点问题[10]。其中人造肉细胞组织培养的主要挑战在于需要从组织中分离获得大量的、均一性的初始细胞,可以进行有效持续增殖分化,实现人造肉的大规模生产。
目前动物组织工程细胞培养细胞来源主要是分离原生组织中的干细胞,例如胚胎干细胞、肌肉干细胞、间充质干细胞、成体干细胞等[11]。其中肌肉干细胞和间充质干细胞是人造肉研究中应用最为广泛的,它们在增殖过程中可以经过特殊化学、生物诱导或机械刺激分化形成不同细胞。虽然在理论上讲,不同干细胞系建立后均可以进行无限的增殖,但是在增殖过程中细胞突变的积累往往会影响组织培养的扩增能力,导致细胞衰老而终止生长[12]。此外,为提高细胞持续增殖能力,科研工作者也通过基因工程或化学方法诱导原始组织或细胞系产生突变,促使细胞无限增殖,并培养出相应的细胞群体[13]。这些持续增殖细胞可以减少对新鲜组织样本的依赖并加快细胞增殖分化速度,但是往往会带来细胞非良性增殖等安全性问题。
为进一步拓展原始细胞来源,基于可诱导多功能干细胞(Induced pluripotent stem cell,iPSC)的研究得到广泛关注,该技术可以高效制备多能干细胞,实现大规模细胞增殖[14-16]。随着国内在新兴干细胞研究中投入的加大,国内实验室已取得了重要的科研进展。关伟军等[17-18]通过不同的诱导方法成功将不同来源动物细胞诱导为干细胞,运用细胞形态学观察、特异性染色和免疫荧光等检测手段进一步证明所分离培养的干细胞具有多分化潜能。研究人员还通过开展胚胎干细多能性分子机制及重编程研究[19],证明维生素C可以显著提高动物细胞重编程效率[20]。此外,去分化细胞作为干细胞的有效替代也具有重要研究价值。它通过可逆的方式将已分化细胞转变为潜在多能细胞,从而具备继续分化的能力。例如研究人员利用已成熟的脂肪细胞,通过体外去分化形成多功能去分化脂肪细胞[21],还可以进一步将去分化细胞诱导形成骨骼肌细胞[22]。这些研究为多能干细胞的高效制备提供了重要基础。
2.2 细胞增殖分化
干细胞与组织工程领域的发展为大规模人造肉的生产提供了可能性[23-25]。细胞培养人造肉的生产需要通过大量分裂分化的肌肉细胞形成组织,但是大多数细胞在自然死亡前的分裂次数是有限的,也被称为海弗利克极限,这就限制了实验室肌肉细胞组织的大规模培养。Edelman等[26]通过不断补充新鲜培养液,使用可持续增殖的细胞系等方法突破细胞增殖极限。虽然,这些策略也已经在细胞组织培养中得到应用,但是仍不能满足人造肉生产中对细胞持续繁殖能力的要求。
增加细胞的再生潜能是另一种增强动物细胞持续增殖能力的有效方式。例如,海弗利克极限是通过端粒长度来确定的,其中的端粒是位于线状染色体的末端富含鸟嘌呤的重复序列。在线性染色体不断复制过程中,端粒会随着每一轮复制而缩短,进而影响细胞再生能力。而端粒酶是一种能延长端粒的核酶,一般存在于抗衰老细胞系中。因此,通过端粒酶的表达调控或外源添加可以有效提升细胞再生潜能,有利于实现动物细胞的大规模、稳定快速增殖[27]。
此外,为了提高细胞培养人造肉的质量,Hocquette等[28]通过将肌肉细胞与脂肪细胞共同培养,增加了培养体系中的脂肪成分,提高人造肉的纹理结构及风味。因此,研究人员可以通过精确控制干细胞增殖分化方向和节点,实现不同蛋白与脂肪含量人造肉的定制生产。
2.3 支架系统
自然状态下的动物肌肉细胞为附着生长,并嵌入到相应组织中。为了模拟体内环境,体外肌肉细胞培养需要利用合适的支架体系进行粘附支撑生长,辅助形成细胞组织纹理及微观结构,维持肌肉组织三维结构[29]。现有的支架因其形状、组成和特性分成不同类型,其中最为理想的支架系统应该具有相对较大的比表面积用于细胞依附生长,可灵活地收缩扩张,模拟体内环境的细胞粘附等因素,并且易于与培养组织分离[30]。Edelman等[26]利用胶原蛋白构建的球状支架系统,可以增加细胞组织培养的附着位点,同时有效维持组织形成过程中的外部形态。Lam等[31]通过利用微型波浪表面的支架进行细胞组织培养,实现了表面肌肉细胞的天然波形排列,具有天然肉的纹理特性。总的来说,支架系统可以改善细胞生长环境,但仍然存在回收困难、成本高、稳定性不足等问题。现在的研究热点主要集中在是否可以开发可食用或可降解的支架,使其成为肌肉组织的一部分,或者是开发可重复使用的支架,以节省材料。例如,使用食品级胶原蛋白、纤维蛋白、凝血酶或其他动物来源的水凝胶等材料模仿自然组织[30]。因此,开发可食用、多孔隙或可重复利用生物支架系统,可以提高细胞组织的结构稳定性与表面结合率,有利于加速细胞生长速率,降低人造肉大规模组织培养成本[32]。由于粘附细胞系具有接触抑制生长特性,这决定了其体外增殖能力不足,支架技术虽然可以部分改善细胞增殖性能,仍不能完全满足大规模快速增殖的要求。为突破这一技术瓶颈,科研工作者也开展了非粘附细胞系的研究[33],通过对贴壁细胞的驯化改造与筛选,获得具有高增殖能力的非贴壁细胞,进一步优化组织培养条件,实现动物细胞的大规模悬浮培养或微载体辅助的悬浮培养(图2),该技术可以减少对支架等媒介系统的粘附和依赖性,进一步达到较高的培养密度,降低成本,有利于实现大规模的细胞组织培养。
2.4 无血清培养体系
大规模体外培养细胞面临着被微生物污染或受自身代谢物质影响的难题,因此,在进行体外细胞培养时,要及时清除细胞产生的代谢废物,为体外培养细胞提供无菌无毒的生存环境。传统的细胞培养阶段都使用动物血清提供细胞贴壁、增殖和分化所需的营养成分和生物因子,并且往往需要添加抗生素或抗有丝分裂剂,不能满足食品安全要求[32]。因此,如何优化培养条件是实现安全、大规模体外动物细胞组织培养的重要影响因素。随着动物细胞培养技术的发展,无血清培养体系因其培养基组分清晰明确、易于分离以及质控更为安全可靠等优势,使其在细胞生物学、药理学、肿瘤学和细胞工程领域已得到广泛的应用[34]。

图2 非粘附细胞的驯化筛选与悬浮培养示意图
无血清培养体系包括无血清培养基的开发、适应细胞株的驯化以及细胞规模化培养等关键技术。近年的研究证明,无血清培养基对细胞的生长速率、细胞密度、产物及蛋白表达水平都不亚于血清培养基[35],并且可以通过精确控制无血清培养基组分调控细胞的增殖分化节点[36],其显著的优势将使无血清培养技术逐步取代含血清细胞培养。虽然现有无血清培养基需要外源添加生长因子、维生素、脂肪酸及微量元素等[37],成本仍然相对较高,但是随着合成生物学和代谢工程的快速发展,可以利用微生物有效合成外源营养因子,这将极大地降低生长因子等外源添加成本,进而实现无血清培养基的低成本产业化应用[38-39]。动物细胞无血清培养技术的日趋成熟和应用将有效提高细胞培养浓度和产品的表达水平,促进动物细胞大规模培养技术的进一步发展。
3 总结与展望
随着人们对健康、环保及高品质食品的追求,如何创新发展未来农产品生产与其加工技术,是亟待解决的重大问题。利用细胞工厂作为种子,生物制造包括淀粉、蛋白、肉类、牛奶以及鸡蛋等未来绿色农产品,不仅能为人类提供高品质的食品来源,而且无需大量种植作物和养殖动物,可以有效节约自然资源与能源。随着生物与食品技术发展,未来越来越多农产品将走向人工生物合成制造的道路,这也将是无激素及抗生素、无食品过敏源、绿色安全高品质农产品的发展趋势。
江南大学研究人员依托生物工程、发酵工程及食品科学等交叉学科优势,已经开展了关于人造肉等先进食品蛋白品质改良与食品化加工的初步研究,例如Zhao等通过代谢工程策略改造大肠杆菌实现了血红素的高效合成,为后期血红蛋白的合成和食品化添加奠定了基础[40]。Liu等通过改良优化谷氨酰胺转胺酶的酶学特性,提高谷氨酰胺转胺酶的应用能力,可以有效实现蛋白间的高效交联,为细胞培养肉后期结构品质改良提供了基础[41]。
为实现人造肉的大规模、安全生产,动物细胞培养技术未来的发展方向将重点放在改良动物细胞增殖分化特性和优化细胞高密度生长环境等方面,最终提高细胞培养人造肉产量,降低成本。虽然目前动物细胞培养当中还存在着大量困难,但是通过进一步利用细胞生物学、分子生物学以及合成生物学等交叉学科基础,可望逐步解决现有动物组织培养技术中存在的问题。此外,随着动物细胞生物反应器不断改良,必将促进动物细胞大规模培养技术的发展,为人造肉等新一代农产品的绿色制造提供新的动力。
[1] Stephens N, Di Silvio L, Dunsford I, et al. Bringing cultured meat to market: technical, socio-political, and regulatory challenges in cellular agriculture. Trends Food Sci Technol, 2018, 78: 155–166.
[2] Post MJ. Cultured beef: medical technology to produce food. J Sci Food Agric, 2014, 94(6): 1039–1041.
[3] Genovese NJ, Domeier TL, Telugu BP, et al. Enhanced development of skeletal myotubes from porcine induced pluripotent stem cells. Sci Rep, 2017, 7: 41833.
[4] Datar I, Betti M. Possibilities for anmeat production system. Innov Food Sci Emerg Technol, 2010, 11(1): 13–22.
[5] Pandurangan M, Kim DH. A novel approach formeat production. Appl Microbiol Biotechnol, 2015, 99(13): 5391–5395.
[6] Benjaminson MA, Gilchriest JA, Lorenz M.edible muscle protein production system (MPPS): stage 1, fish. Acta Astronaut, 2002, 51(12): 879–889.
[7] Wilschut KJ, Jaksani S, van den Dolder J, et al. Isolation and characterization of porcine adult muscle-derived progenitor cells. J Cell Biochem, 2008, 105(5): 1228–1239.
[8] Langelaan MLP, Boonen KJM, Polak RB, et al. Meet the new meat: tissue engineered skeletal muscle. Trends Food Sci Technol, 2010, 21(2): 59–66.
[9] Arshad MS, Javed M, Sohaib M, et al. Tissue engineering approaches to develop cultured meat from cells: a mini review. Cogent Food Agric, 2017, 3(1): 1320814.
[10] Post MJ. Cultured meat from stem cells: challenges and prospects. Meat Sci, 2012, 92(3): 297–301.
[11] Stern-Straeter J, Bonaterra GA, Juritz S, et al. Evaluation of the effects of different culture media on the myogenic differentiation potential of adipose tissue- or bone marrow-derived human mesenchymal stem cells. Int J Mol Med, 2014, 33(1): 160–170.
[12] Amit M, Carpenter MK, Inokuma MS, et al. Clonally derived human embryonic stem cell lines maintain pluripotency and proliferative potential for prolonged periods of culture. Dev Biol, 2000, 227(2): 271–278.
[13] Ramboer E, de Craene B, de Kock J, et al. Strategies for immortalization of primary hepatocytes. J Hepatol, 2014, 61(4): 925–943.
[14] Bogliotti YS, Wu J, Vilarino M, et al. Efficient derivation of stable primed pluripotent embryonic stem cells from bovine blastocysts. Proc Natl Acad Sci USA, 2018, 115(9): 2090–2095.
[15] Wu SM, Hochedlinger K. Harnessing the potential of induced pluripotent stem cells for regenerative medicine. Nat Cell Biol, 2011, 13(5): 497–505.
[16] Lai MI, Wendy-Yeo WY, Ramasamy R, et al. Advancements in reprogramming strategies for the generation of induced pluripotent stem cells. J Assist Reprod Genet, 2011, 28(4): 291–301.
[17] Lu TF, Pei WH, Wang KF, et al.culture and biological properties of broiler adipose-derived stem cells. Exp Ther Med, 2018, 16(3): 2399–2407.
[18] Yang JJ, Zhao QJ, Wang KF, et al. Isolation, culture and biological characteristics of multipotent porcine tendon-derived stem cells. Int J Mol Med, 2018, 41(6): 3611–3619.
[19] Esteban MA, Pei DQ. Vitamin C improves the quality of somatic cell reprogramming. Nat Genet, 2012, 44(4): 366–367.
[20] Shi Y, Zhao Y, Deng HK. Powering reprogramming with vitamin C. Cell Stem Cell, 2010, 6(1): 1–2.
[21] Matsumoto T, Kano K, Kondo D, et al. Mature adipocyte-derived dedifferentiated fat cells exhibit multilineage potential. J Cell Physiol, 2008, 215(1): 210–222.
[22] Kazama T, Fujie M, Endo T, et al. Mature adipocyte-derived dedifferentiated fat cells can transdifferentiate into skeletal myocytes. Biochem Biophys Res Commun, 2008, 377(3): 780–785.
[23] Zhao LX, Wang ZX, Zhang JD, et al. Characterization of the single-cell derived bovine induced pluripotent stem cells. Tissue Cell, 2017, 49(5): 521–527.
[24] Cravero D, Martignani E, Miretti S, et al. Generation of induced pluripotent stem cells from bovine epithelial cells and partial redirection toward a mammary phenotype. Cell Reprogram, 2015, 17(3): 211–220.
[25] Han ZB, Chen HX, Deng JX. Multipotential differentiation and potential applications of adipose-derived stem cells. Chin J Biotech, 2007, 23(2): 195–200 (in Chinese). 韩正滨, 陈红星, 邓继先. 脂肪源性干细胞的多向分化潜力及应用前景. 生物工程学报, 2007, 23(2): 195–200.
[26] Edelman PD, McFarland DC, Mironov VA, et al. Commentary:-cultured meat production. Tissue Eng, 2005, 11(5/6): 659–662.
[27] Harley CB. Telomerase is not an oncogene. Oncogene, 2002, 21(4): 494–502.
[28] Hocquette JF, Gondret F, Baéza E, et al. Intramuscular fat content in meat-producing animals: development, genetic and nutritional control, and identification of putative markers. Animal, 2010, 4(2): 303–319.
[29] Sakar MS, Neal D, Boudou T, et al. Formation and optogenetic control of engineered 3D skeletal muscle bioactuators. Lab Chip, 2012, 12(23): 4976–4985.
[30] Bian WN, Bursac N. Engineered skeletal muscle tissue networks with controllable architecture. Biomaterials, 2009, 30(7): 1401–1412.
[31] Lam MT, Sim S, Zhu XY, et al. The effect of continuous wavy micropatterns on silicone substrates on the alignment of skeletal muscle myoblasts and myotubes. Biomaterials, 2006, 27(24): 4340–4347.
[32] Butler M. Serum and protein free media: Animal Cell Culture. Cham: Springer, 2015, 9: 223–236.
[33] Yamazoe H, Ichikawa T, Hagihara Y, et al. Generation of a patterned co-culture system composed of adherent cells and immobilized nonadherent cells. Acta Biomater, 2016, 31: 231–240.
[34] Wu W, Zhou Y, Tan WS.culture of bone marrow-derived mesenchymal stem cells in a chemically-defined serum-free medium. Chin J Biotech, 2009, 25(1): 121–128 (in Chinese). 吴伟, 周燕, 谭文松. 骨髓间充质干细胞无血清培养. 生物工程学报, 2009, 25(1): 121–128.
[35] de Bruyn C, Delforge A, Bron D.myeloid differentiation of cord blood CD34+cells: comparison of four serum-free media containing bovine or human albumin. Cytotherapy, 2003, 5(2): 153–160.
[36] Danoviz ME, Yablonka-Reuveni Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Mol Biol, 2012, 798: 21–52.
[37] Aswad H, Jalabert A, Rome S. Depleting extracellular vesicles from fetal bovine serum alters proliferation and differentiation of skeletal muscle cells. BMC Biotechnol, 2016, 16: 32.
[38] Fujita H, Endo A, Shimizu K, et al. Evaluation of serum-free differentiation conditions for C2C12 myoblast cells assessed as to active tension generation capability. Biotechnol Bioeng, 2010, 107(5): 894–901.
[39] Shiozuka M, Kimura I. Improved serum-free defined medium for proliferation and differentiation of chick primary myogenic cells. Zool Sci, 2000, 17(2): 201–207.
[40] Zhao XR, Choi KR, Lee SY. Metabolic engineering offor secretory production of free haem. Nat Catal, 2018, 1(9): 720–728.
[41] Liu S, Wang M, Du GC, et al. Improving the active expression of transglutaminase inby promoter engineering and codon optimization. BMC Biotechnol, 2016, 16: 75.
Application of cell culture techniques in cultured meat-a review
Guoqiang Zhang1,2, Xinrui Zhao2, Xueliang Li2, Xiulan Sun3, Jingwen Zhou1,2, Guocheng Du2, and Jian Chen1,2
1 National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China 2 School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China 3 School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
As one of the top 10 breakthrough and emerging technologies in the world in 2018, cultured meat has attracted extensive attention due to its advantages of traceable origin, food safety and green sustainable development. Europe and the United States have invested a lot of resources to focus on research about cultured meat, which will affect our domestic meat and food market in the future. At present, the challenge of cultured meat production is how to efficiently simulate the growth environment of animal muscle tissue and realize large-scale production in bioreactor. Although cell tissue engineering has been deeply studied and achieved varying successful application, it is still difficult to obtain large-scale cultured meat production due to the high cost and technical requirements. Therefore, the development of efficient and safe cell culture technology is an urgent problem for large-scale cultured meat production, which can effectively reduce costs and achieve industrial application. In this review, we summarize the research progress of animal cell tissue culture technology used for cultured meat, and highlighted the current challenges and possible strategies in further applications.
cultured meat, plant protein-based meat, cell tissue culture, stem cell, serum-free medium
April 15, 2019;
June 17, 2019
Supported by: National Key Research and Development Program of China (No. 2017YFC1600403).
Jian Chen. Tel: +86-510-85913660; E-mail: jchen@jiangnan.edu.cn
国家重点研发计划项目(No. 2017YFC1600403) 资助。

张国强, 赵鑫锐, 李雪良, 等. 动物细胞培养技术在人造肉研究中的应用. 生物工程学报, 2019, 35(8): 1374–1381.Zhang GQ, Zhao XR, Li XL, et al. Application of cell culture techniques in cultured meat-a review. Chin J Biotech, 2019, 35(8): 1374–1381.
(本文责编 郝丽芳)
