基于种特异性COI标记的西花蓟马温室品系和羽扇豆品系一步双重快速鉴定技术
2019-08-27张蓉王玉生杨丽梅万方浩张桂芬
张蓉,王玉生,杨丽梅,万方浩,2,张桂芬,2
基于种特异性COI标记的西花蓟马温室品系和羽扇豆品系一步双重快速鉴定技术
张蓉1,王玉生1,杨丽梅3,万方浩1,2,张桂芬1,2
(1中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室/农业农村部作物有害生物综合治理重点实验室,北京 100193;2农业农村部外来入侵生物预防与控制研究中心,北京 100193;3北京市大兴区榆垡镇农业技术推广站,北京 102602)
【】西花蓟马()是世界性农业和园艺作物害虫,也是我国重要的对外对内检疫对象。西花蓟马具有两个品系,即温室品系(greenhouse race,GR)和羽扇豆品系(lupin race,LR),二者在寄主范围、抗药性、生存环境等方面均具有明显差异,但外部形态相似,无法准确鉴别。【】以西花蓟马温室品系和羽扇豆品系为靶标,以田间常见的其他14种蓟马为参照,采用基于线粒体DNA细胞色素C氧化酶亚基I(mitochondrial DNA cytochrome c oxidase subunit I,mtDNA COI)基因的种特异性(species-specific COI,SS-COI)PCR法,研究一步双重品系快速检测技术。【】采用mtDNA COI基因通用引物获得西花蓟马温室品系和羽扇豆品系以及其他常见蓟马的COI序列,根据测序结果以及数据库已公开数据,设计筛选获得可同时扩增两个品系的特异性组合引物(TF6/GR32/LR12),其中TF6为品系通用上游引物,GR32为温室品系特异性下游引物,LR12为羽扇豆品系特异性下游引物,其扩增片段大小分别为温室品系362 bp、羽扇豆品系541 bp;对组合引物比例和退火温度进行优化;同时,对组合引物的种/品系特异性和灵敏性/检测阈值进行检验。【】当组合引物TF6/GR32/LR12比例为1.0/0.2/0.8、退火温度为44℃时,扩增效果最好。种/品系特异性检测结果证实,该检测技术仅对西花蓟马温室品系和羽扇豆品系具有扩增能力,对田间常见的其他14种蓟马包括花蓟马()、禾花蓟马()、黄胸蓟马()、大蓟马()、棕榈蓟马()、烟蓟马()、普通大蓟马()、豆喙蓟马()、草木樨近绢蓟马()、蔗腹齿蓟马()、稻简管蓟马()、榕端宽管蓟马()、榕母管蓟马()和横纹蓟马()等不具有扩增能力。灵敏性检测结果显示,该组合引物不仅对单一品系或混合品系的成虫具有良好的扩增效果,对单粒卵、1龄和2龄幼虫以及预蛹和蛹均具有同样的扩增效能;对温室品系的最低检测阈值为35.90 pg·μL-1,相当于1/10 240头雌成虫,对羽扇豆品系的最低检测阈值为146.95 pg·μL-1,相当于1/2 560头雌成虫;同时,对来自不同地域的同一品系不同单倍型的成虫亦具有良好的扩增效能。【】建立的技术体系完全可以用于西花蓟马品系的快速鉴定及检疫监管,对有效阻截其进一步传播扩散及靶向防控措施制定意义重大。
西花蓟马温室品系;西花蓟马羽扇豆品系;一步双重PCR;SS-COI标记;品系特异性组合引物;快速鉴定
0 引言
【研究意义】西花蓟马()又称苜蓿蓟马,属缨翅目(Thysanoptera)蓟马科(Thripidae)花蓟马属(),是一种世界性检疫性害虫,也是我国重要的对外对内检疫对象。西花蓟马包括两个品系,即温室品系(greenhouse race,GR)和羽扇豆品系(lupin race,LR),二者在寄主植物范围[1]、生存环境[2]、抗药性[3]等方面均有明显差异。相较于羽扇豆品系,温室品系具有更广的寄主植物范围(温室品系60余科,500余种[4-6];羽扇豆品系18科,20余种[1,7-11])、更强的杀虫剂抗性[3],更喜欢在温暖干燥的环境下生存[2],以及更强的繁殖能力和更快的发育速率[12]。西花蓟马温室品系和羽扇豆品系的快速检测鉴定,对西花蓟马的检疫监管及其靶向性防控具有重要意义。【前人研究进展】西花蓟马原产于美国西北部[13],是美国加州常见害虫,之后随花卉产业发展以及国际贸易活动迅速扩散,目前,在以色列[14]、南非[15]、马来西亚[16]、日本[17]、澳大利亚[18]、韩国[19]、印度[20]等均有发生的报道。西花蓟马为多食性害虫,寄主植物有60余科500多种,包括蔬菜、果树、花卉及园林植物等,既可直接锉吸危害,亦可通过传播植物病毒间接危害,严重影响产品的质量和产量以及花卉园林植物的观赏价值,已成为一种世界性农业和园艺作物害虫[21-22]。2000年中国昆明国际花卉节上,我国首次在来自缅甸的盆景植物上检疫到了西花蓟马[23],2003年在北京市郊的温室大棚中首次发现其严重危害辣椒[4],目前已在我国北京、山东[24]、贵州[25]、湖南[26]、江苏[27]、新疆[28]、西藏[29]、四川[30]及河北、山西、内蒙古、辽宁、吉林、黑龙江、河南、云南、陕西、甘肃、宁夏[9,31]19个省(自治区、直辖市)发生危害。其中温室品系在上述19个省(自治区、直辖市)发生危害,而羽扇豆品系目前仅在北京、山东、辽宁、吉林、黑龙江、云南、陕西、宁夏、甘肃9个省(自治区、直辖市)有发现[8-9,31]。西花蓟马个体微小,雌成虫体长1.4—1.7 mm,雄成虫体长1—1.15 mm,且体色多变[21,32]。有研究认为,深色型的西花蓟马更有可能是羽扇豆品系[1]。然而,鉴于烟蓟马()的体色变化与温度有关,温度越低、体色越深[33];因此,多数学者认为温度应该是昆虫体色变化的主要诱因[34]。显然,基于成虫外部特征的传统形态学鉴定法无法满足植物检疫和检测监测的基本需求,尤其当样本为幼体或残体时。基于mtDNA COI[1-2,8-9,11,35]和COII基因[11]、rDNA 28S D2基因[1,8],以及基于核蛋白编码基因[1]等标记技术,曾用于西花蓟马温室品系和羽扇豆品系的识别鉴定。【本研究切入点】然而上述标记技术,或鉴定流程复杂、成本较高,或鉴定结果不稳定、重复性差。如基于COI和COII基因标记的鉴定技术,需要对PCR产物进行碱基序列测定以及系统发育分析[1-2,24,29-31];基于rDNA 28S D2基因的品系特异性检测,虽然无需碱基序列测定和系统发育分析[1],但实际应用中却发现重复性差,无法扩增出理想的品系特异性靶标片段。【拟解决的关键问题】以西花蓟马温室品系和羽扇豆品系为靶标,以田间常见的其他14种蓟马为参照,采用基于线粒体DNA细胞色素C氧化酶亚基I(mitochondrial DNA cytochrome c oxidase subunit I,mtDNA COI)基因的种特异性(species-specific COI,SS-COI)PCR法,研究建立西花蓟马品系特异性一步双重快速检测技术体系。
1 材料与方法
试验于2017年7月至2019年2月在中国农业科学院植物保护研究所完成。
1.1 供试虫源
西花蓟马温室品系和羽扇豆品系为室内饲养种群,田间常见的其他14种蓟马包括花蓟马(Frankliniella intonsa)、禾花蓟马(Frankliniella tenuicornis)、黄胸蓟马(Thrips hawaiiensis)、大蓟马(Thrips major)、棕榈蓟马(Thrips palmi)、烟蓟马、普通大蓟马(Megalurothrips usitatus)、豆喙蓟马(Mycterothrips glycines)、草木樨近绢蓟马(Sussericothrips melilotus)、蔗腹齿蓟马(Fulmekiola serrata)、稻简管蓟马(Haplothrips aculeatus)、榕端宽管蓟马(Mesothrips jordani)、榕母管蓟马(Gynaikothrips ficorum)和横纹蓟马(Aeolothrips fasciatus)均采自田间,具体信息详见表1。
1.2 DNA提取
以西花蓟马温室品系和羽扇豆品系以及田间常见的其他14种蓟马为对象,取单头雌成虫,参照乔玮娜等[36]的方法提取DNA,以20 μL超纯水复溶,充分溶解后以超微量分光光度计(NanoPhotometerTMP330,Implen,Munich,Germany)测定DNA浓度,-20℃保存备用。
1.3 COI基因扩增与序列测定
分别以西花蓟马温室品系、羽扇豆品系,以及上述14种其他蓟马共16种/品系蓟马DNA为模板,以DNA条形码通用型引物LCO1490(GGTCAACAAAT CATAAAGATATTGG),HCO2198(TAAACTTCAGG GTGACCAAAAAATCA)[37]进行PCR扩增,扩增片段大小约为710 bp。PCR反应体系为25 μL,其中DNA模板2 μL,上游引物和下游引物各0.5 μL,10×Buffer 2.5 μL,dNTPs(2.5 mmol·L-1)0.5 μL,TaqDNA聚合酶(5 U·μL-1)0.2 μL,ddH2O补足至25 μL。扩增条件:94℃预变性5 min;94℃ 30 s,51℃ 30 s,72℃ 1 min,35个循环;72℃延伸5 min。取5 μL扩增产物,加1 μL上样缓冲液,以DNA Marker为参照,在含有染色剂Gel stain(北京全式金生物技术有限公司)的1%琼脂糖凝胶上进行电泳分离25 min(150 V),以凝胶成像系统(Gel DocTMXR+Imaging System Universal Hood II,Bio-Rad,USA)分析检测结果;每种蓟马分别检测10头。电泳检测质量合格的PCR产物,直接送生工生物工程(上海)股份有限公司进行双向碱基序列测定。

表1 蓟马样本信息
1.4 一步双重品系特异性引物设计、筛选与体系优化
DNAMAN(DNAMAN Version 9)比对分析显示,西花蓟马两个品系的碱基序列相似度为96.67%,碱基差异位点19个。以本研究获得的其他14种蓟马以及数据库中已公开的蓟马COI基因序列(包括西花蓟马所有单倍型)为参照,在两个品系所有单倍型碱基序列相似度比较高的区段设计通用上游引物和通用下游引物各1条;然后,在两个品系所有单倍型碱基序列差异位点比较集中且差异位点在同一品系不同单倍型间较保守的区段,分别靶向温室品系和羽扇豆品系,设计6条品系特异性上游引物和3条品系特异性下游引物。即品系通用引物共计2条,其中品系通用上游引物1条,品系通用下游引物1条,分别命名为TF6和TR3。品系特异性引物共计18条,其中温室品系特异性上游引物6条、下游引物3条,分别命名为GF1-GF6和GR1-GR3;羽扇豆品系特异性上游引物6条、下游引物3条,分别命名为LF1-LF6和LR1-LR3;并据此构建一步双重PCR反应体系。体系构建时引物组合方式为,1条通用上游引物与2条特异性下游引物(温室品系和羽扇豆品系各1条)或1条通用下游引物与2条特异性上游引物(温室品系和羽扇豆品系各1条)组合,共计获得组合45种。其中30种组合对两个品系的扩增片段大小基本一致,其混合扩增产物无法在凝胶电泳上有效分离,不符合一步双重PCR快速检测的基本要求[38],予以舍弃。对其余15种引物组合进行品系特异性预实验验证和引物优化(基于特异性引物设计中GC含量需>40%的原则,进行AT→GC碱基转换。优化后品系特异性下游引物,温室品系命名为GR32,羽扇豆品系命名为LR12;优化后品系特异性上游引物,温室品系命名为GF62,羽扇豆品系命名为LF52)以及再验证,对优化后依然不能进行品系特异性扩增的引物组合予以舍弃,最终确定TF6/GR32/LR12为西花蓟马品系特异性一步双重PCR检测的最佳引物组合,其对温室品系和羽扇豆品系的特异性扩增片段大小分别为362和541 bp(表2)。然后,以该组合引物为靶标进行引物比例和退火温度优化。

表2 西花蓟马品系特异性引物序列及扩增产物
1.5 一步双重品系特异性PCR检测体系的建立与优化
为确定一步双重品系特异性PCR检测的最佳反应体系,对组合引物的比例和退火温度进行优化研究。PCR反应体系为25 μL,引物组合共计11种,即TF6/GR32/LR12分别以1.0/0/1.0、1.0/0.1/0.9、1.0/0.2/0.8、1.0/0.3/0.7、1.0/0.4/0.6、1.0/0.5/0.5、1.0/0.6/0.4、1.0/0.7/0.3、1.0/0.8/0.2、1.0/0.9/0.1、1.0/1.0/0 μL的比例进行组合(引物浓度为10 μmol·L-1),10×Buffer 2.5 μL,dNTPs(2.5 mmol·L-1)0.5 μL,Taq DNA聚合酶(5 U·μL-1)0.2 μL,DNA模板1 μL,ddH2O补足至25 μL。扩增条件:94℃预变性5 min;94℃ 30 s,梯度退火温度(36—54℃)1 min,72℃ 1 min,35个循环;72℃延伸5 min。电泳检测方法同1.3。
1.6 品系特异性组合引物的种/品系特异性检测
分别以西花蓟马温室品系和羽扇豆品系以及其他14种田间常见蓟马DNA为模板,以优化的反应体系进行PCR扩增,检测组合引物的种/品系特异性。PCR反应体系为25 μL,其中10×Buffer 2.5 μL,dNTPs(2.5 mmol·L-1)0.5 μL,最佳配比组合引物TF6/GR32/LR12共计2.0 μL,Taq DNA聚合酶(5 U·μL-1)0.2 μL,DNA模板1 μL,ddH2O补足至25 μL。扩增条件:94℃ 5 min;94℃ 30 s,最佳退火温度 1 min,72℃ 1 min,35个循环;72℃延伸5 min。电泳检测方法同1.3。每种/品系蓟马分别检测10头。
1.7 品系特异性组合引物对不同虫态的扩增效果
以品系特异性组合引物为靶标,以提取的单一品系不同虫态(卵、1龄和2龄幼虫、预蛹和蛹)与不同性别(雄成虫、雌成虫)DNA,以及混合品系(1﹕1)各虫态/性别DNA为模板,进行PCR扩增,电泳检测方法同1.3。每种性别或虫态分别检测10头。
1.8 品系特异性组合引物的检测阈值
分别取两个品系单头雌成虫DNA模板10 μL,以2倍递减梯度稀释至2-12倍,其中温室品系初始DNA模板浓度为(18.38±5.40)×103pg·μL-1,最终稀释浓度为4.49 pg·μL-1;羽扇豆品系初始DNA模板浓度为(18.81±5.71)×103pg·μL-1,最终稀释浓度为4.59 pg·μL-1。分别取1 μL作为DNA模板进行PCR扩增,电泳检测方法同1.3。分别检测10头。
1.9 不同地理种群西花蓟马的检测
以采自我国宁夏、陕西、山东、甘肃、吉林、云南、北京、河北8个省(自治区、直辖市)10个不同地区的西花蓟马(表3)成虫DNA(1 μL)为模板,以品系特异性组合引物TF6/GR32/LR12进行PCR扩增,电泳检测方法同1.3。根据标本采集获得情况,每个地理种群分别检测2—25头。电泳检测质量合格的PCR产物,送生工生物工程(上海)股份有限公司进行碱基序列测定。然后,用DnaSP 5.10软件分析不同地理种群西花蓟马的单倍型组成。
2 结果
2.1 蓟马类昆虫线粒体DNA COI基因序列扩增与分析
以西花蓟马温室品系和羽扇豆品系及其他14种田间常见蓟马DNA为模板,以DNA条形码通用型引物 LCO1490/HCO2198进行PCR扩增。电泳检测结果显示,16种/品系蓟马均能扩增出一条清晰的靶标片段(图1),扩增片段大小为629—681 bp,与数据库中对应蓟马种类的碱基序列同源性为98.7%—100%。表明所有蓟马种类的mtDNA提取无误,可以用于后续PCR扩增反应。

表3 不同地理种群西花蓟马样本信息
2.2 一步双重品系特异性PCR检测体系建立
2.2.1 组合引物比例的优化 以筛选出的品系通用上游引物TF6以及温室品系特异性下游引物GR32和羽扇豆品系特异性下游引物LR12为靶标,设置不同比例的引物组合,以两个品系DNA为模板分别进行PCR扩增。结果显示,当组合引物TF6/GR32/LR12以1.0/0.2/0.8的比例进行组合时,无论是温室品系(图2-A)还是羽扇豆品系(图2-B)均能扩增出清晰的靶标条带。
2.2.2 退火温度的优化 分别以两个品系DNA为模板,以优化后的品系特异性引物组合(TF6/GR32/LR12配比为1.0/0.2/0.8),比较36—54℃不同退火温度下的扩增效果。结果显示,当退火温度为44℃时,扩增效果最好,扩增出的分别靶向温室品系(图3-A)或羽扇豆品系(图3-B)的特异性条带最为清晰。

M:标准DNA分子质量 DNA ladder;1:西花蓟马温室品系F. occidentalis greenhouse race;2:西花蓟马羽扇豆品系F. occidentalis lupin race;3:花蓟马F. intonsa;4:禾花蓟马F. tenuicornis;5:黄胸蓟马T. hawaiiensis;6:大蓟马T. major;7:棕榈蓟马T. palmi;8:烟蓟马T. tabaci;9:普通大蓟马M. usitatus;10:豆喙蓟马M. glycines;11:草木樨近绢蓟马S. melilotus;12:蔗腹齿蓟马F. serrata;13:稻简管蓟马H. aculeatus;14:榕端宽管蓟马M. jordani;15:榕母管蓟马G. ficorum;16:横纹蓟马A. fasciatus;17:阴性对照(模板为超纯水)negative control (ultrapure water)

M:标准DNA分子质量 DNA ladder;1—11:TF6/GR32/LR12比例分别为The ratios of TF6/GR32/LR12 are 1.0/0/1.0, 1.0/0.1/0.9, 1.0/0.2/0.8, 1.0/0.3/0.7, 1.0/0.4/0.6, 1.0/0.5/0.5, 1.0/0.6/0.4, 1.0/0.7/0.3, 1.0/0.8/0.2, 1.0/0.9/0.1, and 1.0/1.0/0 μL, respectively;12:阴性对照(模板为超纯水)negative control (ultrapure water)
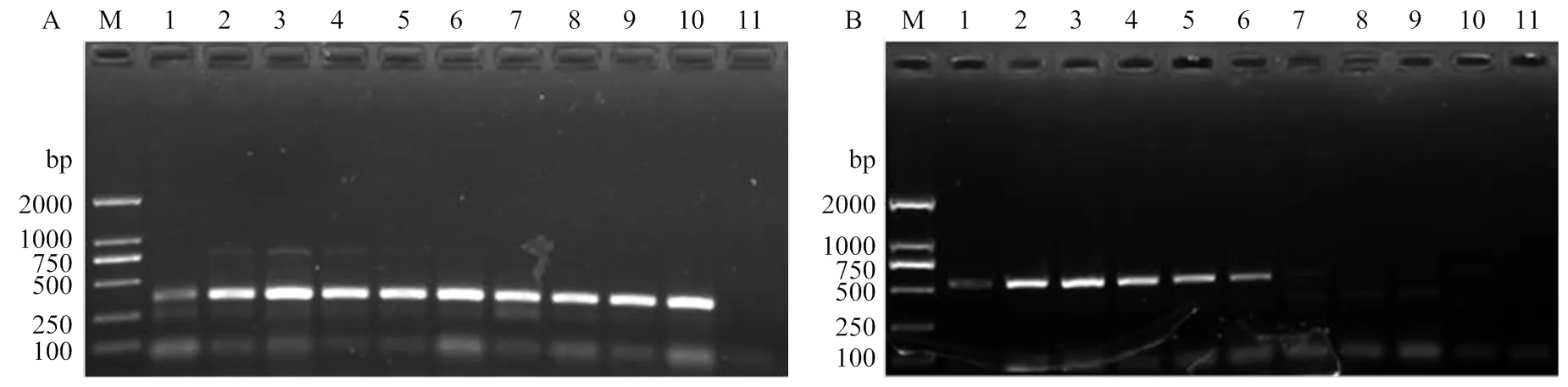
M:标准DNA分子质量 DNA ladder;1—10:退火温度分别为 Annealing temperatures are 36, 38, 40, 42, 44, 46, 48, 50, 52, 54℃, respectively;11:阴性对照(模板为超纯水)negative control (ultrapure water)
2.3 组合引物的种/品系特异性检验
以西花蓟马温室品系和羽扇豆品系以及田间常见的其他14种蓟马DNA为模板,以优化的一步双重PCR反应体系,检验组合引物TF6/GR32/LR12的种/品系特异性。电泳检测结果显明,该组合引物的特异性强,当以温室品系为靶标时,只扩增出362 bp的温室品系特异性条带,当以羽扇豆品系为靶标时,只扩增出541 bp的羽扇豆品系特异性条带,对田间常见的其他14种蓟马没有扩增效果(图4),表明该组合引物为西花蓟马的品系特异性引物。
2.4 品系特异性组合引物对不同虫态的扩增效果
分别以单一品系不同虫态(卵、1龄和2龄幼虫、预蛹和蛹)和不同性别(雄成虫、雌成虫)DNA,以及混合品系(1﹕1)各虫态/性别DNA为模板,以品系特异性组合引物TF6/GR32/LR12进行一步双重PCR扩增。电泳检测结果显示,当以单一品系DNA为模板时,温室品系各虫态/性别均能稳定扩增出清晰的362 bp特异性条带,羽扇豆品系各虫态/性别均能稳定扩增出清晰的541 bp特异性条带(图5-A);当以混合品系DNA为模板时,各虫态/性别均能稳定地同时扩增出分别靶向温室品系和羽扇豆品系的特异性条带(图5-B)。
2.5 品系特异性组合引物的检测阈值
分别以不同浓度西花蓟马温室品系和羽扇豆品系的雌成虫DNA为模板,进行最低检测阈值测定。结果表明,当以温室品系为检测靶标时,其最低检测浓度为35.90 pg·μL-1,相当于1/10 240头雌成虫(图6-A);当以羽扇豆品系为检测靶标时,其最低检测浓度为146.95 pg·μL-1,相当于1/2 560头雌成虫(图6-B)。
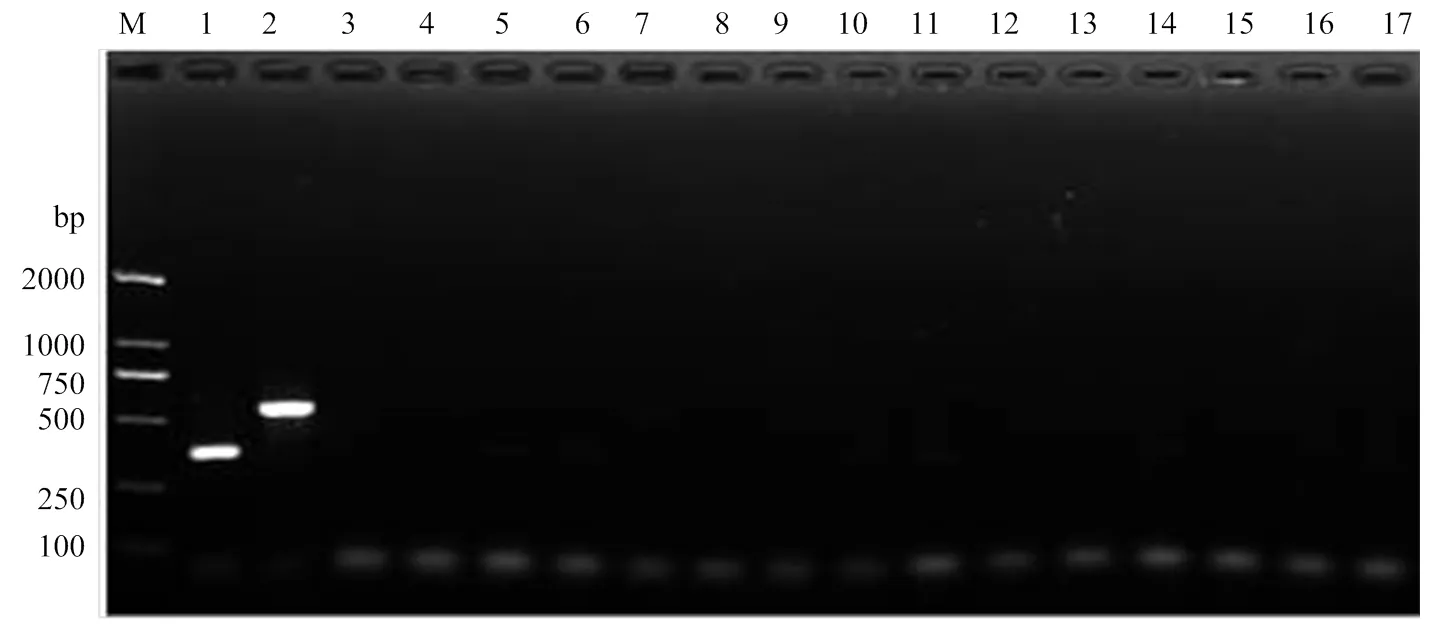
M:标准DNA分子质量DNA ladder;1:西花蓟马温室品系F. occidentalis greenhouse race;2:西花蓟马羽扇豆品系F. occidentalis lupin race;3:花蓟马F. intonsa;4:禾花蓟马F. tenuicornis;5:黄胸蓟马T. hawaiiensis;6:大蓟马T. major;7:棕榈蓟马T. palmi;8:烟蓟马T. tabaci;9:普通大蓟马M. usitatus;10:豆喙蓟马M. glycines;11:草木樨近绢蓟马S. melilotus;12:蔗腹齿蓟马F. serrata;13:稻简管蓟马H. aculeatus;14:榕端宽管蓟马M. jordani;15:榕母管蓟马G. ficorum;16:横纹蓟马A. fasciatus;17:阴性对照(模板为超纯水)negative control (ultrapure water)
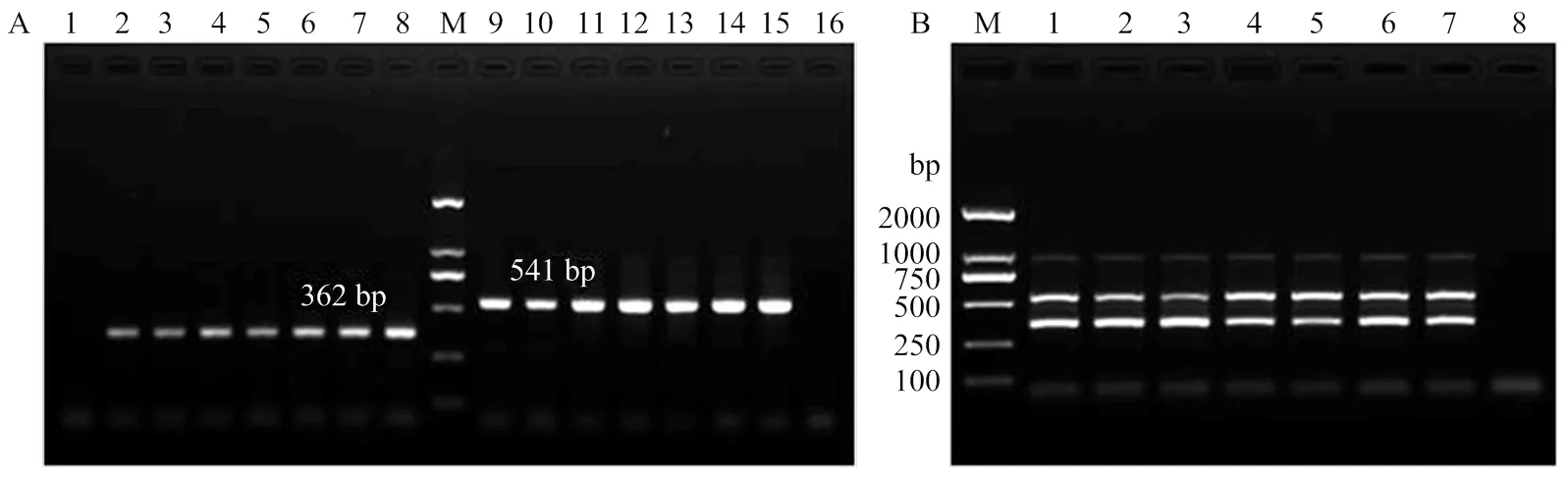
A:单一品系Single race;2—8:温室品系Greenhouse race;9—15:羽扇豆品系lupin race;M:标准DNA分子质量DNA ladder;2、9:卵egg;3、10:1龄幼虫1st instar larva;4、11:2龄幼虫2nd instar larva;5、12:预蛹pre-pupa;6、13:蛹pupa;7、14:雄成虫male adult;8、15:雌成虫female adult;1、16:阴性对照(模板为超纯水)negative control (ultrapure water)。B:混合品系Mixed races;M:标准DNA分子质量DNA ladder;1:卵egg;2:1龄幼虫1st instar larva;3:2龄幼虫2nd instar larva;4:预蛹pre-pupa;5:蛹pupa;6:雄成虫male adult;7:雌成虫female adult;8:阴性对照(模板为超纯水)negative control (ultrapure water)
2.6 不同地理种群西花蓟马的检测鉴定
以采自我国8个省(自治区、直辖市)10个不同地区的127头西花蓟马成虫DNA为模板,以品系特异性组合引物TF6/GR32/LR12进行PCR扩增。检测结果显示,各地理种群均能扩增出或靶向温室品系(362 bp)、或靶向羽扇豆品系(541 bp)的COI基因片段,部分种群个体(10个地理种群45个个体)电泳检测结果如图7所示。其中,114头被鉴定为温室品系,来自全部10个地理种群;13头被鉴定为羽扇豆品系,分别来自宁夏银川、陕西宝鸡、山东烟台、吉林四平和吉林长春。进一步的碱基序列测定和比对分析显示,温室品系和羽扇豆品系的碱基序列与数据库中对应品系碱基序列的同源性分别为98.33%—100%和98.34%—100%;品系单倍型分析结果表明,114头温室品系包含有3种单倍型,13头羽扇豆品系包含有2种单倍型(表4)。
3 讨论
蓟马类为小型昆虫,其物种鉴别主要依据成虫外部形态特征,对于非专业从事蓟马分类的人员而言难以实现,而近年来随着分子生物学技术的迅速发展,这一难题迎刃而解。目前,已有多种DNA标记技术用于蓟马类昆虫的识别与鉴定,包括随机多态性DNA(random amplified polymorphic DNA,RAPD)标记技术[39]、基于线粒体DNA COI/COII/COIII基因的DNA序列测序法[40-42]、基于COI和ITS-1/ITS-2序列的限制片段长度多态性(restriction fragment length polymorphism,RFLP)标记技术[40,43-45]、特征序列扩增区域(sequence characterized amplified regions,SCAR)标记技术[46]、种特异性PCR(species-specific PCR,SSP)扩增技术[47-48]、实时荧光定量PCR(real-time quantitative PCR,qPCR)技术[49-51]、DNA条形码技术[35-36,52-54]、基因芯片技术[55]等,并取得了显著成效。其中,基于线粒体DNA COI基因的DNA条形码技术在蓟马类以及其他昆虫类群的识别鉴定中起到了重要作用[56-57]。

A:温室品系 Greenhouse race;M:标准DNA分子质量 DNA ladder;1—13:18.38×103, 9.19×103, 4.60×103, 2.30×103, 1.15×103, 574.38, 287.19, 143.59, 71.80, 35.90, 17.95, 8.97, and 4.49 pg·μL-1, respectively;14:阴性对照(模板为超纯水)negative control (ultrapure water)。B:羽扇豆品系 Lupin race;M:标准DNA分子质量 DNA ladder;1—13:18.81×103, 9.41×103, 4.70×103, 2.35×103, 1.18×103, 587.81, 293.91, 146.95, 73.48, 36.74, 18.37, 9.18, and 4.59 pg·μL-1, respectively;14:阴性对照(模板为超纯水)negative control (ultrapure water)

M:标准DNA分子质量 DNA ladder;1—5:银川YC;6—10:宝鸡BJI;11—15:烟台YT;16—20:敦煌DH;21、22:四平SP;24—28:长春CC;29—33:临沧LC;34—38:兰州LZ;39—43:延庆YQ;44—46:廊坊LF;23、47:阴性对照(模板为超纯水)negative control (ultrapure water)

表4 基于mtDNA COI基因的各单倍型在西花蓟马10个地理种群中的分布
线粒体DNA为多拷贝基因,具有分子量小、进化速度快、遗传自主性和严格的母系遗传等特性,基于线粒体DNA细胞色素C氧化酶亚基Ⅰ(mtDNA COI)基因的DNA条形码技术即由此发展而来[58],目前已广泛应用于个体识别鉴定、生物分类,以及分子进化、遗传结构和亲缘关系分析等[56-57]。本研究采用基于线粒体DNA COI基因的SS-COI标记技术,研发出了靶向西花蓟马温室品系和羽扇豆品系的一步双重特异性组合引物TF6/GR32/LR12及其快速检测鉴定方法。该组合引物特异性强,只对西花蓟马的温室品系和羽扇豆品系具有扩增效果,只需一步PCR反应,即可获得分别靶向温室品系(362 bp)和羽扇豆品系(541 bp)的特异性条带,对田间常见的14种其他种类蓟马(包括两种花蓟马属蓟马)不具有扩增能力(图4)。同时,该技术体系的检测灵敏性高,无论单一品系还是混合品系,既对成虫具有良好的扩增效果,也对单粒卵、初孵幼虫、2龄幼虫、预蛹及蛹具有同样的扩增效能(图5);靶向温室品系,其最低检测阈值为35.90 pg·μL-1,相当于1/10 240头雌成虫,靶向羽扇豆品系其最低检测阈值为146.95 pg·μL-1,相当于1/2 560头雌成虫(图6)。进一步的田间样本检测分析显示,该技术体系能快速鉴定出来自不同省(自治区、直辖市)的西花蓟马(包括不同的单倍型)所属的品系类型。此外,数据库同源性比对分析结果表明,没有任一同属()近缘种蓟马(包括东方花蓟马、花蓟马、首花蓟马、禾花蓟马、佛罗里达花蓟马、褐花蓟马、梳缺花蓟马、澳洲花蓟马、西印花蓟马、单色花蓟马,以及、、、、、、、、等19种)或其他种类的蓟马或昆虫的DNA序列与西花蓟马温室品系或羽扇豆品系特有的362 bp(同源性<88%)或541 bp(同源性<85%)片段完全一致,显示该技术体系完全可用于西花蓟马品系的快速鉴定,以及国际国内农产品(包括水果、蔬菜和花卉)贸易或调运过程中的检验检疫和监管。同时,还可用于指导田间西花蓟马品系靶向性防控措施的制定,如靶向抗性比较强的温室品系单优地域种群[3],应少用或不用化学农药;而靶向品系混发地域种群,应采用剂量控制、合理用药(轮用、混用等)等措施,延缓抗药性产生。此外,两个品系在危害程度、传播病毒能力等方面是否存在差异,尚不得而知,而本研究的品系特异性快速检测技术体系的建立,为单一品系种群建立及其后续研究提供了技术支撑。
一步多重PCR(multiplex PCR)又称多重引物PCR或复合PCR,是指在同一PCR反应体系中添加两对以上引物,同时扩增出多个核酸片段的PCR反应,且每对引物只对应一个靶标片段[59],与常用的RAPD技术(一对引物对应多个扩增产物)[38]全然不同。多重PCR技术可用于病原微生物、昆虫、软体动物等的检测鉴定,所用的靶标基因主要有COI基因、16S rDNA基因[60-64]和ITS基因[65]等。如基于16S rDNA[60-61]、EF1[66]等基因的一步双重/多重PCR技术常用于细菌鉴定;基于病毒保守基因(DNA/RNA)的一步多重PCR技术常用于5种病毒的快速检测[67-68]。同时,多重PCR技术在外来入侵种的检测监测中亦发挥了重要作用[69]。如Zhang等[70]基于SCAR标记技术,研究构建了靶向烟粉虱()B隐种和西花蓟马的一步双重快速检测鉴定技术体系,只需一步PCR反应,即可将两种同域发生的重大入侵种区分开,无需碱基序列测定和比对分析;Kurata等[61]以COI基因为靶标构建一步多重PCR扩增体系,只需一步扩增反应即可有效区分入侵种烟粉虱(MEAM1,MED Q1,MED Q2隐种)和本地种烟粉虱(Asia II 6隐种);Nakamura等[63]以COI基因为靶标构建了一步多重PCR引物组合体系,用以快速鉴定5种斑潜蝇属()害虫(包括、葱斑潜蝇、南美斑潜蝇、美洲斑潜蝇和三叶草斑潜蝇等),并且针对美洲斑潜蝇存在隐存种或进化支的现象,分别设计了靶向支系A和L的特异性上游引物,与潜蝇属通用下游引物组合成新的多重PCR引物组合,用于鉴定美洲斑潜蝇的3个隐存种,取得了预期效果;Cooke等[62]以COI基因为靶标构建多重PCR技术体系,无需测序即可快速鉴别入侵种福寿螺()与当地两种同属近缘种蜗牛,即淡水苹果蜗牛()和。基于SS-PCR技术的种特异性一步双重/多重PCR检测鉴定技术,只需一步PCR扩增反应,即可根据靶标片段的大小快速地鉴定物种,无需碱基序列测定与比对分析,具有操作简便,经济、高效、系统性强等特性,适用于区分近缘种、隐存种等[38]。
本研究研发的一步双重品系特异性SS-COI组合引物TF6/GR32/LR12及其快速检测技术体系,提高了西花蓟马温室品系和羽扇豆品系检测鉴定的准确性和灵敏度,节约了检测时间,在西花蓟马品系检测监测及其靶向性防控中具有重要应用价值。将本研究获得的靶标序列与数据库中已有序列进行同源性比对,结果显示,本研究温室品系的靶标片段与数据库[71]中温室品系其他单倍型(105种)的同源性为98.33%—100%,与羽扇豆品系(包括不同的单倍型)的同源性为95.03%—96.13%,而与其他近缘种的同源性<87.68%;本研究羽扇豆品系的靶标片段与数据库中羽扇豆品系其他单倍型(104种)的同源性为98.34%—100%,与温室品系(包括不同的单倍型)的同源性为96.12%—96.30%,而与其他近缘种的同源性<84.73%。表明该检测技术完全可以用于西花蓟马的温室品系或羽扇豆品系鉴定,并且在同一品系不同单倍型间具有较好的通用性,在不同品系之间具有良好的特异性(图7)。不过蓟马类昆虫种类比较多,且同一种类(如西花蓟马)包含多种单倍型,有一些常见的种类/种群/单倍型本研究没有涉及,因此该组合引物的特异性,尤其靶向同一品系不同单倍型的通用性以及靶向不同品系不同单倍型的特异性,还需进一步验证;而有关该组合引物对温室品系和羽扇豆品系最低检测阈值的差异,可能与其扩增的两个品系靶标片段的大小不同有关。
4 结论
采用种特异性SS-COI标记法建立了西花蓟马品系一步双重特异性快速检测鉴定技术体系。该检测鉴定技术体系特异性强,仅对西花蓟马的温室品系和/或羽扇豆品系具有扩增能力,对田间常见的其他14种蓟马不具有扩增效能。灵敏度高,无论单一品系还是混合品系,或同一品系不同单倍型,不仅对成虫、预蛹和蛹具有良好的扩增效果,对单粒卵、1龄和2龄幼虫亦具有同等的扩增能力;对温室品系的最低检测阈值为35.90 pg·μL-1,相当于1/10 240头雌成虫,对羽扇豆品系的最低检测阈值为146.95 pg·μL-1,相当于1/2 560头雌成虫。该检测鉴定技术体系的建立对西花蓟马的检疫监管、有效阻截西花蓟马两个品系的进一步传播扩散及其靶向性防控措施制定具有重要意义。
[1] Rugman-Jones P F, Hoddle M S, Stouthamer R. Nuclear-mitochondrial barcoding exposes the global pest western flower thrips (Thysanoptera: Thripidae) as two sympatric cryptic species in its native California., 2010, 103(3): 877-886.
[2] Brunner P C, Frey J E. Habitat-specific population structure in native western flower thrips(Insecta, Thysanoptera)., 2010, 23(4): 797-804.
[3] Martin N A, Workman P J. Confirmation of a pesticide- resistant strain of western flower thrips in New Zealand//, 1994: 144-148.
[4] 张友军, 吴青君, 徐宝云, 朱国仁. 危险性外来入侵生物——西花蓟马在北京发生危害. 植物保护, 2003, 29(4): 58-59.
ZHANG Y J, WU Q J, XU B Y, ZHU G R. Dangerous alien invasive species-western flower thrips occur and damage in Beijing., 2003, 29(4): 58-59. (in Chinese)
[5] LOOMANS A J M, VAN LENTEREN J C. Biological control of thrips pests: a review on thrips parasitoids//, 1995, 95(1): 89-201.
[6] MORITZ G. The biology of thrips is not the biology of their adults: a developmental view//:Australian National Insect Collection, Canberra, 2002: 259-267.
[7] 武晓云, 程晓非, 张仲凯, 桂富荣, 李正跃. 西花蓟马() rDNA ITS2和COI基因5末端序列的克隆与比较分析. 浙江大学学报(农业与生命科学版), 2009, 35(4): 355-364.
WU X Y, CHENG X F, ZHANG Z K, GUI F R, LI Z Y. Cloning and comparative analysis of rDNA ITS2 and 5 terminal sequence of COI gene of., 2009, 35(4): 355-364. (in Chinese)
[8] Yang X M, Sun J T, Xue X F, Li J B, Hong X Y. Invasion genetics of the western flower thrips in China: evidence for genetic bottleneck, hybridization and bridgehead effect., 2012, 7(4): e34567.
[9] 张桂芬, 乔玮娜, 古君伶, 闵亮, 万方浩. 我国西花蓟马线粒体DNA-COI基因变异及群体遗传结构分析. 生物安全学报, 2014, 23(3): 196-209.
ZHANG G F, QIAO W N, GU J L, MIN L, WAN F H. Genetic variability of mtDNA COI and population structure of(Pergande) in China., 2014, 23(3): 196-209. (in Chinese)
[10] 沈登荣, 宋文菲, 袁盛勇, 田学军, 和绍禹, 张宏瑞. 基于mtDNA-COI的云南西花蓟马的遗传分析. 植物保护, 2014, 40(5): 75-79.
SHEN D R, SONG W F, YUAN S Y, TIAN X J, HE S Y, ZHANG H R. Genetic analysis ofbased on mtDNA-COI in Yunnan, China., 2014, 40(5): 75-79. (in Chinese)
[11] 田虎, 张蓉, 王玉生, 万方浩, 张桂芬. 基于线粒体I和II基因的5种不同寄主植物西花蓟马种群遗传多样性研究. 植物保护, 2018, 44(1): 27-36.
TIAN H, ZHANG R, WANG Y S, WAN F H, ZHANG G F. Genetic diversity among five different host plant populations of(Pergande) based onI andII gene sequences., 2018, 44(1): 27-36. (in Chinese)
[12] Nielsen M C, Teulon D A, Chapman R B, Butler R C, Drayton G M, Philipsen H. Comparison of life history parameters of two(Thysanoptera: Thripidae) strains in New Zealand., 2010, 39(2): 303-311.
[13] Bryan D E, Smith R F. The(Pergande) complex in California., 1956, 10(6): 359-410.
[14] Argaman Q, Klein Z, Ben-Dov Y, Mendel Z.(Thysanoptera: Thripidae), an injurious intruder., 1989, 69(7): 1268-1269.
[15] Giliomee J H. First record of western flower thrips,(Pergande) (Thysanoptera: Thripidae) from South Africa., 1989, 52(1): 179-182.
[16] Fauziah I, Saharan H A.. Asian Vegetable Research and Development Center Publication, 1991: 29-33.
[17] Ohta I. Host plant resistance in Japanese chrysanthemums against(Thysanoptera: Thripidae) during the non-flowering stage., 2002, 37(2): 271-277.
[18] Malipatil M B, Postle A C, Osmelak J A, Hill M, Moran J. First record of(Pergande) in Australia (Thysanoptera: Thripidae)., 1993, 32: 378.
[19] Chung B K, Kang S W, Kwon J H. Chemical control system of(Thysanoptera: Thripidae) in greenhouse eggplant., 2000, 3(1): 1-9.
[20] Tyagi K, Kumar V. First report of western flower thrips,(Pergande) (Thripidae: Thysanoptera) from India- a potential Havoc to Indian agriculture., 2015, 6: 1-3.
[21] Kirk W D J, Terry L I. The spread of the western flower thrips(Pergande)., 2003, 5(4): 301-310.
[22] Wan F H, Yang N W. Invasion and management of agricultural alien insects in China., 2016, 61: 77-98.
[23] 蒋小龙, 白松, 肖枢, 杨碧. 为中国昆明国际花卉节把关服务. 植物检疫, 2001, 15(2): 115-117.
JIANG X L, BAI S, XIAO S, YANG B. Inspection and quarantine service for Kunming International Flower Festival, China., 2001, 15(2): 115-117. (in Chinese)
[24] 郑长英, 刘云虹, 张乃芹, 赵希丽. 山东省发现外来入侵有害生物—西花蓟马. 青岛农业大学学报(自然科学版), 2007, 24(3): 172-174.
ZHENG C Y, LIU Y H, ZHANG N Q, ZHAO X L. Invaded insect pest-first reported in Shandong province., 2007, 24(3): 172-174. (in Chinese)
[25] 袁成明, 郅军锐, 李景柱, 张勇. 贵州省蔬菜蓟马的种类、分布及综合防治. 湖北农业科学, 2008, 47(12): 1442-1444.
YUAN C M, ZHI J R, LI J Z, ZHANG Y. The distribution and integrated management of vegetables thrips in Guizhou Province., 2008, 47(12): 1442-1444. (in Chinese)
[26] 刘佳, 张林, 卢焰梅, 张宏瑞. 湖南外来入侵害虫西花蓟马初步调查. 安徽农业科学, 2010, 38(25): 13800-13801, 13804.
LIU J, ZHANG L, LU Y M, ZHANG H R. Preliminary investigation of invasive pest ofin Hunan Province., 2010, 38(25): 13800-13801, 13804. (in Chinese)
[27] 严丹侃, 汤云霞, 贺子义, 孙雷, 王鸣华, 薛晓峰, 范加勤. 南京地区西花蓟马发生调查及其分子检测. 南京农业大学学报, 2010, 33(4): 59-63.
YAN D K, TANG Y X, HE Z Y, SUN L, WANG M H, XUE X F, FAN J Q. Survey in Nanjing and the PCR diagnosis of., 2010, 33(4): 59-63. (in Chinese)
[28] 杨华, 崔元玗, 张升, 孙晓军. 外来入侵害虫——西花蓟马在新疆的发生危害. 新疆农业科学, 2010, 47(11): 2252-2253.
YANG H, CUI Y Y, ZHANG S, SUN X J. The occurrence and damage of the exotic invasive pest: western flower thrip () in Xinjiang., 2010, 47(11): 2252-2253. (in Chinese)
[29] 王海鸿, 雷仲仁, 李雪, 代安国, 陈翰秋. 西藏发现重要外来入侵害虫——西花蓟马. 植物保护, 2013, 39(1): 181-183.
WANG H H, LEI Z R, LI X, DAI A G, CHEN H Q. An important invasive pest,, inspected in Tibet., 2013, 39(1): 181-183. (in Chinese)
[30] 董华芳, 周正东, 许延波, 张晓云, 张旭东, 刘永碧. 不同颜色粘虫板对西昌市草莓西花蓟马的集诱效果比较. 安徽农业科学, 2018, 46(19): 156-158.
DONG H F, ZHOU Z D, XU Y B, ZHANG X Y, ZHANG X D, LIU Y B. Comparison of trapping effect of different color sticky board on strawberryin Xichang., 2018, 46(19): 156-158. (in Chinese)
[31] 田虎. 基于mtDNA、和rDNA多基因条形码的西花蓟马鉴定及遗传结构研究[D]. 北京: 中国农业科学院, 2017.
TIAN H. Molecular identification and genetic structure of(Pergande) based on multiple gene barcoding, mtDNA,and rDNAmarkers[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. (in Chinese)
[32] 雷仲仁, 问锦曾, 王音. 危险性外来入侵害虫——西花蓟马的鉴别、危害及防治. 植物保护, 2004, 30(3): 63-66.
LEI Z R, WEN J Z, WANG Y. The identification, prevention and harm of dangerous invasive alien pests—western flower thrips., 2004, 30 (3): 63-66. (in Chinese)
[33] Murai T, Toda S. Variation ofin colour and size//:, 2002: 377-378.
[34] Protas M E, Patel N H. Evolution of coloration patterns., 2008, 24: 425-446.
[35] 田虎, 张蓉, 张金良, 王玉生, 万方浩, 张桂芬. 入侵种西花蓟马与本地近缘种花蓟马的双基因鉴定. 中国生物防治学报, 2017, 33(5): 612-622.
TIAN H, ZHANG R, ZHANG J L, WANG Y S, WAN F H, ZHANG G F. Identification of invasive speciesand native speciesbased on double gene markers., 2017, 33(5): 612-622. (in Chinese)
[36] 乔玮娜, 万方浩, 张爱兵, 闵亮, 张桂芬. DNA条形码技术在田间常见蓟马种类识别中的应用. 昆虫学报, 2012, 55(3): 344-356.
QIAO W N, WAN F H, ZHANG A B, MIN L, ZHANG G F. Application of DNA barcoding technology for species identification of common thrips (Insecta: Thysanoptera) in China., 2012, 55(3): 344-356. (in Chinese)
[37] Folmer O, Black M, Hoeh W, Lutz R, Vrijenhoek R. DNA primers for amplification of mitochondrial cytochromeoxidase subunit I from diverse metazoan invertebrates., 1994, 3(5): 294-299.
[38] Edwards M C, Gibbs R A. Multiplex PCR: advantages, development, and applications., 1994, 3: S65-S75.
[39] Bayar K, TÖrjÉk O, Kiss E, Gyulai G, Heszky L. Intra- and interspecific molecular polymorphism of thrips species., 2002, 53(3): 317-324.
[40] Brunner P C, Fleming C, Frey J E. A molecular identification key for economically important thrips species (Thysanoptera: Thripidae) using direct sequencing and a PCR-RFLP-based approach., 2002, 4(2): 127-136.
[41] 游中华, 路虹, 张宪省, 冯纪年, 石宝才, 宫亚军, 黄大卫. 入侵害虫西花蓟马及其他8种常见蓟马的分子鉴定. 昆虫学报, 2007, 50(7): 720-726.
YOU Z H, LU H, ZHANG X S, FENG J N, SHI B C, GONG Y J, HUANG D W. Molecular identification of the introduced western flower thrips,(Pergande) and other eight common thrips species (Thysanoptera: Thripidae)., 2007, 50(7): 720-726. (in Chinese)
[42] 魏书军, 马吉德, 石宝才, 宫亚军, 刘静, 康总江, 陈学新, 路虹. 我国新入侵外来害虫美洲棘蓟马的外部形态和分子鉴定. 昆虫学报, 2010, 53(6): 715-720.
WEI S J, MA J D, SHI B C, GONG Y J, LIU J, KANG Z J, CHEN X X, LU H. External morphology and molecular identification of the newly found invasive pest(Thysanoptera: Thripidae) in China., 2010, 53(6): 715-720. (in Chinese)
[43] Moritz G, Delker C, Paulsen M, Mound L A, Burgermeister W. Modern methods for identification of Thysanoptera./, 2000, 30(3/4): 591-593.
[44] Toda S, Komazaki S. Identification of thrips species (Thysanoptera: Thripidae) on Japanese fruit trees by polymerase chain reaction and restriction fragment length polymorphism of the ribosomal ITS2 region., 2002, 92(4): 359-363.
[45] Rugman-Jones P F, Hoddle M S, Mound L A, Stouthamer R. Molecular identification key for pest species of(Thysanoptera: Thripidae)., 2006, 99(5): 1813-1819.
[46] 孟祥钦, 闵亮, 万方浩, 周忠实, 王文凯, 张桂芬, 西花蓟马的SCAR分子检测技术. 昆虫学报, 2010, 53(3): 323-330.
MENG X Q, MIN L, WAN F H, ZHOU Z S, WANG W K, ZHANG G F. SCAR marker for rapid identification of the western flower thrips,(Pergande) (Thysanoptera: Thripidae)., 2010, 53(3): 323-330. (in Chinese)
[47] Asokan R, Krishna Kumar N K, Kumar V, Ranganath H R. Molecular differences in the mitochondrial cytochrome oxidase I (mtCOI) gene and development of a species-specific marker for onion thrips,Lindeman, and melon thrips,Karny (Thysanoptera: Thripidae), vectors of tospoviruses (Bunyaviridae)., 2007, 97(5): 461-470.
[48] 周力兵, 刘忠善, 李春艳, 丁元明. PCR法鉴定西花蓟马. 植物检疫, 2007, 21(2): 78-81.
ZHOU L B, LIU Z S, LI C Y, DING Y M. Method of the polymerase chain reaction for identification of., 2007, 21(2): 78-81. (in Chinese)
[49] Walsh K, Boonham N, Barker I, Collins D W. Development of a sequence-specific real-time PCR to the melon thrips(Thysan., Thripidae)., 2005, 129(5): 272-279.
[50] Huang K S, Lee S E, Yeh Y, Shen G S, Mei E, Chang C M. Taqman real-time quantitative PCR for identification of western flower thrips () for plant quarantine., 2010, 6(4): 555-557.
[51] 吴霞, 张桂芬, 万方浩. 基于TaqMan实时荧光定量PCR技术的西花蓟马快速检测. 应用昆虫学报, 2011, 48(3): 497-503.
WU X, ZHANG G F, WAN F H. TaqMan real-time fluorescent quantitative PCR for identification of., 2011, 48(3): 497-503. (in Chinese)
[52] Glover R H, Collins D W, Walsh K, Boonham N. Assessment of loci for DNA barcoding in the genus(Thysanoptera: Thripidae)., 2010, 10(1): 51-59.
[53] Karimi J, Hassani-Kakhki M, Awal M M. Identifying thrips (Insecta: Thysanoptera) using DNA barcodes., 2010, 2(1): 35-41.
[54] Rebijith K B, Asokan R, Krishna V, Ranjitha H H, Krishna Kumar N K, Remamurthy V V. DNA barcoding and elucidation of cryptic diversity in thrips (Thysanoptera)., 2014, 97(4): 1328-1347.
[55] 冯毅, 王莉, 白云峰, 王洁, 冯纪年. 基于COI序列快速鉴定花蓟马的DNA条形码芯片初探. 生物技术通报, 2009(8): 169-173.
FENG Y, WANG L, BAI Y F, WANG J, FENG J N. Molecular identification ofbased on COI sequences by DNA barcoding chip., 2009(8): 169-173. (in Chinese)
[56] 赵广宇, 李虎, 杨海林, 彩万志. DNA条形码技术在昆虫学中的应用. 植物保护学报, 2014, 41(2): 129-141.
ZHAO G Y, LI H, YANG H L, CAI W Z. Application of DNA barcoding in entomology: a review., 2014, 41(2): 129-141. (in Chinese)
[57] Taylor H R, Harris W E. An emergent science on the brink of irrelevance: a review of the past 8 years of DNA barcoding., 2012, 12(3): 377-388.
[58] HEBERT P D N, CYWINSKA A, BALL S L, DEWAARD J R. Biological identifications through DNA barcodes.:,2003, 270(1512): 313-321.
[59] Chamberlain J S, Gibbs R A, Ranier J E, Nguyen P N, Thomas CASKEY C. Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification., 1988, 16(23): 11141-11156.
[60] 郝少东, 陈昱圻, 王进忠, 王合, 陶万强, 张志勇, 石小玉, 周赛. 多重PCR法区分枣园两种菱纹叶蝉及检测其体内枣疯病植原体. 昆虫学报, 2015, 58(3): 264-270.
HAO S D, CHEN Y Q, WANG J Z, WANG H, TAO W Q, ZHANG Z Y, SHI X Y, ZHOU S. Multiplex-PCR for identification of twospecies (Hemiptera: Cicadellidae) in jujube orchards and detection of jujube witches’ broom (JWB) phytoplasma in their bodies., 2015, 58(3): 264-270. (in Chinese)
[61] Kurata A, Fujiwara A, Haruyama N, Tsuchida T. Multiplex PCR method for rapid identification of genetic group and symbiont infection status in(Hemiptera: Aleyrodidae)., 2016, 51(1): 167-172.
[62] Cooke G M, King A G, Miller L, Johnson R N. A rapid molecular method to detect the invasive golden apple snail(Lamarck, 1822)., 2012, 4(3): 591-593.
[63] Nakamura S, Masuda T, Mochizuki A, Konishi K, Tokumaru S, Ueno K, Yamaguchi T. Primer design for identifying economically importantspecies (Diptera: Agromyzidae) by multiplex PCR., 2013, 13(1): 96-102.
[64] Laruson A J, Craig S F, Messer K J, Mackie J A. Rapid and reliable inference of mitochondrial phylogroups amongspecies, an invasive group of ship-fouling species (Bryozoa, Cheilostomata)., 2012, 4(3): 617-619.
[65] Gariepy T D, Kuhlmann U, Haye T, Gillott C, Erlandson M. A single-step multiplex PCR assay for the detection of Europeanspp., parasitoids ofspp., 2005, 15(5): 481-495.
[66] 何宛芹, 付瑶, 鲁雯璐, 常小丽, 杨文钰. 大豆根腐病致病镰孢菌的多重PCR检测技术. 植物保护学报, 2017, 44(4): 609-616.
HE W Q, FU Y, LU W L, CHANG X L, YANG W Y. A multiplex PCR detection technique for the pathogenicspecies causing soybean root rot., 2017, 44(4): 609-616. (in Chinese)
[67] 王爽, 田雨婷, 乔奇, 秦艳红, 张德胜, 张振臣. 侵染甘薯的菜豆金色花叶病毒属病毒和甘薯褪绿矮化病毒多重PCR检测方法的建立与应用. 植物保护学报, 2018, 45(6): 1427-1428.
WANG S, TIAN Y T, QIAO Q, QIN Y H, ZHANG D S, ZHANG Z C. Development and application of multiplex PCR method for detection of sweepoviruses andin sweet potato., 2018, 45(6): 1427-1428. (in Chinese)
[68] 张曼, 韩飞. AIV、NDV和安卡拉病毒多重PCR检测方法的建立及应用. 西北农林科技大学学报(自然科学版), 2018, 46(2): 1-6, 14.
ZHANG M, HAN F. Establishment and application of multiplex PCR assay for detecting avian influenza virus, new castle disease virus and angara disease virus., 2018, 46(2): 1-6, 14. (in Chinese)
[69] Kamenova S, Bartley T J, Bohan D A, Boutain J R, Colautti R I, Domaizon I, Fontaine C, Lemainque A, Le Viol I, Mollot G, Perga M E, Ravigne V, Massol F. Invasions toolkit: current methods for tracking the spread and impact of invasive species//, 2017, 56: 85-182.
[70] Zhang G F, Wu X, Zhou Z X, Meng X Q, Wan F H. A one-step, single tube, duplex PCR to detect predation by native predators on invasiveMEAM1 and., 2014, 150(1): 66-73.
[71] Cao L J, Wang Z H, Gong Y J, Zhu L, Hoffmann A A, Wei S J. Low genetic diversity but strong population structure reflects multiple introductions of western flower thrips (Thysanoptera: Thripidae) into China followed by human-mediated spread., 2017, 10(4): 391-401.
One-step duplex rapid identification technique ofgreenhouse and lupin races based on species-specific COI marker
ZHANG Rong1, WANG YuSheng1, YANG LiMei3, WAN FangHao1,2, ZHANG GuiFen1,2
(1State Key Laboratory for Biology of Plant Diseases and Insect Pests/Key Laboratory of Integrated Pest Management of Crop, Ministry of Agriculture and Rural Affairs, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193;2Center for Management of Invasive Alien Species, Ministry of Agriculture and Rural Affairs, Beijing 100193;3Agricultural Technology Extension Station of Yufa, Daxing, Beijing 102602)
【Background】is one of the most important pests infesting agricultural and horticultural crops worldwide, also it is a national- and international-wide important quarantine pest.has two races, i.e., greenhouse race (GR) and lupin race (LR). There are significant differences between the two races in host plant species, pesticide resistance, living environments, etc. However, it is difficult to identify these two races because of their high similarity in morphological characteristics.【】In this study, a one-step duplex PCR procedure for rapid identification ofgreenhouse race and lupin race was developed by using species-specific COI (SS-COI) marker based on mitochondrial DNA cytochrome c oxidase subunit I (mtDNA COI) gene, and other 14 common thrips species in the field were used as the control.【】The COI sequences ofgreenhouse and lupin races, and other 14 thrips species were amplified using mtDNA COI gene universal primers. The race-specific primer combination system, TF6/GR32/LR12 (TF6, the universal forward primer; GR32, the greenhouse race-specific reverse primer; LR12, the lupin race-specific reverse primer), for one-step duplex amplification of the two races was established. The fragments amplified by the combined primers were 362 bp for the greenhouse race and 541 bp for the lupin race, respectively. The system and conditions (e.g., annealing temperature) were optimized. The species/race specificity and sensitivity/ detection threshold of the combined primers were evaluated.【】When the ratio of the combined primers (TF6/GR32/LR12) was 1.0/0.2/0.8 and the annealing temperature was 44℃, the amplification effect was the best. Species/race-specific tests performed with this set of combined primers indicated that allgreenhouse race and lupin race specimens were detected positively and no cross reaction with other 14 thrips species, including,,,,,,,,,,,,,and, was identified. The system was tested on individual male and female adults, individual prepupae and pupae, individual 1st and 2nd instar larvae, and even single egg, and demonstrated to be applicable for all these stages of greenhouse and lupin races of, either in single race or two races mixed together. The detection threshold for greenhouse race was 35.90 pg·μL-1, which was equivalent to 1/10 240 of a whole female adult. The detection threshold for lupin race was 146.95 pg·μL-1, which was equivalent to 1/2 560 of a whole female adult. Meanwhile, the system worked well in testing individuals from different geographic populations with different haplotypes within greenhouse race or lupin race of the thrips. 【】The one-step duplex PCR system developed here for rapid identification ofgreenhouse and lupin races could be useful in port quarantine and interception in national and international transportation of agricultural products, and should be significant in blocking further spreading and developing targeted prevention and control measures of.
greenhouse race;lupin race; one-step duplex PCR; SS-COI marker; race-specific combined primer set; rapid identification
2019-03-27;
2019-06-06
国家自然科学基金(31572067)、国家重点研发计划(2017YFC1200600)
张蓉,E-mail:zhangrong0120@163.com。
张桂芬,E-mail:guifenzhang3@163.com
(责任编辑 岳梅)
