腹腔镜下完全经腹入路部分内括约肌切除术在低位直肠癌保肛手术中的应用研究
2019-08-26陈保祥周燕解萧宇孙孔亮洪云天刘波喻学桥刘韦成陈文豪丁召钱群江从庆
陈保祥,周燕,解萧宇,孙孔亮,洪云天,刘波,喻学桥,刘韦成,陈文豪,丁召,钱群,江从庆
(武汉大学中南医院结直肠肛门外科 湖北省卫健委结直肠肛门外科质量控制中心 湖北省肠病医学临床研究中心 肠病省重点实验室,湖北 武汉 430071)
结直肠癌是全球范围内发病率较高的恶性肿瘤之一。男、女性结直肠癌的患病率分别居恶性肿瘤的第2位和第3位[1]。近年来,随着外科技术及器械的不断发展,全直肠系膜切除术(total mesorectal excision, TME)及新辅助放化疗的应用,使得低位直肠癌的治疗取得了重大进展,病人的生存率得到了显著提高。单纯肿瘤根治不再是直肠癌治疗的唯一目的,如何提高病人术后的生活质量得到广泛关注。1976年,Lyttle等[2]首次提出经括约肌间切除术(intersphincteric resection,ISR)手术用于治疗炎症性肠病。1984年Schiessel等[3]首次将ISR手术应用于低位直肠癌的保肛治疗,并将ISR手术分为完全ISR(total intersphincteric resection, TISR)及部分ISR。2007年日本学者Yamada等[4]在Schiessel等的基础上进一步将ISR分为3种亚型,其中,TISR以括约肌间沟为远端切除线,切除全部内括约肌;次全ISR的远端切除线位于齿状线和括约肌间沟之间;部分ISR的远端切除线位于齿状线上缘。2010年,池畔提出腹腔镜下完全经腹入路部分内括约肌切除术(completely abdominal approach partial intersphincteric resection,CAPISR),并通过随后的研究证实了其良好的疗效[5]。本研究回顾性分析了53例行腹腔镜CAPISR或TISR手术病人的临床资料及随访信息,探讨两种手术方式治疗低位直肠癌的可行性、肿瘤学安全性、术后肛门功能及腹腔镜CAPISR手术的优势。
资料与方法
一、临床资料
采用回顾性研究方法。纳入2015年3月至2018年11月在武汉大学中南医院行腹腔镜CAPISR或TISR手术的53例超低位直肠癌病人的临床资料及随访信息。纳入标准:①肿瘤下缘距肛缘3~5 cm;②术前检查肛门外括约肌及肛提肌未受累、无淋巴结转移及远处转移;③术前病理学证实为中高分化腺癌。排除标准:①合并肠穿孔、出血或梗阻需急诊手术者;②合并其他影响肠道功能的疾病,如克罗恩病、溃疡性结肠炎等者;③合并结直肠多源发肿瘤者;④全身健康状况差合并重要脏器功能障碍者;⑤术前肛门功能不良者;⑥临床资料不完整及随访信息缺失者。其中,CAPISR组31例,TISR 组22例。两组病人的年龄、性别、BMI、美国麻醉医师协会(ASA)分级、癌胚抗原(CEA)及术前肿瘤分化程度等临床资料差异无统计学意义(P>0.05),详见表1。CAPISR组和TISR组病人的肿瘤大小分别为(3.22±1.06) cm和(3.55±1.47) cm,肿瘤距肛缘中位长度分别为4.5 (4.0, 5.0) cm和4.5 (3.5, 5.0) cm。CAPISR组中有4例病人接受新辅助治疗,2例病人由T3降为T2,2例病人由T3降至T1;TISR组中有3例病人接受新辅助治疗,1例病人由T3降至T0,2例病人由T3降至T2。

表1 53例超低位直肠癌病人的临床资料
注:表中单位除注明的外,余均为“例(%)”;a.采用中位数(四分位数)表示
二、方法
1.腹腔镜CAPISR手术 病人取截石位,采取常规的五孔法,脐上观察孔,左右髂前上棘连线与右锁骨中线稍内下方作为主操作孔。采用内侧入路,经乙状结肠系膜黄白交界处进入Toldt’s间隙,注意保护左侧输尿管及生殖血管,处理肠系膜下动脉(inferior mesenteric artery, IMA)时,根部U形切开系膜前层,逐层切开系膜脂肪,整块清扫第253组淋巴结。肠系膜下丛分布在IMA根部及其分支周围,参与组成IMA的血管鞘。裸化IMA的过程时,需始终提起血管,将血管两侧及夹角内可见的神经网格推向后腹壁,避免损伤神经(图1A)。在骶骨岬水平向下游离直肠时,应始终在腹下神经前筋膜前方游离,既可以指引分离层面,又可以避免损伤腹下神经。沿Holy平面隧道式向下游离,直达肛提肌平面,注意勿损伤骶前筋膜及骶前静脉丛(图1B)。充分游离直肠后方,沿着后方的脏层筋膜向侧方分离,使直肠侧腹膜趋于“薄翼状”,在盆丛内侧切断侧韧带(图1C)。腹膜反折上方约1 cm处切开腹膜,进入Denonvilliers筋膜(Denonvilliers fasciae,DVF)前间隙,继续向下锐性分离,达精囊腺尾部或直肠阴道隔下方,并在此处U形切开,显露黄色的直肠筋膜(图1D)。肛提肌裂孔处切断末端直肠系膜(图1E),继续向下游离,离断Hiatal韧带后,切断联合纵肌在括约肌间隙内交织的肌纤维,顺利进入括约肌间隙(图1F),将直肠充分提起,当观察到直肠后壁曲张的静脉团块时,提示分离达齿状线水平,此举可获1~2 cm的括约肌间的游离直肠,对保证CAPISR手术的安全远切缘至关重要。前方游离至前列腺以下,同时注意保护左、右前方的神经血管束(neurovascular bundle,NVB)。正确的分离平面位于黄白组织交界的黄色侧,注意避免过度牵拉NVB,以免误将其当作切除线,损伤神经及血管(图1G)。直肠指检确定肿瘤下缘的位置,主刀在盆腔内标记肿瘤位置,用7号丝线确定肿瘤远切缘,T2~T3期必须保证2 cm,T1期至少保证1 cm的安全切缘,可见断端位于肛提肌裂孔下(图1H)。我中心在ISR术后常规实施预防性造瘘,取右下腹穿刺孔或右下腹拟行造瘘处作腹部切口,于肿瘤上方10 cm处离断乙状结肠,移除标本,充分扩肛后经肛门置入管型吻合器,完成结肠-肛管端端吻合。测量肿瘤远切缘长度,行快速冷冻切片检查,若远切缘阳性则追加手术。

图1 腹腔镜CAPISR手术过程 A.裸化IMA; B.后方游离直肠; C.侧方游离直肠; D.前方游离直肠;E.切断末端直肠系膜; F.游离括约肌间隙;G.保护NVB; H.直肠断端位于肛提肌裂孔以下
2.TISR手术 手术操作标准与CAPISR手术相当,遵循TME原则游离直肠至肛提肌平面,随后转向会阴部操作。使用Lone Star暴露术野,在内外括约肌间沟处沿括约肌间隙向头侧分离,切除全部内括约肌,直至与腹腔游离平面会师。自肛门拖出肠管,在肿瘤上方10 cm处离断乙状结肠,移除标本。采用手工间断缝合的方式完成结肠-肛管端端吻合。
3.观察指标及评价标准
(1)手术学指标:手术时间;术中失血量;术后镇痛时间;术后住院时间;术后并发症(含吻合口漏、吻合口狭窄、切口感染、肛门疼痛、肠梗阻、腹腔感染、切口疝、心脑血管意外及肺部感染等);并发症的诊断和分级参照Clavien-Dindo[6]分级系统。
(2)肿瘤学指标:离体标本肿瘤的直径、肿瘤远切缘长度、淋巴结清扫数量及远近切缘、环周切缘(circumferential resection margin, CRM)阳性率;术后3个月、6个月、1年、2年时对病人进行电话或门诊随访,统计局部复发率、远处转移率及生存率等。
(3)肛门功能的评估:所有病人均在术前评估基线每日平均排便次数及肛门失禁Wexner评分,造瘘还纳术后3个月、6个月及12个月通过问卷形式再次评估日平均排便次数和肛门失禁Wexner评分,并在术后12个月通过Kirwan[7]分级对病人的肛门功能进行综合评分。
三、统计学分析

结 果
53例病人顺利行CAPISR和TISR手术,无围手术期死亡病例。CAPISR组均行腹腔镜手术,TISR组中16例(72.7%)行腹腔镜手术,6例中转开腹。CAPISR组较TISR组手术时间更短(P=0.003);术中失血量更少(P=0.000);术后住院时间也更短(P=0.038)。两组病人术后镇痛中位时间分别为1 d和2 d,差异无统计学意义(P=0.300)。CAPISR组术后并发症发生率较TISR组低(22.6%比72.7%,P=0.000)。术后并发症按Clavien-Dindo分级比较,CAPISR组发生了3例Ⅲ级并发症:3例吻合口狭窄,手术松解瘢痕后治愈;1例病人术后4 h发生回肠造瘘旁腹壁血管出血,手术止血后治愈。TISR组发生了5例Ⅲ级并发症:1例因肠梗阻手术治疗,术中证实为切口疝(戳孔疝);3例吻合口狭窄,手术松解瘢痕后,其中1例病人吻合口狭窄松解术后1个月出现吻合口上方发生肠穿孔,再次手术修补后治愈;1例病人术后2年出现直肠黏膜脱垂,行直肠黏膜部分切除后治愈。经Mann-Whitney U检验,两组病人术后并发症的Clavien-Dindo等级有显著差异(P=0.001),见表2。

表2 两组病人手术学指标比较
注:表中指标,单位除注明的外,余均为“例(%)”;a.采用中位数(四分位数)表示
两组病例肿瘤远切缘长度、清扫淋巴结数量及淋巴结阳性率差异均无统计学意义(P>0.05)。两组病人术后病理标本的CRM、远近切缘均为阴性。两组术后病理TNM分期差异无统计学意义(P=0.658),术后存在高危因素的pTNM Ⅱ期及pTNM Ⅲ期病人予以辅助治疗。本研究中位随访时间16(10, 25.5)月,无失访者。CAPISR组有10例随访超过2年,全组在随访期内未发现局部复发及转移;TISR组有15例随访超过2年,2例随访期内出现转移,其中1例在术后7个月肝转移,术后20个月死亡;另1例在术后24个月腹腔广泛转移,术后28个月死亡,总生存率为90.9%,详见表3。
评估(回肠造瘘还纳)术后超过12月病人的肛门功能。其中,CAPISR组25例,TISR组17例。与术前相比,两组病人术后3、6、12个月的每日平均排便次数及肛门失禁Wexner评分均显著增加,差异有统计学意义(P<0.05)。术后不同时间节点的每日平均排便次数及肛门失禁Wexner评分的差异有统计学意义(P=0.000)。与TISR组相比,CAPISR组术后3、6、12个月时的每日排便次数和肛门失禁Wexner评分均较低,差异均有统计学意义(P<0.05)。两组术后12个月Kirwan分级综合评分表明,术后1年病人肛门功能良好,无1例因严重肛门失禁(KirwanⅤ级)行永久性造口。与TISR组相比,CAPISR组病人的肛门功能更好,差异有统计学意义(P=0.015)。具体见表4、表5,图2,图3。
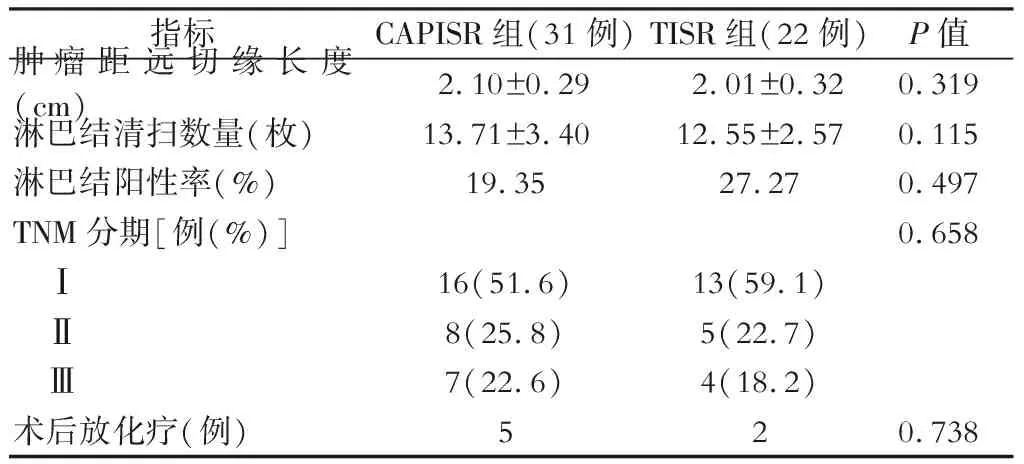
表3 两组肿瘤学指标比较

图2 每日平均排便次数变化趋势图

图3 肛门失禁Wexner评分变化趋势图


时间组别每日平均排便频次肛门失禁Wexner评分术前CAPISR组 1.40±0.501.44±0.58TISR组 1.41±0.511.47±0.62术后3个月CAPISR组10.12±5.319.28±3.31TISR组16.53±1.8713.47±1.55术后6个月CAPISR组 6.72±3.946.40±2.42TISR组 9.41±2.859.82±2.81术后12个月CAPISR组 3.92±1.504.12±1.61TISR组 6.47±1.777.23±1.85
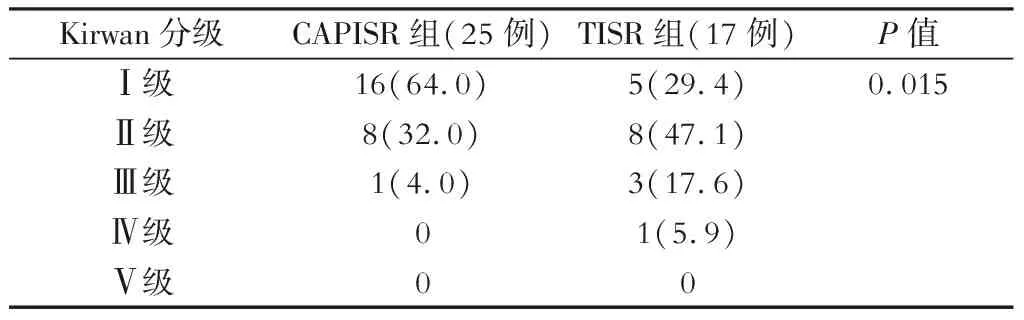
表5 术后12个月Kirwan分级综合评分[例(%)]
注:Kirwan分级评分:Ⅰ级:无肛门失禁症状;Ⅱ级:气体或液体失禁;Ⅲ级:偶尔有固态粪便失禁;Ⅳ级:经常有固态粪便失禁;Ⅴ级:需永久性造口;依次功能逐渐变差[7]
讨 论
国外学者[8]对低位直肠癌的病理组织的研究表明,直肠癌的淋巴引流主要向近端扩散,远端浸润仅出现在部分肿瘤分化差、分期晚以及肿瘤压迫或阻塞淋巴管的情况。此外,肿瘤在肠壁内也主要向近端浸润,远端浸润通常不超过2 cm[9]。美国一项前瞻性对照研究分析评估ISR术后病人远端切缘长度,结果显示切缘<2 cm、2~2.9 cm及≥3 cm的局部复发率和生存率无统计学差异[10]。Saito等[11]的研究表明,T1~2期低位直肠癌的安全切缘为1 cm,T3~4期低位直肠癌的安全切缘为2 cm。甚至有学者建议,在保证远切缘阴性的前提下,即使切缘距肿瘤下缘小于1 cm也是相对安全[12]。上述研究表明分化程度较好、肿瘤分期较早的低位直肠癌病人可以通过ISR手术得以保肛。随着新辅助治疗的快速发展,部分分期相对较晚、肿瘤体积相对较大的病人术前可通过放化疗使肿瘤退缩降期,从而获得保肛的机会。
Kim等[13]的一项222例机器人辅助或开腹CAPISR的前瞻性研究,报道术中并发症发生率为3.2%,失血量大于400 ml占比为5.9%。Chi等[14]回顾性分析137例腹腔镜或开腹CAPISR,也同样证实了此术式的安全性。本研究中,CAPISR组均顺利完成腹腔镜手术,平均手术时间、术中失血量及术后住院时间均较TISR组显著减少。ISR术后的并发症主要包括吻合口相关并发症、肛门失禁、泌尿生殖功能障碍及肠梗阻等。日本结直肠癌学会(Japanese Society for Cancer of the Colon and Rectum, JSCCR) 对2 125例ISR术后病人的长期随访结果显示:ISR术后的总体并发症发生率为36.6%[15]。Martin等[16]开展的一项包含1 289例病人的荟萃分析显示ISR术后并发症发生率为8%~65%。我中心CAPISR组的并发症发生率为29.0%,较TISR组(63.6%)显著减少,特别是需要外科介入的Clavien-Dindo Ⅲ级并发症(12.9%比22.7%),这与以上研究基本相符。笔者认为以上差异原因有如下可能:CAPISR手术在腹腔镜下行TME后继续向下游离末端直肠至肛提肌裂孔以下,结肠-肛管管状吻合器端端吻合,此术式不仅直视下显露末端直肠系膜附着点,有效防止系膜残留,加之腹腔镜的放大效果,可精细分离内外括约肌间隙,避免过于偏内损伤直肠肌层造成穿孔,过于偏外损伤外括约肌或肛提肌,影响术后肛门功能。TISR手术经腹腔镜或开腹完成TME后,转而经会阴切除全部内括约肌,结肠拖出与肛管手工吻合,手术操作繁琐,费时费力且一定强度上可能增加吻合口相关并发症的风险。
符合肿瘤学安全性的ISR手术需满足以下条件:①肿瘤下缘距肛缘3~5 cm,肿瘤为中高分化,T2期远切缘最少2 cm,T1期远切缘最少1 cm,并且术中行快速冷冻切片检查证实切缘阴性;②肛门外括约肌、肛提肌均未受累,无淋巴结及远处转移;③肛提肌裂孔水平处完整切除直肠系膜,由此进入括约肌间隙。ISR手术有严格的手术适应证,不应盲目追求保肛而扩大适应证。因此,低位直肠癌病人术前必须行直肠肿瘤MRI、直肠腔内超声检查,精准分期。新辅助治疗后还应组织结直肠肛门外科医师、肿瘤科医师及影像科医师多学科综合讨论后再分期,制定个体化的治疗方案。ISR手术的肿瘤学安全性的指标包括术后病理标本的检查、局部复发率和生存率等。根治性手术切除的病理标本应满足远近切缘阴性、直肠系膜完整及淋巴结检出数≥12枚等条件[17]。本研究中,两组病人术后病理标本的CRM、远近切缘均为阴性。两组平均检出淋巴结数目分别为13.71枚和12.55枚,肿瘤远切缘长度分别为(2.10±0.29) cm和(2.01±0.32) cm,以上均表明无论是CAPISR手术还是TISR手术均可达到肿瘤根治性切除。Tilney等[18]的一项荟萃分析纳入21项研究含612例ISR手术的病人,研究结果为ISR手术的5年总生存率为81.5%,局部复发率为9.5%(0~31%)。Kim等[19]的一项包含624例病人的随机对照研究显示,ISR术后5年无病生存率为78.9%,总生存率为92%,局部复发率为4.3%。本研究中,中位随访时间16 月,CAPISR组未发现局部复发及转移,TISR组有2例病人术后出现远处转移后死亡,总生存率为90.9%。但由于样本量少,随访时间短,无法进一步评估CAPISR及TISR手术的远期肿瘤学疗效。
ISR手术不仅仅是保留肛门的外形,而是尽可能地保留肛门的功能。对于低位直肠癌ISR术后病人而言,其生活质量仍然是亟待研究的问题,而这很大程度取决于肛门的控便能力,ISR术后肛门功能不良导致的生活质量的下降可能不亚于永久性造瘘。Martin等[16]的一项荟萃分析显示,ISR术后病人日平均排便次数为2.7次,其中 51.2%的病人肛门功能良好,手术满意度达90.8%,且保留部分内括约肌能明显改善病人术后的肛门功能。Akagi等[20]的一项荟萃分析纳入14项研究共1 134例ISR病人,研究表明术后0~33%病人需口服止泻药物,手术满意度超过80%。ISR术后控便能力受损受多因素影响,包括括约肌的损伤、直肠肛管抑制反射受损及新直肠的生理特性变化等。尽管ISR手术操作上可行,肿瘤学安全性可靠,且手术仅切除(部分)肛门内括约肌,可保留大部分肛门功能,但手术对肛门功能的实际影响仍令人担忧。ISR术后会出现大便次数增多、夜间排便频繁、大便失禁和排便不尽感等“直肠前切除综合征”。研究表明,直肠前综合征在保留了全部括约肌的直肠前切除术后的病人中,仍有较高的发生率,这说明直肠储便功能的缺失也是影响因素之一。此外,ISR术后肛门功能不良与术中肛门外括约肌和支配直肠的盆丛神经的损伤、吻合口周围感染以及放疗等有关。本研究中,CAPISR手术仅切除部分内括约肌,该组病人与完全切除内括约肌的TISR组相比早期每日排便次数更少,肛门失禁症状更轻(P<0.05)。韩加刚等[21]的一项研究也提出,与TISR手术相比,保留部分内括约肌的CAPISR手术能更好地保留肛门功能,降低术后肛门失禁的发生率。随着时间的推移,病人的控便能力逐渐恢复。术后1年,多数病人的肛门功能可大幅改善,这与Saito等[22]的一项长期随访结果相符。因此,池畔等建议ISR手术常规行预防性造瘘,可避免术后早期肛门失禁带来的不适[23]。而早期适当肛门功能锻炼和生物反馈治疗也有助于肛门功能的恢复。
综上所述,CAPISR手术与TISR手术肿瘤学安全性相当,但CAPISR手术时间短、术中失血量少、恢复快、住院时间短、并发症少。与TISR手术相比,CAPISR手术仅切除部分内括约肌从而能更好保留术后肛门功能,获得较高的生活质量。因此,随着操作规范化及专科医生经验的不断积累与总结,腹腔镜CAPISR手术可能会成为低位直肠癌保肛手术一种更好的选择。
