腹腔镜与传统脾切除术治疗创伤性脾破裂的疗效对比研究
2019-08-26李春明李大伟王永高
裴 磊,李春明,黄 涛,李大伟,王 非,王永高
(浙江中医药大学附属第一医院,浙江 杭州,310018)
脾脏是人体中枢免疫器官,同时也是最大的淋巴器官,位于腹腔左上部,表面呈暗红色,脾脏中的巨噬细胞通过吞噬衰老的血小板、白细胞而发挥滤血功能[1-2]。脾脏生理解剖位置特殊,是腹腔脏器中最容易受到创伤的器官[1,3]。研究表明[3-5],创伤性脾损伤在腹部创伤中占比接近50%,其中脾破裂是常见的腹部闭合性损伤,多合并脏器损伤、胃穿孔、失血性休克及多处骨折等,死亡率超过60%。一旦脾脏发生破裂后,出现大出血,需要切除脾脏进行治疗,以往对于脾脏功能的认识不足,多采用传统开腹脾切除术,但由于脾脏解剖位置特殊,手术风险大,需在肋缘或腹直肌做较大切口,出血量较多,破坏机体腹壁结构,患者预后较差[6-7]。近年随着对脾脏功能的深入认识及微创技术的发展,腹腔镜手术逐渐应用于创伤性脾破裂的治疗中[1,7]。本研究通过对比两种术式治疗创伤性脾破裂患者的术中与术后指标、免疫、血液系统功能及安全性,旨在为选择合适的临床术式提供参考。
1 资料与方法
1.1 临床资料 选择2014年6月至2018年5月我院普通外科收治的创伤性脾破裂患者76例,均经CT或B超等影像学检查确诊为创伤性脾破裂,纳入标准:(1)符合脾切除适应证;(2)患者生命体征稳定,能耐受长时间手术;(3)患者各项基本资料完整,且临床依从性高;(4)经患者及其家属同意,并签署手术知情同意书。排除标准:(1)合并腹内其他脏器严重损伤;(2)腹腔内巨大良性及恶性肿块;(3)合并严重低血压;(4)有腹部手术史;(5)凝血功能障碍。按照随机数字表,将患者分为对照组(行传统开腹手术)与研究组(行腹腔镜脾切除术),每组38例,两组患者临床资料差异无统计学意义(P>0.05),见表1。研究过程符合相关伦理准则。


组别性别(n)男女年龄(岁)受伤原因(n)钝器打伤高处坠落交通事故挤压伤损伤分级(n)Ⅱ级Ⅲ级Ⅳ级对照组231543.24±5.62101297161210研究组221643.17±5.531110107151310t/χ2值0.055-0.0550.2820.072P值0.8150.9570.9630.965
1.2 手术方法 患者入院确诊后进行术前常规准备,包括扩容补液、胃肠减压、备血、建立输液通道等,均行气管插管全身麻醉。研究组:患者取平卧位,两腿分开,头低足高位30°,向右倾斜30°,术者立于患者右侧,四孔法施术。建立CO2气腹,压力维持在12~14 mmHg,脐上缘做10 mm切口作为观察孔,左锁骨中线肋缘下3 cm处为主操作孔,分别于左腋前线肋缘下5 mm、左腋前线平脐交点处做切口,作为第一与第二辅助操作孔。置入30°腹腔镜,探查腹腔,吸除腹腔内积血,明确脾脏损伤位置、程度及是否合并其他脏器损伤等,根据脾脏损伤程度决定手术方式。将脾脏向上托起,充分显露脾下极,将脾脏翻向内侧,用超声刀切断脾结肠韧带及部分脾下极血管。将脾脏向内侧牵拉,脾肾韧带形成张力,超声刀依次离断脾肾韧带与脾膈韧带,接着将脾脏向外侧牵拉,显露脾胃韧带,用超声刀离断、血管夹止血。将脾脏向上托起,露出脾蒂,评估脾蒂分级情况,采用一级或二级离断法切除脾蒂,完成脾切除,见图1~图3。将完整的脾脏放入无菌标本袋内,将其剪成条块状,适当扩大主操作孔,将脾脏取出送检病理。重新建立气腹,冲洗腹盆腔,观察有无活动性出血,清点手术器械与纱布无误后,于脾窝放置腹腔引流管,逐层缝合各操作孔,手术结束。对照组:行传统开腹脾切除术,麻醉方式、体位同研究组,左上腹肋缘下做15 cm切口,逐层暴露脾脏,使用负压吸引器吸净腹腔内积血,观察腹腔内脏器损伤情况及脾脏出血情况,向右牵拉胃,用超声刀离断脾胃韧带,分离后充分暴露胃后壁、胰体尾部,结扎脾动脉,并向上牵拉脾脏,依次离断脾结肠韧带、脾膈韧带,钝性分离脾肾韧带,充分暴露脾蒂,切断脾蒂后移除脾脏。
1.3 术后处理 补液,观察引流情况,实时监测患者生命体征,对患者体征变化进行对症治疗。保证敷料干燥;选择二代头孢菌素类抗生素,对头孢过敏可选用其他抗生素,术中使用一次,术后再使用2~3 d;通常情况下不使用生长抑素或胰酶抑制剂,当腹腔引流液中淀粉酶水平升高,并符合胰瘘诊断标准时,使用加贝酯、奥曲肽等药物;术后鼓励患者尽早下床,对于不能下床的患者,可在床上做翻身或抬臀等动作,第一次下床活动时间多集中于术后1~3 d;此外,应注意腹腔引流管的管理及拔管时机。
1.4 观察指标 (1)术中及术后指标:对比两组术中(术中出血量、自体血使用量、脾动脉结扎时间及手术时间)及术后(术后引流量、术后镇痛药物使用率、术后肛门排气时间、住院时间、禁食时间、发热时间)相关指标;(2)免疫功能检测:采用免疫透射比浊法检测两组患者手术前后IgG、IgM、IgA水平,严格按照试剂盒说明书操作;(3)血液指标变化:比较两组患者血液指标变化(白蛋白、血红蛋白、血小板),检测时间为术后第1天、第5天,排除术后使用白蛋白、输血的患者;(4)术后并发症发生率。


图1 置入腹腔镜后探查
2 结 果
2.1 两组患者术中、术后相关指标的比较 研究组术中出血量、术中自体血使用量、脾动脉结扎时间、手术时间、术后引流量、术后镇痛药物使用率、术后肛门排气时间、发热时间及住院时间优于对照组,差异有统计学意义(P<0.05);两组禁食时间差异无统计学意义(P>0.05),见表2。此外,两组患者手术前后影像学结果显示,因腹腔镜气腹的建立,手术结束不可能完全释放,存在膈下游离气体,见图4。
2.2 两组患者手术前后免疫球蛋白指标的变化 两组患者术前免疫球蛋白水平差异无统计学意义(P>0.05)。两组患者术后IgG、IgM、IgA水平均高于术前,同时研究组患者术后免疫球蛋白水平均高于对照组,且差异有统计学意义(P>0.05),见表3。
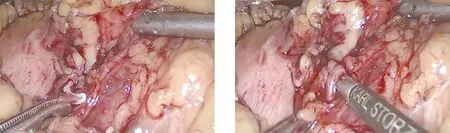
图2 分离脾动脉

图3 分离脾静脉
2.3 两组患者手术后血液指标的变化 术后第1天,两组患者血液指标差异无统计学意义(P>0.05)。术后第5天,两组患者血液中白蛋白、血红蛋白及血小板水平均高于术后第1天,且研究组高于对照组,差异均有统计学意义(P<0.05),见表4。
2.4 两组患者并发症发生率的比较 两组患者术后均出现轻度并发症,经治疗后临床症状得到明显改善。对照组术后并发症发生率为21.05%(8/38),研究组为5.26%(2/38)。对照组术后并发症发生率高于研究组(P<0.05),见表5。
3 讨 论
脾脏自身脆软,发生创伤后容易导致致命性出血,如果不能得到及时有效治疗,会危及患者生命[4,8]。中华医学会外科学分会脾功能与脾脏外科学组发布的《脾脏损伤治疗方式的专家共识(2014版)》明确指出“抢救生命第一,保留脾脏第二”、“损伤控制”的原则,即首先确保患者生命健康,其次保留脾脏,充分评估患者病情后选择合适术式[3,9]。腹腔镜脾切除术最早由Delaitre于1991年完成[10],此后,随着腹腔镜技术的发展,在国内外临床手术中的应用越来越广泛,并且腹腔镜脾切除术的临床疗效及安全性已得到循证医学数据的支持[4]。

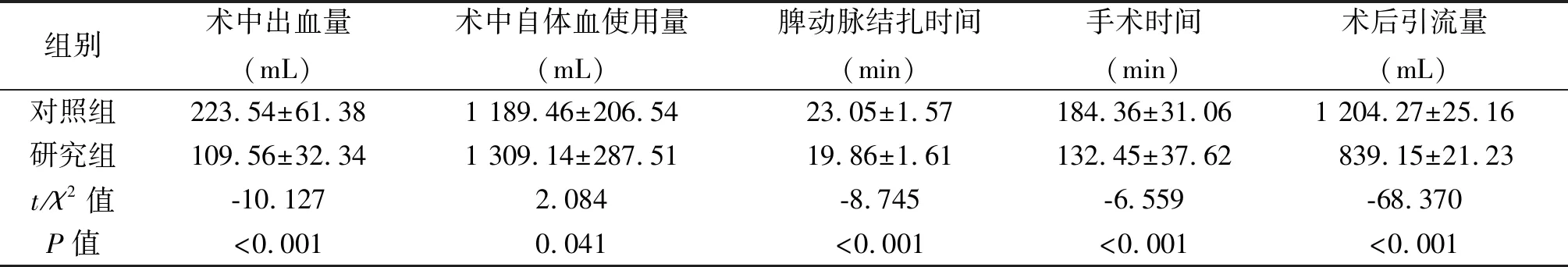
组别术中出血量(mL)术中自体血使用量(mL)脾动脉结扎时间(min)手术时间(min)术后引流量(mL)对照组223.54±61.381 189.46±206.5423.05±1.57184.36±31.061 204.27±25.16研究组109.56±32.341 309.14±287.5119.86±1.61132.45±37.62839.15±21.23t/χ2值-10.1272.084-8.745-6.559-68.370P值<0.0010.041<0.001<0.001<0.001
续表2

组别术后镇痛药物使用率[n(%)]术后肛门排气时间(h)发热时间(d)住院时间(d)禁食时间(d)对照组17(44.74)79.04±6.182.57±0.629.04±1.871.49±0.46研究组3(7.89)61.03±5.031.82±0.436.53±1.831.42±0.41t/χ2值13.300-13.933-6.127-5.914-0.762P值 <0.001<0.001<0.001<0.0010.448

图4 左图为术前影像图,右图为术后影像图。

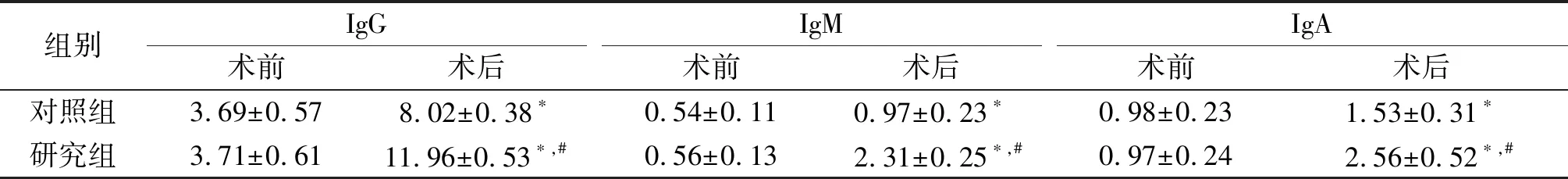
组别 IgG术前术后IgM术前术后IgA术前术后对照组3.69±0.578.02±0.38∗0.54±0.110.97±0.23∗0.98±0.231.53±0.31∗研究组3.71±0.6111.96±0.53∗,#0.56±0.132.31±0.25∗,#0.97±0.242.56±0.52∗,#
*P<0.001 vs. 术前;#P<0.05 vs. 对照组


组别白蛋白(g/L)术后第1天术后第5天血红蛋白(g/L)术后第1天术后第5天血小板(×109/L)术后第1天术后第5天对照组27.62±2.8931.69±3.82∗96.86±12.64109.62±22.01∗82.14±13.5496.57±8.24∗研究组27.59±2.7845.38±3.74∗,#97.01±12.73138.52±25.72∗,#81.97±12.98136.24±15.14∗,#
*P<0.001 vs.术前;#P<0.05 vs.对照组
表5 两组患者并发症发生率的比较(n)

组别腹腔出血切口感染脾热静脉血栓发生率[n(%)]对照组24118(21.05)研究组00112(5.26)χ2值4.146P值0.042
本研究中,研究组相关指标的改善情况优于对照组(P<0.05),与国内研究基本一致[4-5,7,11-12]。传统开腹脾切除术难以精确辨认脾门血管,容易撕裂血管,对于患者的脾蒂血管及胰尾极易造成损伤,加重脾出血,延长术后恢复时间[7]。腹腔镜手术对腹内脏器的干扰较小,手术应激轻,患者可早期下床活动,肛门排气早,能尽早恢复进食[11]。腹腔镜视野可清晰暴露脾动脉,超声刀等手术器械的配合使用,利于脾动脉的处理,同时腹腔镜手术进腹快,因此脾动脉结扎时间短;此外,腹腔镜手术在相对密闭的空间中操作,能彻底回收积血,提高自体血使用量,降低过敏反应及炎症反应,加速患者术后恢复进程[12]。脾脏作为机体重要的免疫器官,脾发生破裂后,免疫功能受损,本研究发现,两组患者术后免疫球蛋白水平明显高于术前,研究组患者术后免疫球蛋白水平均高于对照组(P<0.05),表明两组患者术后免疫功能均有所改善,而腹腔镜手术改善效果更明显,这与廖方等[7]的研究结果基本一致,传统开腹手术无法准确辨认脾门血管,加重了脾脏的损伤,脾脏作为重要的免疫器官,影响免疫指标的变化。由于研究组冲洗彻底,术后引流量少,患者可更快恢复,使得术后血液系统指标改善情况优于对照组(P<0.05)[12]。研究组术后并发症发生率低于对照组(P<0.05),推测原因可能为腹腔镜可清晰显示脾门分支血管解剖结构,彻底结扎、止血、分离,减少腹腔积液积血、出血等并发症[13];此外,传统开腹脾切除术切口大,术中出血量多,患者腹腔组织暴露时间长,容易发生术后继发性感染等并发症,不利于患者预后[14]。
我们行腹腔镜脾切除术治疗创伤性脾破裂的经验总结如下:(1)术前应了解患者生命体征、疾病严重程度,充分掌握脾切除的适应证。(2)合理选择手术体位,右侧斜卧位更适合手术操作。(3)术前做好准备,备好血液,建立静脉通道,清理腹腔积血时先清理残留血液,探查腹腔,确定无其他创面出血后暴露脾脏。(4)全面腹腔探查,观察有无积血、是否合并其他脏器损伤。(5)仔细离断脾动脉、脾静脉、胰腺、脾蒂等组织,用超声刀分离解剖脾门应有效剥离血管周围脂肪组织后再进行,避免损伤血管,离断过程中尽量采用锐性分离,避免撕裂脾包膜导致出血。(6)预防术后并发症,针对不同的并发症,提前做好准备,予以处理,如:①电刀具有热效应,如果术野不能充分暴露,会损伤胰腺、胃部等,导致胃肠穿孔,因此术中处理韧带时需确保一定张力,尽量靠近脾脏,避免发生胃穿孔;②如果脾门解剖不完全,直接使用切割闭合器离断脾门,可能导致胰尾部受损,从而发生胰瘘,因此处理脾门时应用蛇形拉钩,固定脾蒂,避免脾脏抬起过程中晃动,同时充分暴露脾蒂,一次性隔断并闭合脾蒂。(7)如果术中出血难以控制,术野暴露程度不足,或循环不稳定时,及时更改为手助式腹腔镜脾切除术或开腹。
综上所述,腹腔镜脾切除术治疗创伤性脾破裂具有创伤小、出血量少、预后效果好及安全性高等特点,可积极改善患者免疫、血液系统功能,临床可结合脾破裂程度选择合适的手术方式。
