高通量基因测序确诊PKD1基因新移码突变致常染色体显性遗传性多囊肾*
2019-08-24贾玉敏范亚平解心悦施钊钰
贾玉敏,范亚平,蒋 霞,解心悦,施钊钰,袁 莉
常染色体显性遗传性多囊肾(autosomal dominant polycystic kidney,ADPK)是最常见的肾脏遗传性疾病,由两个主要基因PKD1(80%~85%)和PKD2(15%~20%)的突变引起[1]。与 PKD2 突变型相比,PKD1突变型患者终末期肾病发生时间要早20年[2]。ADPK的外显率近100%,患者子女的再发风险为50%,基因检测可以早期确诊,明确致病变异,可通过遗传咨询有针对性地指导家系管理(包括家系的临床筛查和产前诊断)。该文报道通过新一代测序明确由PKD1基因杂合移码变异导致的ADPK家系1例。
1 资料与方法
1.1 临床资料先证者,男,49岁,2010年因夜尿增多就诊,查肌酐156μmol/L,彩超提示多囊肾,多囊肝。2014年肌酐升至1136μmol/L开始血液透析治疗,无多囊肾家族史(图1、2)。患者女儿25岁,目前肾功能正常,B超未提示有典型PKD肾脏病变。影像学检查:先证者2018年泌尿系统B超见右肾大小237 mm×103 mm×109 mm,左肾大小279 mm×120 mm×134 mm,双肾布满大小不等之液性暗区,左侧最大80 mm×71 mm,右侧最大60 mm×37 mm;左右肾内见数枚强光团,最大直径5 mm;提示多囊肾,双肾结石(图 2)。
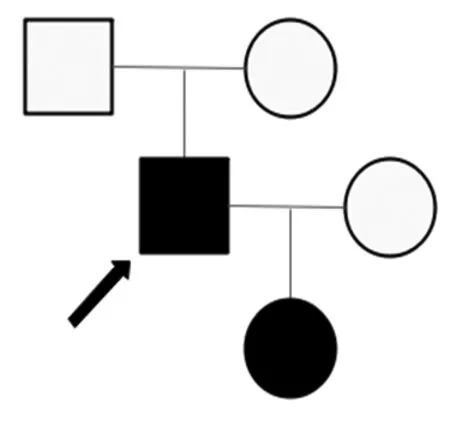
图1 多囊肾病家系图

图2 先证者多囊肾B超图
1.2 实验方法
1.2.1 样本采集与DNA提取 经知情同意后,采集先证者及其女外周静脉血各3 ml,置于ETDA抗凝管中,使用TIA Namp Blood DNA Kit(北京天根生化科技有限公司,中国)血液试剂盒从外周血淋巴细胞中提取基因组DNA。
1.2.2 Long-PCR 由于PKD1基因特殊性,可分为单拷贝区域和多拷贝区域。在多拷贝区域中,基因组序列BLAT结果显示6个假基因序列与目标序列相似度高达98%~99%左右,寻找PKD1真基因与假基因的细微序列差异,挑选PKD1基因第1号外显子到第34号外显子间的差异序列进行引物设计,共设计长片段引物4对。同时,PKD1基因单拷贝区域和PKD2基因设计长片段引物6对。PCR扩增采用Applied Biosystems Veriti 96孔热循环PCR仪,扩增产物用Agencourt AMPure XP磁珠纯化后,使用Qubit 2.0分别定量,并以相等的摩尔比合并。
1.2.3 Illumina测序及生物信息学分析 将2 mg LR-PCR产物合并在200 ml Tris-EDTA缓冲液中,并使用Covaris法随机打断成长度为180~280 bp的片段并回收。使用Agencourt AM Pure XP磁珠对样本进行进一步纯化。构建Illumina测序文库时将回收片段进行末端修复反应,将测序特定接头(Adapter)同末端修复产物进行连接反应,根据Adapter上的通用引物结合位点进行产物的扩增反应,纯化回收产物。带有特异index的文库pooling后与生物素标记的探针进行液相杂交,再使用带链霉素的磁珠将基因上的外显子捕获下来,经PCR线性扩增后进行文库质检,质检合格后用Illumina Next Seq 500测序仪进行测序。
原始图像文件经过Illumina base calling Software 1.7进行碱基读取,获得读长为90 bp双末端序列reads。去除低质量和污染的reads,去除Adapter序列得到纯化数据进行序列比对分析,用soap软件分析拷贝数、多态性和插入/缺失,并且进行注释筛选可疑致病突变。并经SIFT(http://sift.jcvi.org/) 和 Polyphen 软 件 (http://genetics.bwh.harvard.edu/pph/)等蛋白预测软件对其进行蛋白功能预测。
1.2.4 Sanger测序验证 根据新一代测序所得基因突变位点序列设计引物,对患者及其女目标序列进行Sanger测序,分析测序结果。采用PCR方法扩增,反应条件为:25μl的反应体系中包含10×扩增缓冲液 2.5μl,94℃预变性 5 min,94℃变性 40 s,57℃退火 40 s,72℃延伸 60 s条件循环 35次后72℃延伸10 min。见表1。
2 结果
通过对目标序列及侧翼区进行详尽分析,发现该受检者携带PKD1基因c.10396_10397delTC(Ala3467Ilefs*3)杂合移码变异,是ADPK的致病变异。PKD1基因c.10396_10397delTC变异发生在第33号外显子上,该变异使PKD1基因编码区第10396至10397位的胸腺嘧啶脱氧核苷酸(T)、胞嘧啶脱氧核苷酸(C)缺失,导致其编码的蛋白第3467位氨基酸由丙氨酸(Ala)变为异亮氨酸(Ile),并在其后第2位提前出现终止密码子,可能导致蛋白截短表达,影响其功能。该变异未见人群频率报道(数据来源:1000G、ExAC、esp6500 和 gnomAD),是一个罕见变异。见图3。

表1 Sanger测序引物序列表

图3 基因测序图
3 讨论
ADPK是由肾小管上皮细胞基因突变引起的,可导致细胞增殖和囊肿形成,并进展至慢性肾病[3]。PKD1基因导致的ADPK可于任何年龄发病,多于青中年时期被发现,以双侧多发肾囊肿为主要特点,伴随肾功能异常、高血压、肾痛、肾结石、尿路感染等。除肾囊肿外,患者也可出现其他器官囊肿,包括肝脏、精囊、胰腺和蛛网膜等[4]。
ADPK的临床诊断依赖于家族史及肾脏影像学表现(如超声、CT及MRI),然而年轻人影像学结果往往模糊不清,特别对于无家族史的患者,早期明确诊断仍有难度。该文先证者无多囊肾家族史,其女亦无异常肾脏的影像学资料提示。所以,基因检测在ADPK患者的早期诊断中发挥着重要作用,而且随着对ADPK潜在有效药物治疗的发展,对准确诊断基因检测的需求也越来越迫切[5]。
在ADPK的突变分析过程中,要注意以下几个方面:首先ADPK的突变分析被PKD1和PKD2的大尺寸和复杂的基因组结构、显著的等位基因异质性和带有低营养等位基因的常见错义突变所阻碍[6],其次要注意真假基因的筛选。PKD1基因外显子1至33与人类基因组16号染色体区域存在六段高度相似的序列,即在离PKD1基因13到16兆碱基处存在六个与其高度同源的假基因,与真基因序列同源性为97.7%[7]。此区域结构复杂,部分区域GC含量高达70%甚至80%。而在检测变异的PCR过程中往往同时扩增出这些同源假基因序列,导致对真突变基因的鉴定产生困难。测序前进行LR-PCR可以有效避免这些假基因的PCR产物的污染,放大PKD1基因区域,同时避免假基因序列的干扰[8]。
该文中,笔者所在课题组使用了一种新的NGS PK基因分型方法,分析灵敏度及特异性分别为99.2%,99.9%,优于单纯Sanger测序方法。该方法基于PKD1和PKD2基因的LR-PCR扩增,使用10对精心设计的PCR引物覆盖约68.0 kb的PKD基因组区域,相当于 31.9 kb(68.8%)和 35.8 kb(51.0%)的PKD1和PKD2基因[9]。鉴于NGS技术对复杂结构基因、GC含量高的区域检测仍有欠缺之处,实验使用新一代测序联合Sanger验证相互补充以确保基因检测的准确性。
该文的先证者病史及影像学检查支持PKD的诊断,但无家族史,其女年仅20余岁,无PKD影像学诊断依据,针对该文2例患者,笔者所在课题组使用基于NGS的基因分型方法,该方法更适合于标准的临床诊断设置,通过对每例患者进行单独条形码编码,可以实现快速周转时间和高灵敏度。经过检测,发现先证者及其女携带的PDK1基因c.10396_10397delTC(Ala3467Ilefs*3)变异为致病变异,该突变目前尚未见报道,该次发现丰富了PKD1的突变谱,有助于开展ADPK的基因诊断,同时对于该杂合移码变异引起疾病的进一步研究,将有助于对ADPK发病的分子学机制、基因突变类型和临床表型关系的进一步理解。
(感谢中科基因医学检验所给予的技术支持)
