三氯生和三氯卡班对水稻土好氧氮转化及N2O排放的影响*
2019-08-24陈顺涛朱同彬陈建秋颜晓元
陈顺涛 朱同彬 陈建秋 单 军 颜晓元
(1 中国药科大学工学院,南京 210009)
(2 中国科学院南京土壤研究所,南京 210008)
(3 中国地质科学院岩溶地质研究所/自然资源部、广西岩溶动力学重点实验室,广西桂林 541004)
药品与个人护理用品(Pharmaceutical and personal care products, PPCPs)是一类新型的环境有机污染物,而三氯生(Troclosan, TCS)和三氯卡班(Triclocarban, TCC)是其中的典型代表。TCS和TCC作为两种广谱的抗菌剂,已被广泛添加于日化用品如香皂、洗发膏、牙膏、洗手液以及化妆品等[1]。由于TCS和TCC广泛、大量的使用以及污水处理厂对此类物质去除效率的限制[2],使得其在环境中被频繁地检出,特别是在活性污泥中,TCS的平均浓度为34.9 mg·kg-1,而TCC的浓度可达到10.2 mg·kg-1[3-4]。近年来,由于水资源的短缺,处理污水的农田灌溉以及活性污泥的农田利用已经成为美国等发达国家重要的农业实践,但TCS和TCC会随着污水及污泥进入土壤生态系统,具有很大的潜在环境风险,因此受到了持续的关注。
TCS和TCC具有一定的生态毒性。研究表明,mg·L-1浓度水平的TCS和TCC即可对食细菌秀丽隐杆线虫产生显著的生理和生殖毒性[5],此外,研究也显示,TCC、TCS以及甲基三氯生(Me-TCS)能在蜗牛和藻类体内生物蓄积,并产生生物放大效应[6-7]。重金属和TCS复合污染效应的研究表明,铜、锌与TCS的复合污染均显著减少了土壤微生物生物量,并增加了土壤微生物的代谢活性[8]。王凤花等[9]发现,TCS与镉单一及复合污染对土壤呼吸呈现激活—抑制—激活的生态效应,并显著抑制土壤蔗糖酶活性。Waller和Kookana[10]也发现,当TCS的浓度超过10 mg·kg-1时,土壤的呼吸作用受到了显著抑制。因此可以预期,土壤中普遍存在的TCS和TCC对土壤中的元素转化和生态系统服务功能会产生潜在影响。
在稻田生态系统,氮素是水稻产量的主要限制性营养元素,为了提高水稻产量,氮肥经常会被过量使用[11]。在好氧条件下,肥料中的氮素通过微生物的作用将会转化为各种形态氮,而各形态氮素之间的转化速率控制了各种形态的氮在土壤中含量的变化[12]。当TCS和TCC随处理污水和活性污泥进入水稻田时,由于其抗菌的性质,可能会对稻田土壤氮转化过程产生影响。例如,有研究显示,5 mg·kg-1和50 mg·kg-1的TCS分别显著抑制了砂土和黏土中的土壤净硝化活性[10]。N2O作为土壤硝化反应的中间产物也可能受到TCS和TCC暴露的影响,但目前有关TCS和TCC对稻田土壤N2O排放影响的研究尚未见诸报道。此外,以往有关外源污染物对土壤氮转化过程影响的研究大多仅关注其对氮素净转化速率(如净矿化和净硝化速率等)的影响,而对于控制氮形态含量变化的各个过程的初级转化速率的影响则鲜有涉及。考虑到土壤氮素在作物生长和环境效应中的重要性及TCS和TCC在土壤环境的广泛检出,很有必要从氮素初级转化过程角度开展TCS和TCC对土壤氮转化过程的影响。近年来,随着15N同位素示踪技术和模型数值优化算法的发展[13-14],使得同时量化土壤中多个氮素转化过程初级转化速率成为可能,为准确测定土壤氮素实际转化速率提供了可靠手段。为此,本文采用15N同位素稀释法结合Müller等[13]提出的氮转化数值模型,系统地研究不同浓度梯度下TCS和TCC单一或联合存在对水稻土好氧氮转化过程及N2O排放的影响,以期为合理评价TCS和TCC的土壤环境风险及稻田氮素管理提供科学借鉴。
1 材料与方法
1.1 试验材料
水稻土采自中国科学院常熟农业生态试验站水稻田,施氮肥量为300 kg·hm-2(以N计,下同),采样时间为2017年11月,采样时稻田处于休闲期。采样深度为0~20 cm,采集后的鲜土过2 mm筛,4℃保存备用。三氯生(纯度大于99%,TCS)和三氯卡班(纯度大于97%,TCC)购于Sigma-Aldrich(上海,中国),丙酮购于南京化学试剂股份有限公司,三氯生和三氯卡班的丙酮储备溶液于4℃冰箱保存备用。
1.2 15N示踪实验
本研究采用15N成对标记技术测定土壤中多个氮素转化过程的初级速率[13],实验操作参考Zhu等[15]的研究,实验中TCS和TCC的浓度设置参考土壤和底泥中的实际检出浓度[16-17]。首先,称取相当于30 g干土重的新鲜土样于250 mL三角瓶中,再加入1 mL的TCS、TCC以及TCS和TCC混合丙酮储备液(丙酮含量小于0.5%),使其在土壤中的浓度分别达到2和5 mg·kg-1TCS、1和2 mg·kg-1TCC、2 mg·kg-1TCS+1 mg·kg-1TCC和5 mg·kg-1TCS+2 mg·kg-1TCC,同时将不加抗菌剂的处理作为空白对照(CK),每个处理设置三个重复。每个处理采用15NH4NO3(15N丰度为10.3%)和NH415NO3(15N丰度为10.3%)成对标记,15NH4NO3和NH415NO3以溶液形式加入三角瓶中,加入量为1 mL,加入的标记液尽可能均匀地分布于土壤,其中,NH4+-N和NO3--N含量均为50 mg·kg-1(以N计,下同)干土。同时加入2.5 mL蒸馏水,调节土壤含水量至50%WHC(田间持水量)。随后,用保鲜膜将三角瓶封口,扎上小孔以便通气,最后在20℃恒温培养箱中培养96 h。
分别于加入标记液后的0.5、24、48和96 h随机从培养箱中取出各处理的样品,加入150 mL 2 mol·L-1KCl溶液,于20℃/250 r·min-1下振荡提取1 h,过滤,提取液保存于4℃冰箱中,并于一周内完成测定。提取液中-N和-N的测定用MgO-戴氏合金蒸馏法,即先在部分提取液中加入MgO蒸出之后加入戴氏合金,将还原为蒸出,馏出液均用硼酸+混合指示剂(甲基红+溴甲酚绿)吸收液吸收,0.02 mol·L-1标准硫酸滴定,可得到提取液中-N和-N的含量。酸化后的蒸馏液在80℃浓缩,然后用同位素比质谱仪(MAT-251,SerCon质谱公司,英国)测定15N丰度。
1.3 土壤氮初级转化速率和净硝化速率的计算
土壤氮的初级转化速率依据Müller等[13]的氮素转化模型结合马尔柯夫链蒙特卡洛随机采样方法(Markov chmin Monte Carlo Metropolis a l g o r i t h m, M C M C)计算方法得出,共包括8个初级转化速率:(1)有机氮矿化为铵态氮(MNorg);(2)铵态氮固定为有机氮(INH4);(3)铵态氮的释放(RNH4a);(4)铵态氮的吸附(ANH4);(5)自养硝化(ONH4);(6)异养硝化(ONorg);(7)硝态氮固定为难分解有机氮(INO3);(8)硝态氮异化还原为铵(DNRA)。本研究所用的7种处理土壤氮的初级转化速率符合一级或者二级动力学方程。土壤氮的初级转化速率的运算采用MCMC法,通过连续调整模型和实测的和-N的浓度及15N丰度,使拟合值最小化,避免局域最小值问题,确保模型运算过程中找到真正的全局最小值。此外,根据硝态氮总产生速率(ONH4+ ONorg)减去硝态氮总消耗速率(INO3+DNRA)计算得出净硝化速率。
1.4 N2O含量的测定
称取相当于10 g干土重的新鲜土样于120 mL血清瓶中,然后在瓶口贴上封口膜,20℃室内预培养一天。结束后,向血清瓶中加入0.5 mL 0.036 mol·L-1硝酸钾溶液,使得水稻土中N的浓度达到50 mg·kg-1。在考察TCS和TCC单一作用时,TCS的浓度梯度为0.01、0.1、1、2和5 mg·kg-1;TCC的浓度梯度为0.01、0.05、0.1、1和2 mg·kg-1。联合作用实验中,其浓度梯度(T C S+T C C,mg·kg-1)为0+0、0.01+0.01、0.1+0.05、1+0.1、2+1和5+2。此外,将不加抗菌剂的处理作为对照,每个处理设置3个重复,共需48个血清瓶。加入蒸馏水,调节土壤含水量至65%最大持水量(WHC),贴上封口膜,扎孔,保证通气。继续于20℃的恒温培养箱中培养96 h。
分别在加入抗菌剂后0.5、24、48和96 h采集N2O气体样品,每次采集气样前先去掉封口膜,用铝盖密封血清瓶。真空泵抽真空8 min后充入室内空气1 min,置于20℃恒温培养箱中培养3 h后,采集血清瓶上部气体,每次抽取气样前用注射器反复抽提瓶内气体3次以混匀气体,所采集的气样用配备电子捕获检测器(ECD)的气相色谱仪(Agilent 7890A,美国)测定。以高纯氮气作为载气,流速25 mL·min-1,使用不锈钢分离柱(内径为2 mm,长度3 m),填充材料为Porapak Q(80~100目),分离柱工作温度为55℃,检测器工作温度为330℃。
N2O产生速率的计算式如下:
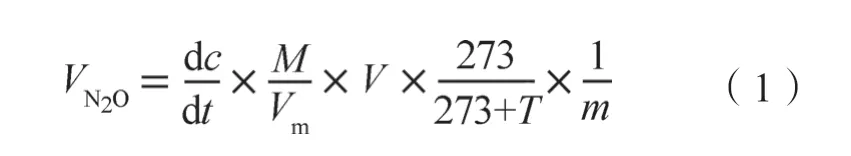
式中,VN2O表示N2O的产生速率,mg·kg-1·h-1;dc/dt为单位时间内血清瓶内气体浓度增加量,mg·kg-1·h-1;Vm为气体的摩尔体积,22.4 L·mol-1;M为摩尔质量,28 g·mol-1(N2O-N);V是血清瓶上部有效空间体积,m3;m为烘干土重,kg;T为测定气体时的温度,℃。N2O累积排放量为前后2次采样测定的排放通量平均值与时间间隔乘积的累加。
1.5 数据处理
利用S P S S 1 9.0 软件中的单因素方差分析(One-way ANOVA)(最小显著差异法(LSD)及邓肯法(Duncan)检验)方法对不同处理下氮的初级转化速率、净硝化速率、N2O排放速率以及N2O累积排放量的差异进行显著性分析,显著性水平设置为P<0.05。TCS和TCC的浓度与N2O累积排放量之间的关系采用皮尔森(Pearson)相关进行分析。
2 结 果
2.1 TCS和TCC处理下水稻土无机氮库含量及15N丰度
TCC和TCS各种处理下,水稻土15NH4NO3和NH415NO3处理-N和-N含量变化趋势一致,整个培养过程,土壤-N含量呈降低趋势而-N含量呈升高趋势(图1)。培养96 h后,TCC和TCS各处理下土壤的实测净硝化速率为正值,其中,5 mg·kg-1TCS+2 mg·kg-1TCC处理的实测净硝化速率最小(6.02 mg·kg-1·d-1),而2 mg·kg-1TCC处理最大(7.81 mg·kg-1·d-1)。与模型值相比,实测净硝化速率与其无显著性差异(P>0.05)。5 mg·kg-1TCS+2 mg·kg-1TCC处理的实测净矿化速率为负值(-0.47 mg·kg-1·d-1),而其余处理均为正值(0~0.75 mg·kg-1·d-1),2 mg·kg-1TCS处理的实测净矿化速率最大。图2显示,整个培养过程15NH4NO3处理土壤-N库的15N丰度显著降低(P<0.05),而-N库的15N丰度显著升高(P<0.05)。NH415NO3处理土壤NH4+-N库的15N丰度略有提高,而-N库的15N丰度显著降低(P<0.05)。
2.2 TCS和TCC处理下水稻土氮的初级转化速率和净硝化速率
根据Müller等[13]的15N转化模型,可计算出8个土壤氮的初级转化速率,结果发现,添加了TCS和TCC的水稻土氮的转化过程发生了显著改变(表1)。与CK的总矿化速率(1.67 mg·kg-1·d-1(以N计,下同))相比,除1 mg·kg-1TCC和5 mg·kg-1TCS+2 mg·kg-1TCC 处理外,其余的TCS和TCC单一及联合处理均显著(P<0.05)增加了总矿化速率(2.07~2.37 mg·kg-1·d-1)。此外,与CK相比(0.71 mg·kg-1·d-1),除了1 mg·kg-1TCC处理外,其余抗菌剂处理均显著(P<0.05)增加了水稻土的总同化速率(1.06~2.15 mg·kg-1·d-1)。水稻土的总同化速率随着TCS和TCC单一处理添加剂量的增加而增加,具有剂量效应,而TCS和TCC的联合处理则并未观察到明显的剂量效应。2 mg·kg-1TCC处理以及TCS和TCC联合处理显著(P<0.05)抑制了铵的吸附速率,其余处理虽然也对铵的吸附速率有所抑制,但并不显著。与CK相比,TCS和TCC单一和联合处理均有提高铵释放速率的趋势,但影响并不显著(表1)。
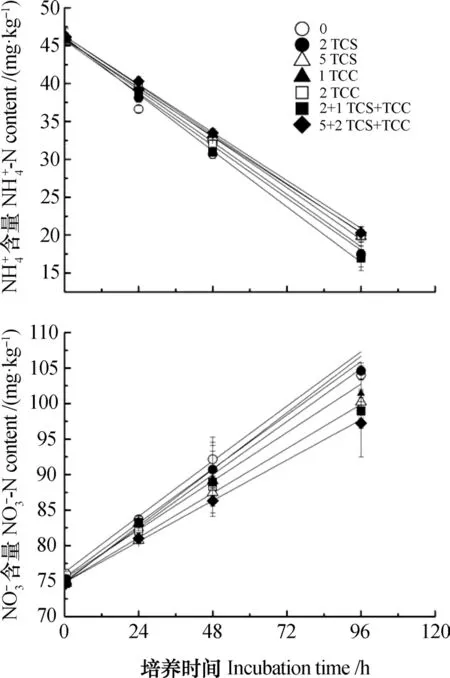
图1 三氯生和三氯卡班添加处理下土壤铵态氮和硝态氮含量的实测值(点)和模型模拟值(线)变化Fig. 1 Measured (Dots) and simulated (Line) concentrations of and in soil during the 96 h of incubation relative to treatment
TCS和TCC处理显著改变了水稻土硝态氮的总产生和总消耗过程。根据计算结果,CK和所有处理的异养硝化速率为0,说明该水稻土很可能缺少异养硝化菌。CK处理的自养硝化速率为8.67 mg·kg-1·d-1,而TCS和TCC单一及联合处理均显著(P<0.05)抑制了自养硝化速率(6.22~8.21 mg·kg-1·d-1),抑制率为5.30%~28.31%。自养硝化速率随着TCS单一处理及TCS和TCC联合处理浓度的增加而减小(TCS:r=-0.98,P=0.00;TCS+TCC:r=-0.97,P = 0.00),而TCC单一处理则无明显的剂量关系。与CK的硝态氮固定速率(0.50 mg·kg-1·d-1)相比,TCS和TCC单一及联合处理均显著(P<0.05)抑制了硝态氮的固定,其抑制率为78.04%~96.11%。CK和抗菌剂处理中均存在硝态氮异化还原成铵(DNRA)的过程,2 mg·kg-1TCS及5 mg·kg-1TCS+2 mg·kg-1TCC处理提高了DNRA的速率,但并不显著,其余的抗菌剂处理均显著(P<0.05)抑制了DNRA的速率,抑制率为31.99%~85.02%。2 mg·kg-1TCC处理促进了净硝化,但并不显著,其余的TCS和TCC处理均显著(P<0.05)抑制了净硝化速率,抑制率为2.44%~26.19%。
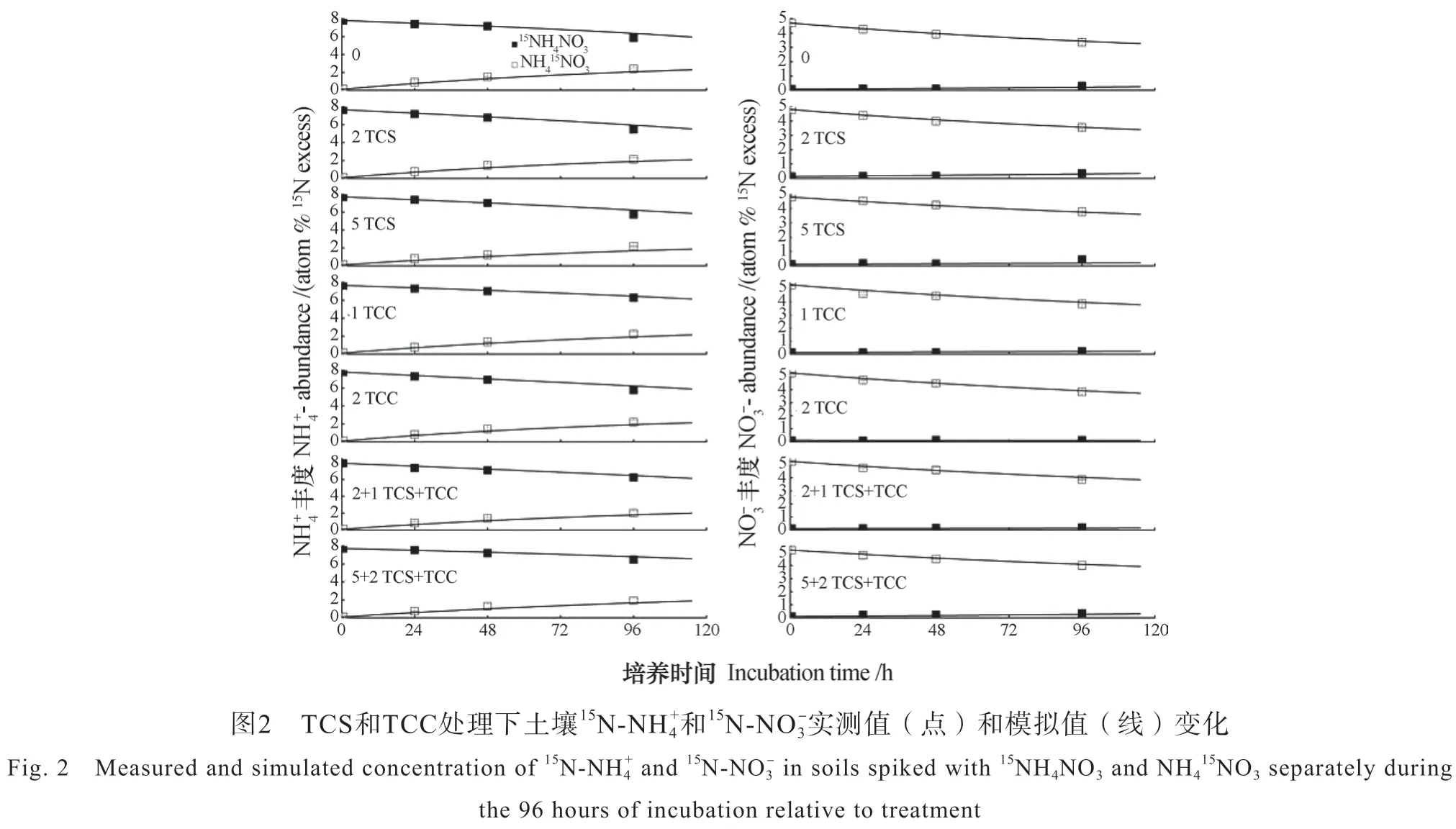
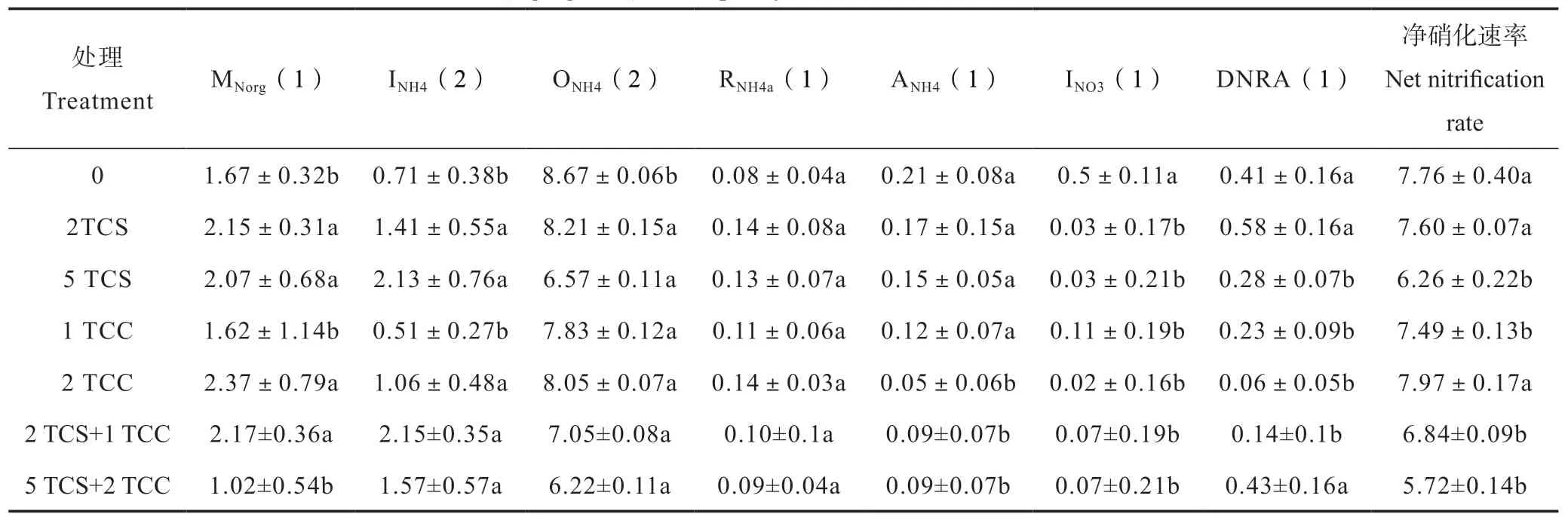
表1 TCS和TCC添加对水稻土氮素初级转化速率及净硝化速率的影响Table 1 Effects of TCS and TCC (alone or in combination) on N preliminary transformation rate/(mg·kg-1·d-1) and net nitrification rate/(mg·kg-1·d-1) in the paddy soil relative to treatment
2.3 TCS和TCC处理下水稻土N2O的排放速率和累积排放量
T C S 和T C C 的添加显著改变了水稻土N2O的排放速率(图3)。培养0.5 h,与对照相比(8.81×10-3mg·kg-1·h-1),TCS和TCC单一及联合处理均显著(P<0.05)提高了水稻土N2O的排放速率(11.52~13.83×10-3mg·kg-1·h-1),且随着TCS、TCC以及TCS和TCC联合处理浓度的增加,N2O的排放速率也随之增加,具有剂量效应。培养至24 h,对照处理N2O的排放速率为1.56×10-3mg·kg-1·h-1,与0.5 h相比,N2O的排放速率有所下降,此时,所有TCS和TCC单一及联合处理的排放速率在1.53~2.65×10-3mg·kg-1·h-1之间。TCC单一处理以及TCS和TCC联合处理均显著地(P<0.05)提高了水稻土N2O的排放速率,而TCS单一处理仅在2和5 mg·kg-1时显著(P<0.05)提高了N2O排放速率。随着培养时间的延长,对照处理N2O的排放速率(1.82×10-3mg·kg-1·h-1)有所上升,2和5 mg·kg-1TCS单一处理、2 mg·kg-1TCC单一处理以及2 mg·kg-1TCS+1 mg·kg-1TCC和5 mg·kg-1TCS+2 mg·kg-1TCC处理显著(P<0.05)提高了其排放速率,其余的抗菌剂处理无显著影响。当培养至96 h,与对照相比,所有的TCS和TCC单一及联合处理的N2O排放速率均无显著变化。
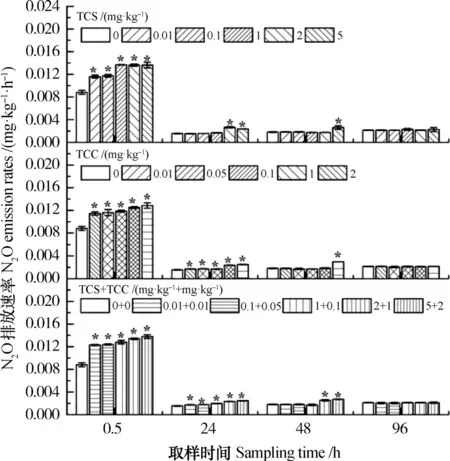
图3 TCS和TCC添加对水稻土N2O排放速率的影响Fig. 3 Effects of TCS and TCC (alone or in combination) on N2O release rate from the paddy soil relative to treatment
图4显示,所有TCS和TCC单一及联合处理均显著(P<0.05)增加了水稻土N2O的累积排放量。对照水稻土N2O的累积排放量为0.26 mg·kg-1,TCS和TCC单一和联合处理的累积排放量在0.30~0.38 mg·kg-1之间,提高了12.04%~43.11%。TCS和TCC单一处理N2O的累积排放量分别为对照处理的1.13倍~1.42倍和1.13倍~1.44倍;TCS和TCC联合处理N2O累积排放量为对照处理的1.17倍~1.44倍。TCS和TCC单一及联合处理中,水稻土N2O的累积排放量随着TCS和TCC添加量的增加而显著增加,呈现明显的剂量效应。
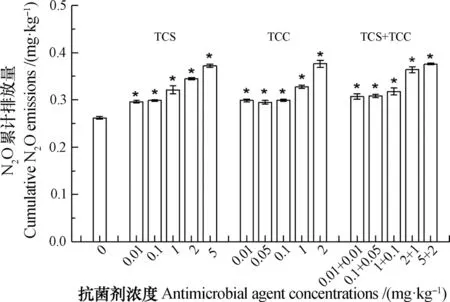
图4 TCS和TCC添加对水稻土N2O累积排放量的影响Fig. 4 Effects of TCS and TCC (alone or in combination)on cumulative N2O emission from the paddy soil relative to treatment
3 讨 论
3.1 TCS和TCC处理对水稻土矿化-同化循环及硝化作用的影响
氮是限制水稻生产的营养元素,而水稻土中的氮通常以有机态氮和无机态氮两种形式存在。研究发现,某些植物可直接利用土壤中的有机态氮如氨基酸,但可供绝大多数作物吸收利用的氮仍以无机态氮为主[18-19]。土壤中无机态氮的供应包括供氮量及供氮过程两个方面,其中,供氮过程是评价供氮能力的重要指标。自然界中,土壤氮素的矿化-同化循环是两个重要环节,也是决定供氮能力的重要因素[20]。本研究发现,与对照相比,TCS和TCC处理的总矿化速率有所增加(表1)。当水稻土中加入TCS和TCC后,由于其广谱抗菌的性质,部分微生物被杀死,可溶性细胞质如糖类、氨基酸和肽类就会从死亡细胞中泄漏出来,而存活的微生物可利用这部分营养源[21]。由于这部分营养源更加容易分解,发生矿化的微生物工作效率可能会更高,因此,TCS和TCC处理反而提高了水稻土的矿化速率。Ingham 和Coleman[22]发现,土壤微生物可将链霉素和放线菌酮直接作为碳源和氮源,而TCS和TCC与其有类似的官能团以及抗菌作用,因此,TCS和TCC也可能为微生物提供了碳源和氮源,提高了微生物的活性,这有待进一步研究证实。
传统观点认为,硝化作用是硝化细菌以CO2作为碳源,将铵态氮转化为硝态氮,并获得能量的过程,而近期研究发现,在酸性土壤中,有机氮也可直接被氧化为硝态氮,即异养硝化作用[23-24]。本研究发现,对照以及TCS和TCC单一及联合处理的异养硝化速率为0,说明水稻土中很可能缺少异养硝化菌。图5中,所有TCS和TCC单一及联合处理的自养硝化速率均受到了显著抑制。自养硝化分两个阶段完成,即氨氧化过程和亚硝酸氧化过程,氨氧化作用也被称为亚硝化作用,是硝化过程的限速步骤[25],因此,以往对硝化过程的研究主要集中在氨氧化过程。本研究中,TCS和TCC处理可能抑制了氨氧化菌(氨氧化古菌和氨氧化细菌)或者亚硝化细菌的活性。Waller和Kookana[10]发现,当TCS在砂土中的浓度超过5 mg·kg-1,将会抑制土壤的净硝化活性,这与本文的研究结果一致。值得关注的是,TCS和TCC单一及联合处理对净硝化速率的影响结果与对自养硝化速率的影响基本一致,可能的原因是,与硝态氮的总产生(自养硝化和异养硝化)相比,硝态氮的总消耗速率(硝态氮的固定以及DNRA过程)很小,因而,硝态氮的总产生速率是净硝化速率较高的主导因素。土壤中氮的同化是指无机氮被微生物同化吸收进入有机氮库的过程,其中,微生物同化铵态氮进入有机氮库的过程即为铵态氮的同化,是评价土壤保氮能力的一个重要指标。TCS处理以及TCS和TCC的联合处理均显著促进了水稻土铵态氮的同化,而1 mg·kg-1TCC处理对其速率无显著影响,2 mg·kg-1TCC处理显著提高了铵态氮的同化速率,这说明低浓度TCC处理未达到效应值。TCS和TCC单一及联合处理抑制了自养硝化过程,这可能为铵态氮的同化提供了底物,从而增加了其同化速率。Booth等[26]发现,土壤中铵态氮的微生物同化速率与氮的矿化速率显著正相关,但在本研究中,有机氮的矿化与铵态氮的同化并无显著的相关性,这可能与土壤的理化性质等有关系。
3.2 T C S 和T C C 处理对水稻土硝态氮固定及DNRA过程的影响
硝态氮的固定(INO3)是一个消耗硝态氮的过程,可以避免硝态氮的过度累积。对照处理的INO3是TCS和TCC单一及联合处理的4.5倍~25倍,这可能是因为TCS和TCC是广谱抗菌剂,微生物需要较多的能量去适应存在抗菌剂的胁迫环境,因此,与对照硝态氮的同化速率相比,TCS和TCC单一及联合处理的INO3几乎可以忽略。铵态氮的同化速率为硝态氮同化速率的1.4倍~71.0倍,这与Low等[27]的研究结果一致,说明土壤微生物更倾向于铵态氮的同化。对于另一个消耗硝态氮的过程DNRA来说,2 mg·kg-1TCS处理对其无显著影响,而5 mg·kg-1TCS处理显著抑制了DNRA速率,说明TCS对DNRA过程的抑制有剂量效应,而TCC处理均显著抑制了DNRA速率,说明参与DNRA过程的微生物对TCC更敏感。
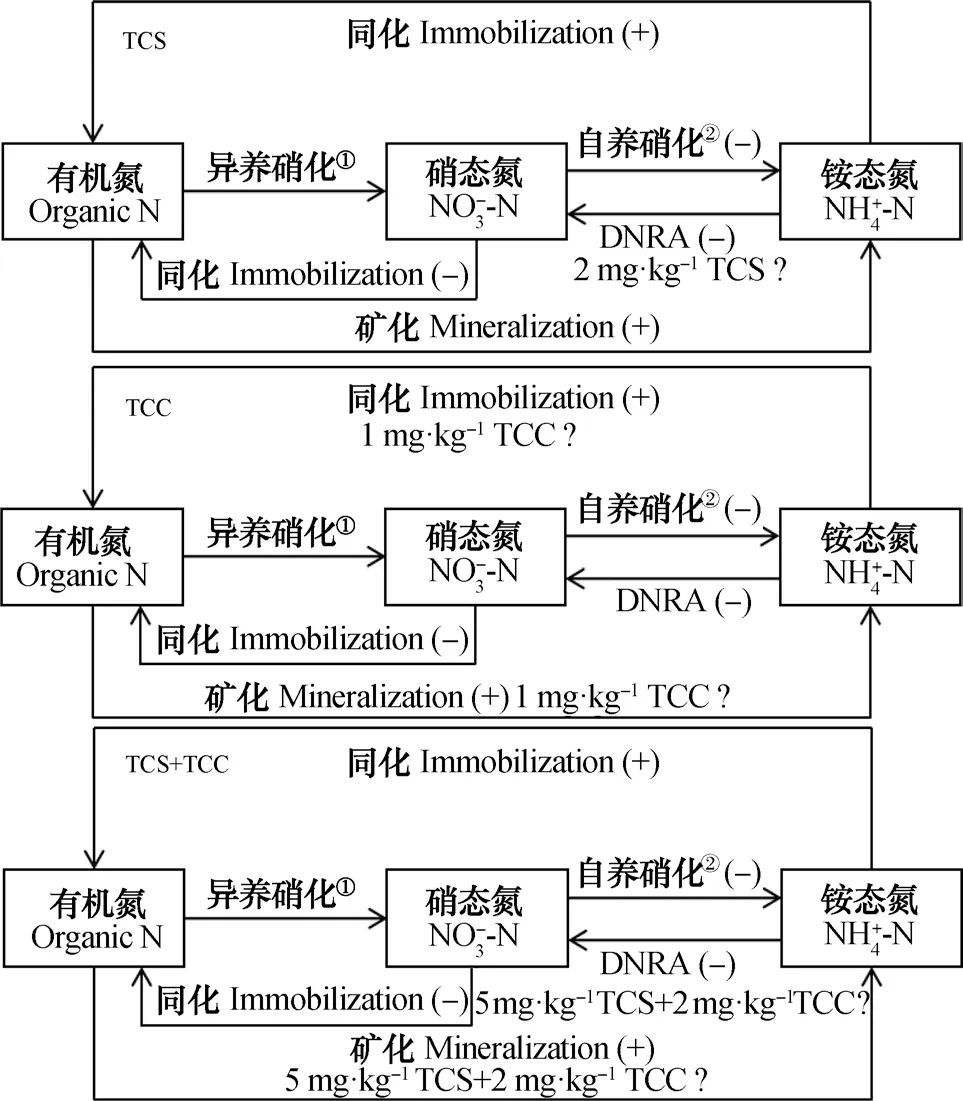
图5 不同抗菌剂对水稻土氮素初级转化速率的影响示意图Fig. 5 Schematic of the effects of antimicrobial agents,separately, on soil N preliminary transformation rate in the paddy soil
3.3 TCS和TCC处理对水稻土N2O排放的影响
N2O是一种受人类活动影响的重要温室气体,在自然或耕作土壤中,硝化和反硝化是土壤中N2O的主要来源。除此之外,化学反硝化、硝化细菌反硝化、硝态氮异化还原成铵(DNRA)以及羟胺的化学分解等过程均能产生N2O[28]。与对照相比,TCS和TCC处理显著地促进了N2O的排放,是对照N2O累积排放量的1.13倍~1.44倍,TCS和TCC促进N2O排放的具体机制尚待进一步研究,一种可能的解释是土壤氮转化微生物部分利用TCS和TCC作为碳源,从而促进了N2O的排放[29]。本文中,在对照与抗菌剂处理的水稻土中,均发现了DNRA过程,这也说明TCS和TCC处理促进N2O的排放也可能是通过对DNRA过程的影响产生的。以往研究认为,DNRA过程的发生需要严格厌氧的环境及高含量碳源供给,但近期一些研究表明,DNRA过程的发生对环境条件的要求可能并不像过去认为的那样严格,相比于反硝化,DNRA 对氧气的存在并不十分敏感,在好氧情况下,DNRA较反硝化更具竞争力[30-31],在并不完全厌氧的热带和温带森林土壤中具有很高的初级DNRA 转化速率,并且DNRA 是这些土壤中硝酸根的主要消耗过程[32-33]。目前尚不清楚TCS和TCC处理促进N2O产生的具体途径,需要进一步探索其促进N2O排放的机理,可能的一种解释是TCS和TCC处理选择性地抑制了非典型N2O还原型(nosZ II)微生物的活性[34]。
4 结 论
TCS和TCC的添加改变了水稻土好氧氮转化过程,1 mg·kg-1TCC单一处理及2 mg·kg-1TCC+5 mg·kg-1TCS联合处理对水稻土氮素的矿化-同化无显著影响,其余TCS和TCC处理均促进了氮的矿化-同化循环。此外,TCS和TCC处理显著降低了自养硝化速率、硝态氮的微生物固定速率以及DNRA速率(其中,2 mg·kg-1TCS处理对DNRA速率无显著影响)。值得注意的是,与对照相比,在实验周期内(4天),TCS和TCC处理显著地促进了N2O的排放,其累积排放量为对照的1.13倍~1.44倍。TCS和TCC添加增加了水稻土N2O的排放,可能影响稻田生态系统对臭氧层破坏及温室效应的贡献。因此,未来评价TCS和TCC土壤生态风险时,应重视其对好氧氮转化过程及N2O排放的影响。
致 谢 感谢中国地质科学院岩溶地质研究所杨霖、罗柳玲、李菁等同学在15N示踪实验给予的帮助;感谢中国科学院南京土壤研究所柴延超、李进芳、马舒坦等同学在N2O排放实验上给予的帮助。
