淡紫拟青霉TD16促进雨生红球藻生长和油脂合成的研究
2019-08-22董庆霖邢向英崔江坤王雪晴
董庆霖,王 瑶,邢向英,崔江坤,王雪晴
(河北工业大学化工学院,天津 300130)
雨生红球藻是一种高附加值的单细胞绿藻,在胁迫状态下能够大量合成虾青素和油脂[1]。雨生红球藻油脂的脂肪酸组成主要为棕榈酸、油酸和亚麻酸等,可作为生物柴油的理想原料[2-3]。为提高雨生红球藻用于生物柴油生产的经济性和可持续性[4],通常采用油脂和虾青素联产工艺[5-6],但此工艺需要在胁迫条件下诱导油脂和虾青素合成,降低了雨生红球藻的生长速率,故油脂平均比合成速率依然较低。因此,如何同时提高生物量和油脂的平均合成速率,是雨生红球藻用于生产生物柴油过程中所必须解决的关键问题。
自然界中微藻通常与其他微生物共生,两者间的相互作用可影响藻细胞的生长及组成[7],许多微生物对微藻生长和油脂积累具有促进[8-15]或抑制作用[16-17]。目前,微藻-真菌混合培养的研究大多集中于丝状真菌促进藻细胞沉降从而降低采收成本[18],而丝状真菌对微藻生长和油脂合成的研究相对较少。
淡紫拟青霉TD16(以下简称TD16)是从蓝藻培养液中分离的一种丝状真菌[19],TD16可促进植物种子萌发以及叶片根系生长[20]。由于微藻和植物都是光合生物,因此本实验将雨生红球藻与TD16混合培养以研究TD16对雨生红球藻细胞生长和油脂合成的影响。
1 材料与方法
1.1 实验材料
1.1.1 藻种及培养基
雨生红球藻,购自中国科学院武汉水生生物研究所,于BBM培养基中培养;淡紫拟青霉TD16,由本实验室分离并保存于中国科学院微生物研究所菌物标本馆,于PDA培养基中培养。
BBM液体培养基:硝酸钠250 mg/L,磷酸二氢钾175 mg/L,硫酸镁75 mg/L,磷酸氢二钾75 mg/L,乙二胺四乙酸二钠50 mg/L,氢氧化钾31 mg/L,氯化钠25 mg/L,氯化钙25 mg/L,硼酸11.4 mg/L,硫酸锌8.82 mg/L,硫酸铁4.98 mg/L,钼酸钠1.79 mg/L,硫酸铜1.57 mg/L,硝酸钴0.49 mg/L。
PDA培养基:马铃薯200 g/L,无水葡萄糖20 g/L,琼脂20 g/L。
1.1.2 仪器与设备
LG16-B台式高速离心机,723N可见分光光度计,GXZ-300D光照培养箱,X-521无菌工作台,TDA-8002恒温水浴锅,DH-101-0S电热恒温鼓风干燥机,HZQ-QG全温振荡器,XSZ-H光学显微镜,YX280加压灭菌锅,LRH-150S恒温恒湿培养箱,Multi N/C 3100有机碳分析仪,JP-020超声波清洗机。
1.2 实验方法
1.2.1 无菌雨生红球藻藻种的制备
将纳他霉素、庆大霉素按10 mg/L和100 mg/L加至雨生红球藻培养液中,于25℃、光照强度60 μmol/(m2·s)下静置培养14 d。将培养结束后的藻液稀释105个/mL,取100 μL涂布至BBM平板上,重复多次得到无菌藻落,将无菌藻落接种至BBM液体培养基中培养,用于后面的单独培养和混合培养。
1.2.2 雨生红球藻细胞密度及胞外有机碳质量浓度的测定
取10 mL浓度为0.34×107个/mL的雨生红球藻无菌藻液,将其接种至100 mL BBM液体培养基中,于25℃、光照强度60 μmol/(m2·s)下静置培养。隔天取1 mL无菌藻液,用光学显微镜和血球计数板测定藻细胞个数。另取5 mL藻液于8 000 r/min离心5 min,上清通过0.2 μm滤膜过滤除菌,用有机碳分析仪测定胞外有机碳(Extracellular organic carbon,EOC)的质量浓度。测定条件为:载气为超纯氧气,压力0.3 MPa,温度1 100℃。
1.2.3 TD16在雨生红球藻EOC中的生长
将TD16接种于PDA固体培养基,28℃下培养5 d,用20 mL无菌水冲洗斜面,过滤菌丝,得到TD16孢子悬浮液。将培养14 d的雨生红球藻无菌藻液离心,上清通过0.2 μm滤膜过滤除菌,与等体积BBM液体培养基混合,对照组为BBM液体培养基,接种100 μL TD16孢子悬浮液,28℃、110 r/min摇床培养。用有机碳分析仪测定EOC质量浓度的变化,TD16的生长情况由OD580表示。
1.2.4 雨生红球藻单独培养及与TD16混合培养
用血球计数板将培养5 d即生长到对数期的雨生红球藻藻细胞浓度调整至1×107个/mL、TD16孢子悬浮液浓度调整至1.36×107个/mL。取10 mL藻液分别与2、1、0.5 mL TD16孢子悬浮液按5∶ 1、10∶ 1、20∶ 1体积比接种至100 mL BBM液体培养基,用BBM液体培养基将接种量补齐至12 mL。对照组加10 mL藻液与2 mL BBM液体培养基,于25℃、光照强度60 μmol/(m2·s)下静置培养,每日手摇3次,每组设3个平行。
1.2.5 生物量、平均生长速率、平均比生长速率和倍增时间的测定
生物量即细胞干重的测定参考Cho等[21]的方法并加以改动。向混合培养液中加入质量分数为2%的十二烷基硫酸钠超声并低速离心,使藻细胞与菌丝分离,烘干称得藻细胞干重。平均比生长速率(μ)、平均生长速率(r)和倍增时间(DT)[22]由下式计算。
(1)
(2)
(3)
式中:X0和Xn分别为微藻细胞在培养时间t0和tn时的藻细胞干重,g/L。
1.2.6 雨生红球藻油脂含量及脂肪酸组成分析
取25 mg烘干研磨后的藻粉悬浮于5 mL氯仿-甲醇(体积比2∶ 1)提取液中,在100 Hz下超声提取10 min,然后8 000 r/min离心10 min,重复提取分离3次,合并氯仿相,挥干溶剂,烘干称重,计算油脂含量。油脂平均合成速率(r1)、平均比合成速率(q)[22]由下式计算。
(4)
(5)
式中:X0、G0和Xn、Gn分别为雨生红球藻在培养时间t0和tn时的生物量和油脂含量。
将2 mL 1%硫酸-甲醇溶液加入烘干至恒重的油脂中,80℃水浴锅中加热60 min,取出冷却至室温,加入5 mL去离子水和2 mL正己烷,8 000 r/min离心10 min,收集上清液。沉淀加入1 mL正己烷继续提取,离心将2次上清液合并,氮气吹干。用0.5 mL正己烷重新溶解,经0.2 μm滤膜过滤,用气相色谱仪分析脂肪酸组成。色谱条件:DB-23(安捷伦)毛细管柱;起始温度为80℃,采用程序升温以12℃/min升至140℃,再以4℃/min升至240℃,保持20 min;进样口温度250℃;检测器温度280℃;载气流量80 mL/min;进样量1 μL。
1.2.7 硝态氮质量浓度测定[23]
将硝酸钠标准品烘干至恒重,配制成质量浓度为0、50、100、150、200、250、300 mg/L的标准溶液,分别取0.1 mL 于试管中,加入0.4 mL 5%的水杨酸-浓硫酸溶液,于室温下显色25 min后向其中加入9.5 mL 8%的氢氧化钠溶液,摇匀,冷却至室温,测定410 nm下的吸光度,以硝酸钠质量浓度(X)为横坐标,吸光度(Y)为纵坐标,绘制标准曲线,经拟合得回归方程Y=0.096 62X-0.010 26。
将雨生红球藻培养液离心,取0.1 mL上清液于试管中,按上述方法测定410 nm下的吸光度,通过硝酸钠标准曲线回归方程求出硝态氮质量浓度。
1.2.8 叶绿素a质量浓度的测定
参照Wellburn[24]的方法。取2 mL雨生红球藻培养液,离心弃上清,将微藻细胞悬浮于90%的甲醇溶液中,于50℃水浴30 min,8 000 r/min离心10 min,收集上清液。以90%甲醇为对照,测定上清液于652 nm和665 nm处的吸光度(A),通过式(6)得出叶绿素a的质量浓度(Chla)。
Chla=16.82×A665-9.28×A652
(6)
1.2.9 虾青素质量浓度和含量的测定
虾青素质量浓度的测定参考文献[25]。取5 mL样品,于5 000 r/min下离心10 min,弃上清,将藻细胞悬浮于含有5 g/100 mL KOH的3 mL甲醇中,于70℃水浴加热5 min,离心去上清(除叶绿素)。用5 mL二甲基亚砜提取至藻细胞无色,测定提取物在490 nm处的吸光度(OD490),用下式计算虾青素的质量浓度(C)。所有步骤均在黑暗中进行。虾青素含量=虾青素质量浓度/生物量。
C=(4.5×OD490×Va)/Vb
(7)
式中:Va为二甲基亚砜的体积;Vb为雨生红球藻样品的体积。
2 结果与讨论
2.1 雨生红球藻EOC的变化及TD16代谢EOC进行生长的情况
藻细胞在光合自养过程中会分泌EOC[16]。雨生红球藻细胞密度和EOC质量浓度的变化如图1所示,TD16利用雨生红球藻EOC生长和EOC质量浓度变化如图2所示。
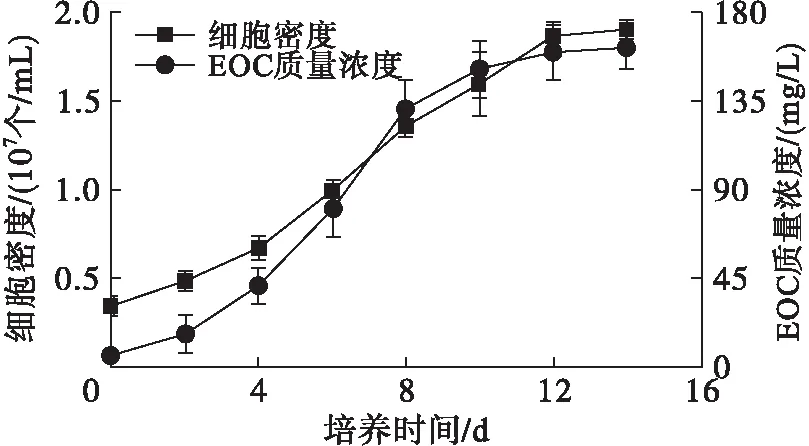
图1 雨生红球藻细胞密度及EOC质量浓度的变化
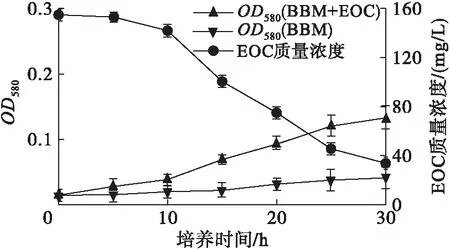
图2 TD16在EOC中的生长及EOC质量浓度的变化
由图1可见,雨生红球藻EOC质量浓度随藻细胞生物量的增加而增加,当藻细胞生长进入到稳定期,EOC质量浓度也逐渐趋于平稳,最大值为162.33 mg/L。由图2可见,TD16与雨生红球藻混合培养,TD16的生物量随培养时间延长不断增加,且随着TD16的生长EOC质量浓度不断降低,表明藻细胞分泌的EOC可以被TD16利用,为TD16与雨生红球藻在光合自养条件下混合培养提供了基础。
2.2 雨生红球藻与TD16接种比例的确定
藻菌混合比例是影响体系中微藻生长的重要因素,本研究设置3组不同藻菌比(体积比)以确定最佳混合比例,结果如表1所示。
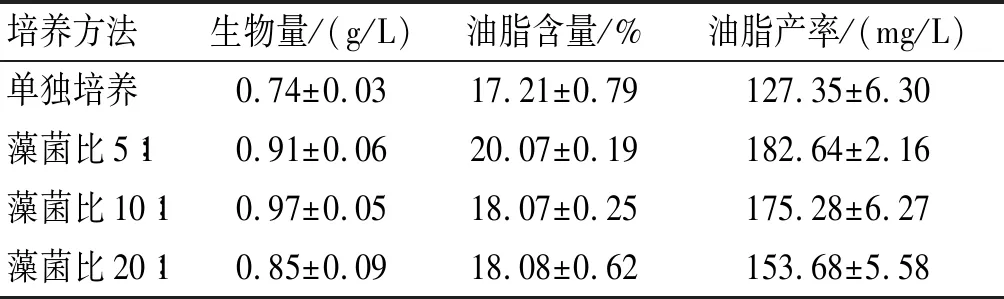
表1 藻菌比对雨生红球藻生物量、油脂含量和油脂产率的影响
注:培养时间14 d。
由表1可见:混合培养与单独培养相比,藻菌比为10∶ 1时对生物量的促进作用最明显,此时生物量为0.97 g/L,比单独培养提高31.08%;藻菌比为5∶ 1时油脂含量提高明显,为20.07%,比单独培养提高16.62%;油脂产率在藻菌比为5∶ 1时最高,达到了182.64 mg/L。因此,为提高油脂产率,以下实验均采用藻菌比5∶ 1进行研究。
2.3 雨生红球藻生物量和动力学参数的变化
雨生红球藻单独培养和与TD16混合培养过程中生物量的变化如图3所示,藻细胞生长的动力学参数如表2所示。
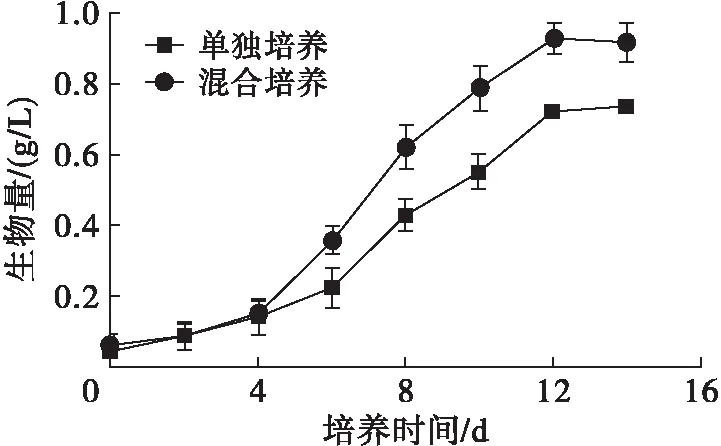
图3 雨生红球藻生物量的变化
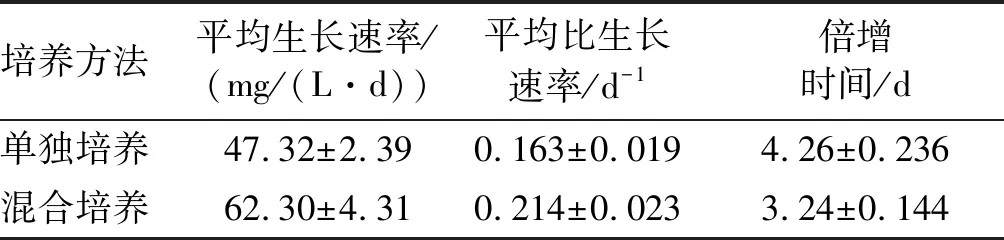
培养方法平均生长速率/(mg/(L·d))平均比生长速率/d-1倍增时间/d单独培养47.32±2.390.163±0.0194.26±0.236混合培养62.30±4.310.214±0.0233.24±0.144
注:培养时间14 d。
由图3可见,藻细胞生物量从第4天开始迅速增加,培养结束后,混合培养生物量为0.92 g/L,比单独培养提高24.32%。由表2可见,混合培养中平均生长速率和平均比生长速率与单独培养相比分别提高31.66%和31.29%,倍增时间缩短了23.94%。混合培养雨生红球藻生物量提高的原因可能是TD16分泌促生长因子促进了藻细胞的的生长。Voinove等[26]发现淡紫拟青霉可以分泌植物激素β-吲哚乙酸(IAA),但杨婷等[27]提出淡紫拟青霉的促生长活性因子不是IAA。我们前期实验证明TD16发酵液可明显促进植物生长[20],经硫酸铵分级沉淀和SDS-PAGE确定促生长因子为蛋白类物质。与此一致,夏汉祥等[28]发现淡紫拟青霉对菜心种子生长具有显著的促进作用,并确定其产生的类植物生长素为水溶性蛋白质。此外,雨生红球藻单独培养过程中由于光合作用导致培养液中O2浓度上升而CO2浓度下降,二者均导致光合作用效率下降[25],与其他藻-菌混合培养相似[6,22,25],混合培养过程中TD16吸收O2释放CO2,并且TD16的菌丝有利于藻细胞附着,提高了菌丝和藻细胞之间的气体传质效率[16],促进了光合作用。
2.4 培养液中硝态氮质量浓度的变化
雨生红球藻单独培养和与TD16混合培养培养液中硝态氮质量浓度的变化如图4所示。
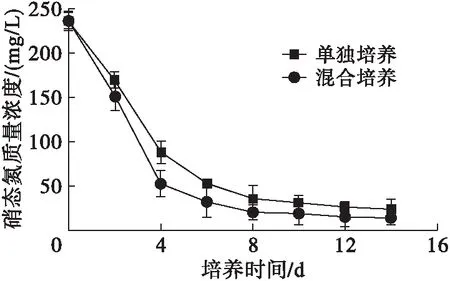
图4 培养液中硝态氮质量浓度的变化
由图4可见,混合培养和单独培养培养液中硝态氮质量浓度均在培养前期迅速下降,到第4天分别下降了77.85%和62.79%,第4天后缓慢下降,另外混合培养硝态氮质量浓度的下降速度明显快于单独培养,说明混合培养过程中TD16提高了硝态氮的代谢速率。
2.5 培养液pH的变化
用pH计测定了雨生红球藻单独培养和与TD16混合培养过程中培养液pH的变化,结果如图5所示。
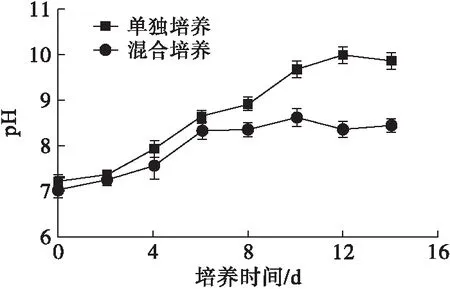
图5 培养液中pH的变化

2.6 雨生红球藻叶绿素a质量浓度的变化
为了研究油脂合成与光合作用的关系,测定了雨生红球藻单独培养和与TD16混合培养叶绿素a质量浓度的变化,结果如图6所示。
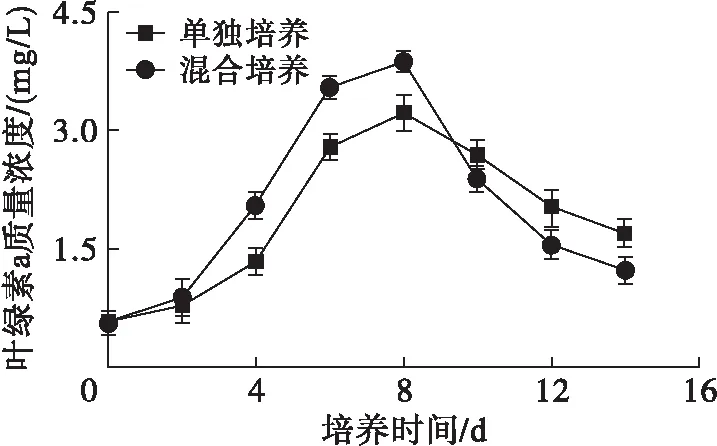
图6 雨生红球藻叶绿素a质量浓度的变化
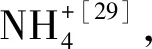
2.7 雨生红球藻油脂参数分析及脂肪酸组成的变化
培养14 d雨生红球藻油脂含量、油脂产率和动力学参数如表3所示,脂肪酸组成分析结果如表4所示。

表3 雨生红球藻油脂含量、油脂产率和动力学参数的分析
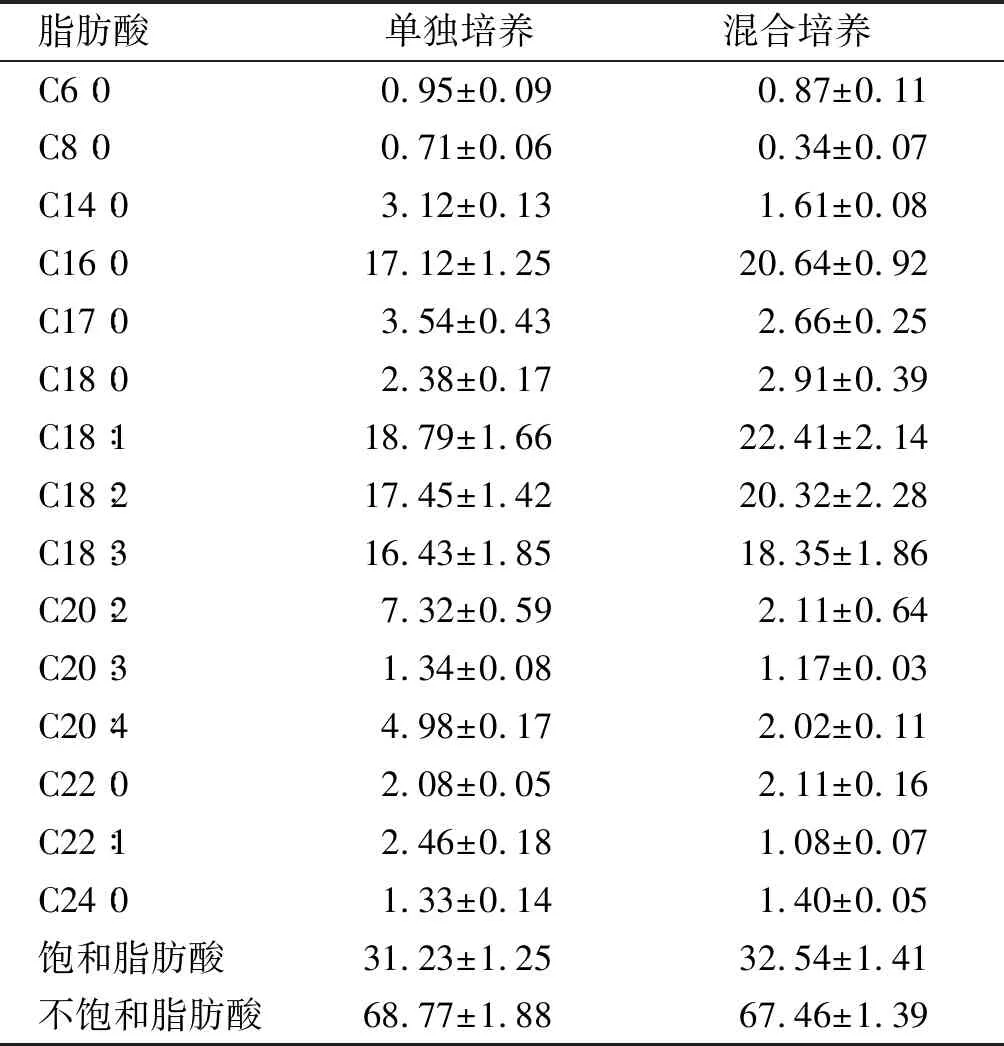
表4 雨生红球藻脂肪酸组成及含量 %
由表3可见,混合培养与单独培养相比雨生红球藻的油脂含量、油脂产率、平均合成速率和平均比合成速率分别提高了16.97%、45.59%、45.64%和16.67%。混合培养过程中油脂产率的提高主要归因于两个方面,即生物量的提高和油脂合成速率的提高,后者的提高主要是由于混合培养过程中氮质量浓度的快速下降导致的氮饥饿和TD16释放CO2提高了反应体系中CO2的浓度,二者均能提高油脂的合成速率[25]。
由表4可见,两种培养方法雨生红球藻油脂中脂肪酸组成基本相同,主要组分都为十六碳和十八碳脂肪酸,占总脂肪酸的72.17%~84.63%。混合培养与单独培养相比,饱和脂肪酸从31.23%上升为32.54%,不饱和脂肪酸从68.77%下降为67.46%,其中C16∶ 0和C18∶ 1分别提高20.56%和19.27%,脂肪酸含量的改变可能是因为培养液中CO2和胞外有机物浓度的变化引起的[30]。
2.8 雨生红球藻虾青素的质量浓度和含量的变化
虾青素是脂溶性次级产物,当培养液中硝态氮含量趋于0时才开始合成,为了研究油脂含量提高的同时虾青素的变化,测定培养8 d后虾青素的质量浓度和含量,结果如图7所示。

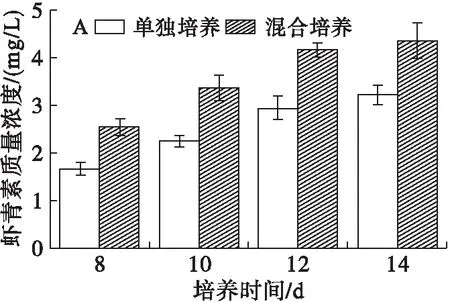
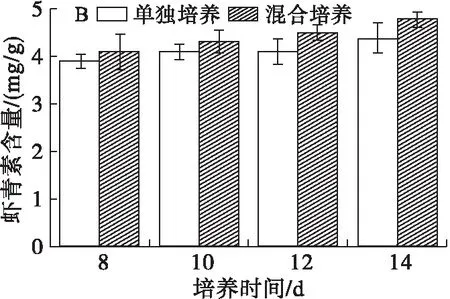
图7 雨生红球藻虾青素的质量浓度和含量
3 结 论
本研究确定了雨生红球藻与TD16混合培养的最佳接种比例,并证明混合培养过程中TD16能够稳定pH、促进氮代谢和叶绿素的合成,提高雨生红球藻的生物量、油脂产率、油脂平均合成速率和虾青素含量。因此,雨生红球藻与TD16混合培养为生物柴油的生产提供了一种新的反应模式。
