穗花杉双黄酮对3T3-L1细胞增殖、凋亡 及生物钟的影响*
2019-08-22王曜晖赵智权杜运松袁冰舒王刚
王曜晖,赵智权,杜运松,袁冰舒,王刚
(遵义医学院,贵州 遵义 563003)
穗花杉双黄酮是卷柏中的一种多酚化合物[1],具有降低血糖、抗炎、抗氧化、抗病毒、抗辐射及抗肿瘤等多种生物学功能[2-15]。肥胖与前脂肪细胞的过度分化、增生及脂肪细胞肥大密切相关[16]。肥胖机体出现炎症细胞浸润,相关炎症基因表达升高[17]。昼夜节律运动输出周期故障蛋白(circadian locomotor output cycles kaput, CLOCK)、脑及肌肉组织芳香烃受体核转运蛋白的类似蛋白1(the brain and muscle arnt-like protein-1, BMAL1)的异常表达可导致脂质代谢异 常[18-20]。本实验将不同浓度的穗花杉双黄酮作用于正常和过表达CLOCK的3T3-L1细胞后,观察其对3T3-L1细胞增殖、凋亡的影响,并探讨其与生物钟基因的关系。
1 材料与方法
1.1 材料与试剂
穗花杉双黄酮(160523,纯度>98%)购自成都瑞芬恩科技有限公司,3T3-L1购自中国科学院上海生命科学研究院细胞资源中心,鼠抗CLOCK、兔抗BMAL1、兔抗Cleaved caspase-3及兔抗Bcl-2均购自美国Proteintech公司,抗鼠二抗、抗兔二抗及Click-iTTMEdU Alexa FluorTM555 Imaging Kit均购自美国Sigma公司,逆转录试剂和RealMasterMix(SYBR Green)购自北京天根生物化学科技有限公司,正反向引物由上海捷瑞生物工程有限公司合成。
1.2 主要仪器
CFX96 touch荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)仪(美国Bio-Rad公司),Gallios流式细胞仪(美国Beckman Coulter公司)。
1.3 实验方法
1.3.1 药物配制穗花杉双黄酮用二甲基亚砜溶解,储存浓度为10 g/L,0.22μm孔径滤膜过滤除菌,于4℃冰箱保存备用,使用前用培养基稀释至所需浓度。
1.3.2 3T3-L1细胞培养和分组3T3-L1细胞培养于含10%胎牛血清的达尔伯克改良伊格尔培养基,培养条件为37℃,5%二氧化碳CO2。穗花杉双黄酮按0.0、2.5、5.0、10.0、20.0及40.0 mg/L质量浓度分成6组。
1.3.3 CCK-8检测细胞增殖将3T3-L1细胞接种到96孔板中,200μl/孔细胞悬液,贴壁培养24 h,加入不同质量浓度的穗花杉双黄酮培养基,继续培养24 h,以换液的方式加入含10% CCK-8的培养基,培养4 h,测定450 nm处的吸光度,参比波长600~650 nm。
1.3.4 实时逆转录聚合酶链反应(real-time reverse transcription-polymerase chain reaction, real-time RTPCR)检测生物钟基因的表达从0 h开始,每间隔4 h(共6次)提取3T3-L1细胞的总核糖核酸(RNA),并检测培养箱中3T3-L1细胞CLOCK和BMAL1的表达情况。见表1。

表1 real-time RT-PCR引物序列
将不同浓度穗花杉双黄酮作用于3T3-L1细胞,培养24 h后提取总RNA,逆转录后用real-time RTPCR检测其表达情况,反应条件:95℃预变性5 min,95℃变性5 s,57℃退火30 s,57℃延伸5 s,共循环40次。real-time RT-PCR结束后,计算CLOCK和BMAL1 mRNA与β-actin的相对表达量。
1.3.5 Western blotting检测生物钟蛋白的表达在 6孔板中种入细胞,24 h后观察各孔细胞贴壁均匀,将不同质量浓度穗花杉双黄酮加入6孔板。在37℃、5% CO2培养箱中培养24 h,取出置于冰上。吸去培养液,加入2 ml/孔预冷的0.01 mol/L磷酸盐缓冲液(phosphate buffer saline, PBS),吸弃。加入200μl/孔预冷的RIPA裂解液,放置1 min后,用细胞刮将板底的细胞刮掉。将细胞悬浮液吸入1.5 ml离心管,置于冰上。每3 min震荡15 s,重复5次。将离心管置于冷冻离心机中,12 000 r/min离心20 min,取上清冻存至-80℃冰箱,作为后续Western blotting的样本。
将收取的蛋白样品从-80℃取出,溶解后用酶标仪检测蛋白浓度。各组取等量的蛋白样品混入6×Loading Buffer,加入适量的蛋白裂解液将体积补为20μl,混匀后于4℃备用。制备8%分离胶和5%浓缩胶,放于电泳槽,加入适量电泳液,拔出梳子后,按顺序加入蛋白样品。80 V恒压30 min后,转为120 V恒压跑2 h。4℃转膜过夜。转膜结束后,用TBST溶液溶解5%脱脂奶粉,将膜置于封闭液封闭1 h。按照抗体说明书建议浓度稀释抗体,抗体稀释液为0.5%脱脂奶粉。一抗室温孵育4 h后,TBST洗3次,20 min/次。按抗体说明书稀释二抗,室温孵育1 h,TBST洗3次,每次20 min。在膜上滴加适量的ECL发光检测混合液后,拍照并分析。
1.3.6 流式细胞仪检测细胞凋亡情况将不同质量浓度穗花杉双黄酮作用于3T3-L1细胞,培养24 h后用胰酶消化收集细胞,用冰冷的PBS调整待测细胞的浓度为5×105~1×106个/ml。取1ml细胞,4℃、1 000 r/min离心5 min,弃上清,再次使用冰冷的PBS悬浮细胞后,以同样的条件进行离心,弃上清液,每管加入100μl Binding buffer悬浮细胞。依次加入5 μl Annexin V-FITC和5μl碘化丙啶,室温避光条件下,继续孵育5 min,加入Binding buffer至500 μl,轻轻混匀,用流式细胞仪检测0.0、2.5、5.0、10.0、20.0及40.0 mg/L穗花杉双黄酮对细胞凋亡的 影响。
1.3.7 EdU检测细胞增殖20 mg/L穗花杉双黄酮可以抑制3T3-L1细胞的增殖,20 mg/L穗花杉双黄酮引起CLOCK mRNA和蛋白表达降低。为证明穗花杉双黄酮与CLOCK基因的相关性,将3T3-L1细胞分为3组:①药物组:加入20 mg/L穗花杉双黄酮;②联合组:20 mg/L穗花杉双黄酮处理3T3-L1细胞24 h后,过表达Pc-DNA-CLOCK质粒;③对照组:未做任何处理。检测3组细胞24 h时的增殖情况。将细胞消化并接种于96孔板,细胞数量为5×104个/孔。培养24 h后,将配好的EdU溶液(20μmol/L)分别加入各孔,100μl/孔,孵育4 h。将96孔板取出,吸弃液体,0.01 mmol/L PBS清洗2遍后,加入4%多聚甲醛固定4 h。室温0.01 mol/L PBS清洗2次后,用1% TritonX-100处理1 h,加入染色液室温处理1 h。吸弃染色液后用0.01 mol/L PBS清洗2次,用DAPI进行染色,荧光显微镜下观察染色 情况。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 3T3-L1细胞CLOCK和BMAL1的周期性表达
不同时间点3T3-L1细胞CLOCK和BMAL1 RNA的相对表达量比较,经方差分析,差异有统计学意义(P<0.05);各相邻组间进一步两两比较,差异有统计学意义(P<0.05),0、12及18 h表达量较为接近,从中选取18 h进行后续实验。见表2和图1。
表2 生物钟基因mRNA相对表达量(×10-3,±s)

表2 生物钟基因mRNA相对表达量(×10-3,±s)
时间点CLOCK mRNABMAL1 mRNA 0 h0.605±0.0030.621±0.002 4 h0.675±0.0010.784±0.003 8 h1.011±0.0040.953±0.003 12 h1.423±0.0051.430±0.003 16 h1.193±0.0041.331±0.003 18 h1.114±0.0031.124±0.013 20 h1.025±0.0031.130±0.004 F值92.69893.745 P值0.0000.000
2.2 穗花杉双黄酮对3T3-L1细胞增殖的影响
不同质量浓度穗花杉双黄酮作用时的3T3-L1细胞活性比较,经方差分析,差异有统计学意义(F=194.485,P=0.000);与0.0 mg/L比较,2.5、5.0及10.0 mg/L穗花杉双黄酮对3T3-L1细胞增殖无影响(P>0.05),20和40 mg/L穗花杉双黄酮对3T3-L1细胞的增殖产生抑制作用(P<0.05)。见表3和图2。

图1 不同时间点3T3-L1细胞BMAL1和CLOCK mRNA的表达变化
表3 不同质量浓度穗花杉双黄酮作用时的3T3-L1细胞 活性比较(%,±s)
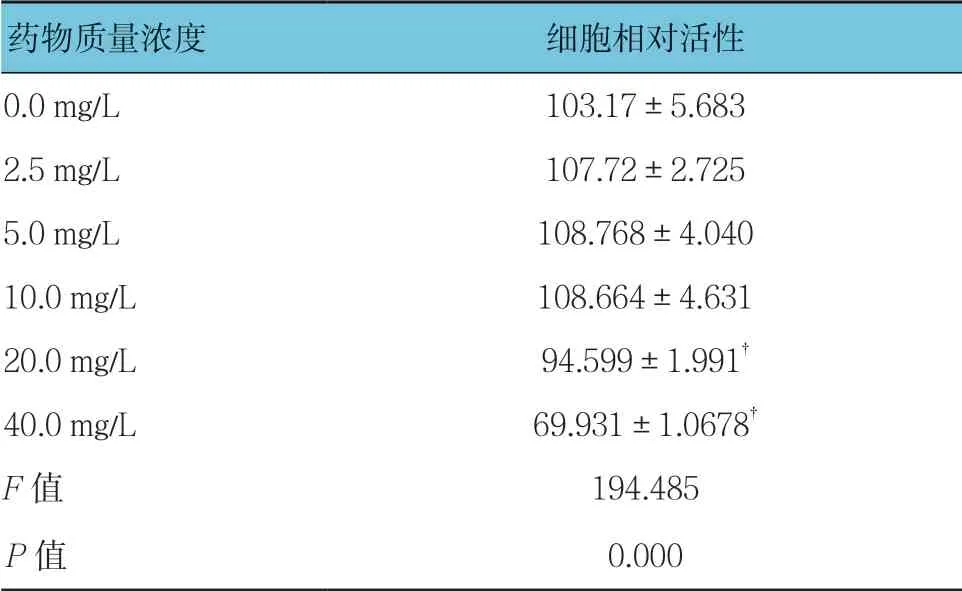
表3 不同质量浓度穗花杉双黄酮作用时的3T3-L1细胞 活性比较(%,±s)
注:†与0.0 mg/L比较,P <0.05
药物质量浓度细胞相对活性0.0 mg/L103.17±5.683 2.5 mg/L107.72±2.725 5.0 mg/L108.768±4.040 10.0 mg/L108.664±4.631 20.0 mg/L94.599±1.991†40.0 mg/L69.931±1.0678†F值194.485 P值0.000
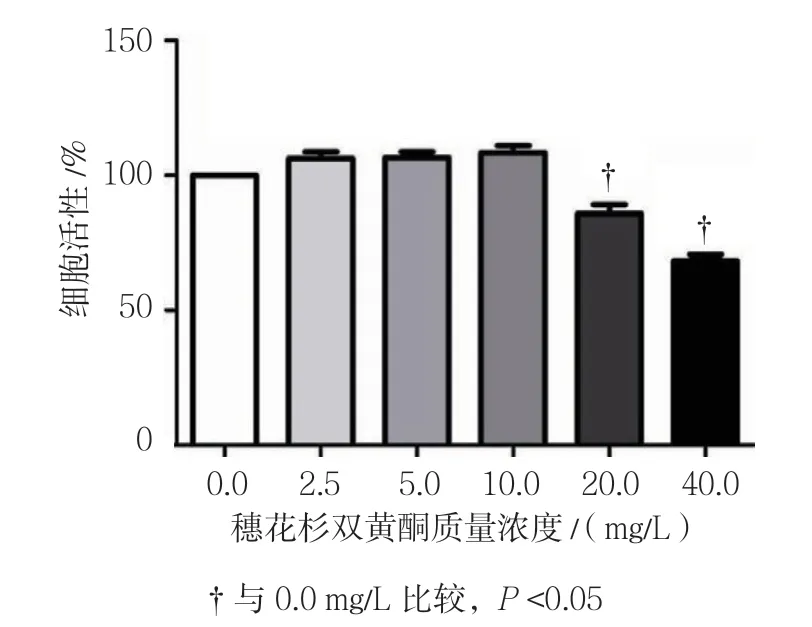
图2 不同质量浓度穗花杉双黄酮对3T3-L1细胞活性的影响(±s)
2.3 穗花杉双黄酮对3T3-L1细胞凋亡的影响
各组早期凋亡率、总凋亡率比较,差异有统计学意义(P<0.05);与0.0 mg/L组比较,2.5、5.0及10.0 mg/L穗花杉双黄酮对3T3-L1细胞总凋亡率无影响(P>0.05),20.0和40.0 mg/L穗花杉双黄酮促进3T3-L1细胞凋亡(P<0.05)。见表4。
2.4 穗花杉双黄酮对3T3-L1细胞凋亡相关蛋白的影响
不同质量浓度穗花杉双黄酮作用时,3T3-L1细胞凋亡相关蛋白Cleaved-caspase-3和Bcl-2比较,经方差分析,差异有统计学意义(P<0.05);与0.0 mg/L 比较,2.5、5.0及10.0 mg/L穗花杉双黄酮不影响3T3-L1细胞中Cleaved caspase-3的表达(P>0.05),20和40 mg/L穗花杉双黄酮促进3T3-L1细胞中Cleaved-caspase-3的表达(P<0.05);与0.0 mg/L比较,2.5、5.0及10.0 mg/L穗花杉双黄酮不影响3T3-L1细胞中Bcl-2的表达(P>0.05),20和40 mg/L穗花杉双黄酮抑制Bcl-2的表达(P<0.05)。见表5和图3。
表4 不同质量浓度穗花杉双黄酮对3T3-L1细胞凋亡的影响(%,±s)
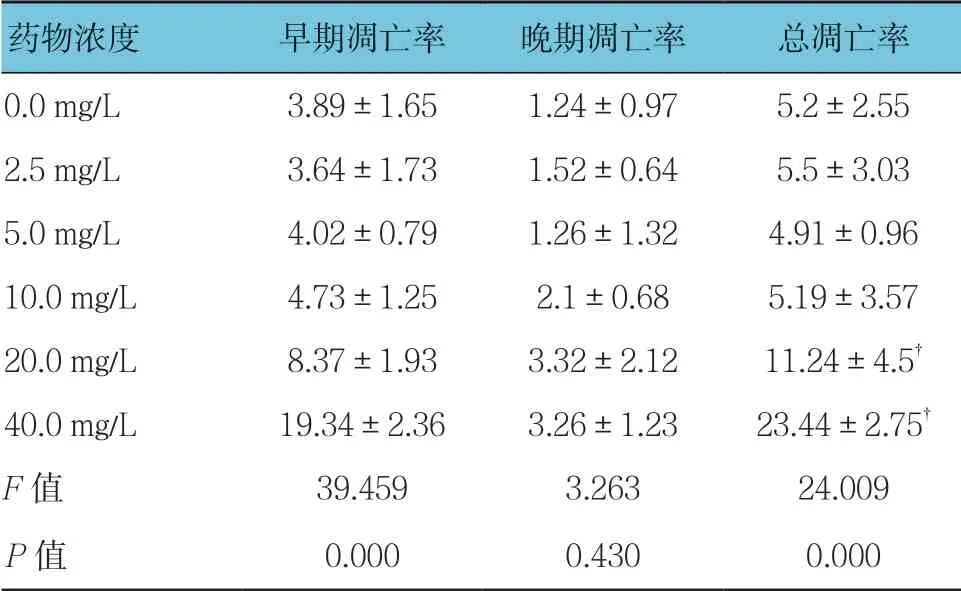
表4 不同质量浓度穗花杉双黄酮对3T3-L1细胞凋亡的影响(%,±s)
注:†与0.0 mg/L比较,P <0.05
药物浓度早期凋亡率晚期凋亡率总凋亡率0.0 mg/L3.89±1.651.24±0.975.2±2.55 2.5 mg/L3.64±1.731.52±0.645.5±3.03 5.0 mg/L4.02±0.791.26±1.324.91±0.96 10.0 mg/L4.73±1.252.1±0.685.19±3.57 20.0 mg/L8.37±1.933.32±2.1211.24±4.5†40.0 mg/L19.34±2.363.26±1.2323.44±2.75†F值39.4593.26324.009 P值0.0000.4300.000
表5 不同质量浓度穗花杉双黄酮对3T3-L1细胞凋亡相关蛋白相对表达量的影响(±s)
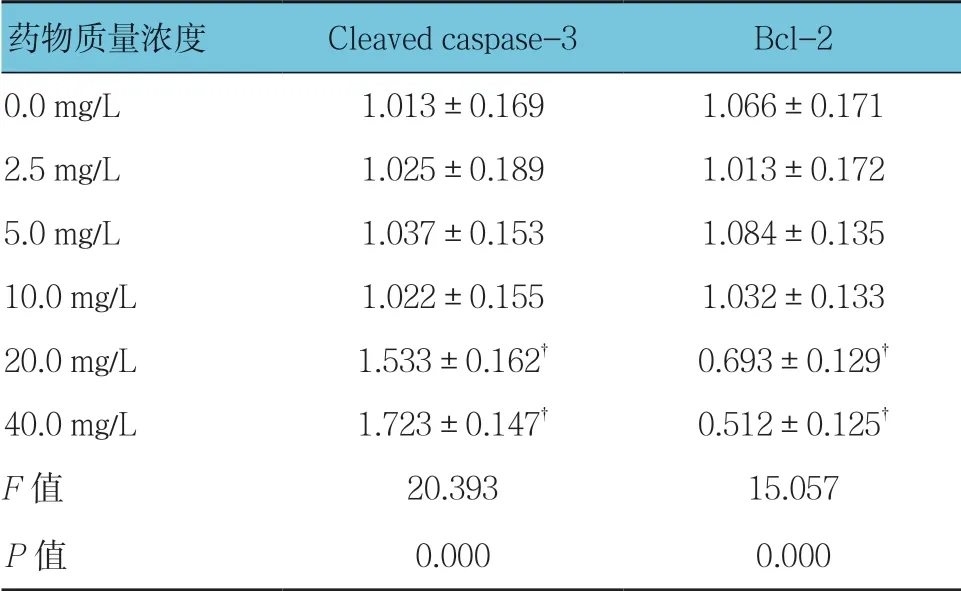
表5 不同质量浓度穗花杉双黄酮对3T3-L1细胞凋亡相关蛋白相对表达量的影响(±s)
注:†与0.0 mg/L比较,P <0.05
药物质量浓度Cleaved caspase-3Bcl-2 0.0 mg/L1.013±0.1691.066±0.171 2.5 mg/L1.025±0.1891.013±0.172 5.0 mg/L1.037±0.1531.084±0.135 10.0 mg/L1.022±0.1551.032±0.133 20.0 mg/L1.533±0.162†0.693±0.129†40.0 mg/L1.723±0.147†0.512±0.125†F值20.39315.057 P值0.0000.000
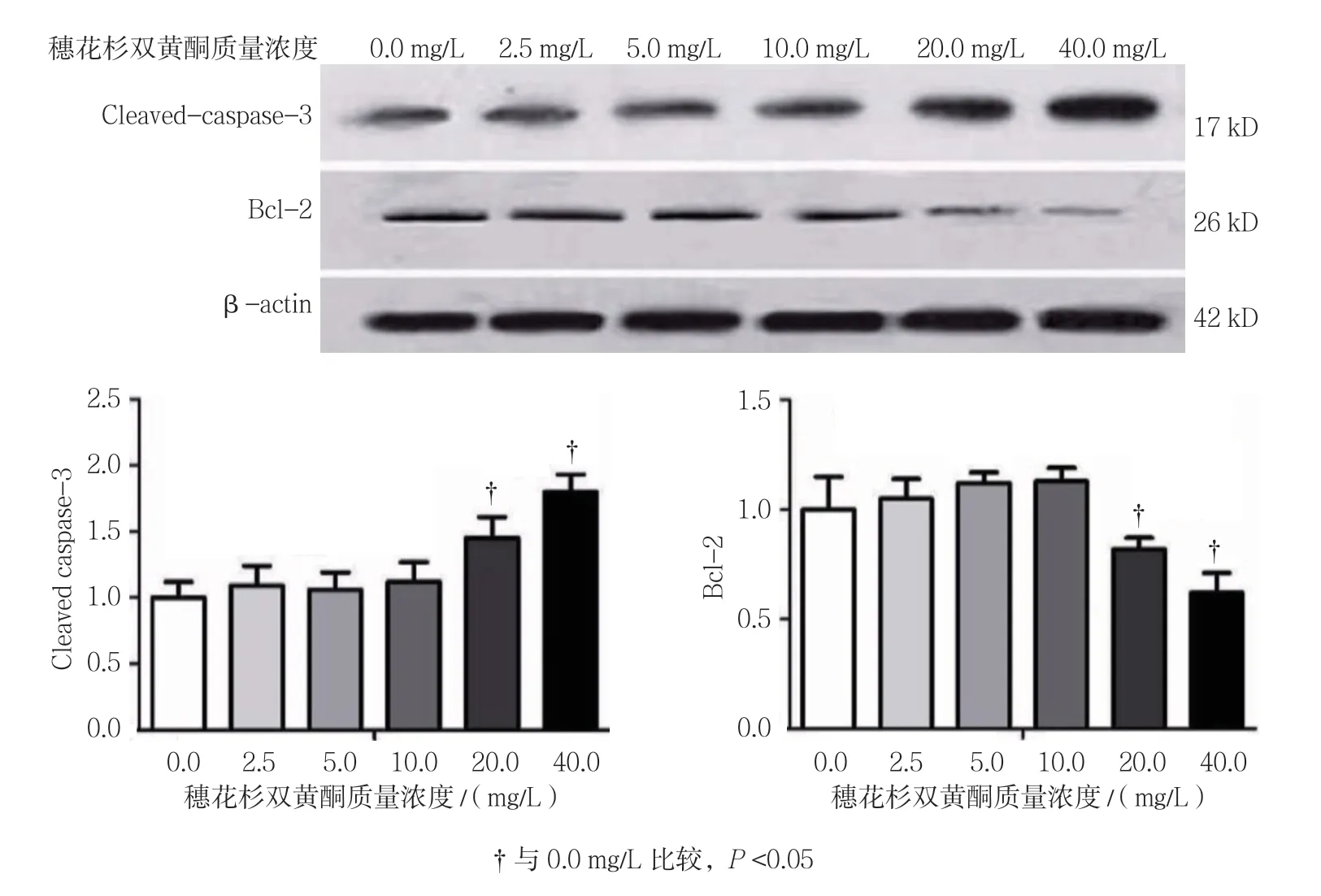
图3 穗花杉双黄酮对3T3-L1细胞凋亡相关蛋白的影响(±s)
2.5 穗花杉双黄酮对3T3-L1细胞CLOCK和BMAL1 mRNA的影响
不同质量浓度穗花杉双黄酮作用时,3T3-L1细胞CLOCK和BMAL1 mRNA相对表达量比较,经方差分析,差异有统计学意义(P<0.05);与0.0 mg/L比较,2.5、5.0及10.0 mg/L穗花杉双黄酮对3T3-L1细胞18 h时CLOCK mRNA的转录无影响(P>0.05),20和40 mg/L 抑制CLOCK mRNA的转录(P<0.05);与0.0 mg/L比较,2.5、5.0及10.0 mg/L穗花杉双黄酮对3T3-L1细胞18 h BMAL1 mRNA的转录无影响(P>0.05),20和40 mg/L穗花杉双黄酮抑制3T3-L1细胞BMAL1 mRNA的转录(P<0.05)。见表6和图4。
表6 不同质量浓度穗花杉双黄酮作用时3T3-L1 BMAL1和CLOCK mRNA相对表达量比较(×10-3,±s)
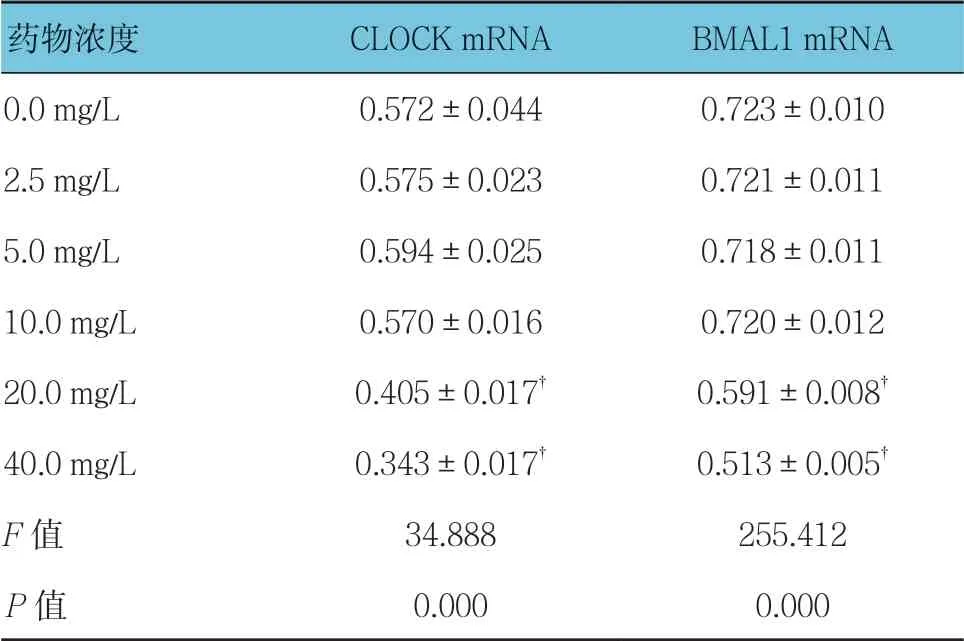
表6 不同质量浓度穗花杉双黄酮作用时3T3-L1 BMAL1和CLOCK mRNA相对表达量比较(×10-3,±s)
注:†与0.0 mg/L比较,P <0.05
药物浓度CLOCK mRNABMAL1 mRNA 0.0 mg/L0.572±0.0440.723±0.010 2.5 mg/L0.575±0.0230.721±0.011 5.0 mg/L0.594±0.0250.718±0.011 10.0 mg/L0.570±0.0160.720±0.012 20.0 mg/L0.405±0.017†0.591±0.008†40.0 mg/L0.343±0.017†0.513±0.005†F值34.888255.412 P值0.0000.000
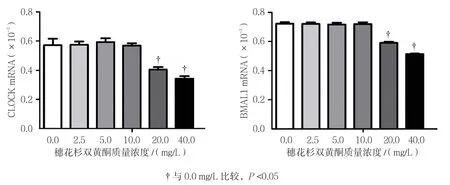
图4 不同质量浓度穗花杉双黄酮对BMAL1和CLOCK mRNA的影响(±s)
2.6 穗花杉双黄酮对3T3-L1细胞CLOCK和BMAL1蛋白的影响
不同质量浓度穗花杉双黄酮作用时,3T3-L1细胞CLOCK和BMAL1蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较用SNK-q检验,与0.0 mg/L比较,2.5、5.0及10.0 mg/L 穗花杉双黄酮对3T3-L1细胞的18 h时CLOCK蛋白的表达无影响(P>0.05),20和40 mg/L穗花杉双黄酮抑制CLOCK蛋白的表达(P<0.05);与0.0 mg/L比较,2.5、5.0及10.0 mg/L穗花杉双黄酮对3T3-L1细胞18 h时BMAL1蛋白的表达无影响(P>0.05),20和40 mg/L穗花杉双黄酮抑制BMAL1蛋白的表达(P<0.05)。见表7和图5。
表7 不同质量浓度穗花杉双黄酮处理后CLOCK 和BMAL1蛋白相对表达量比较(±s)
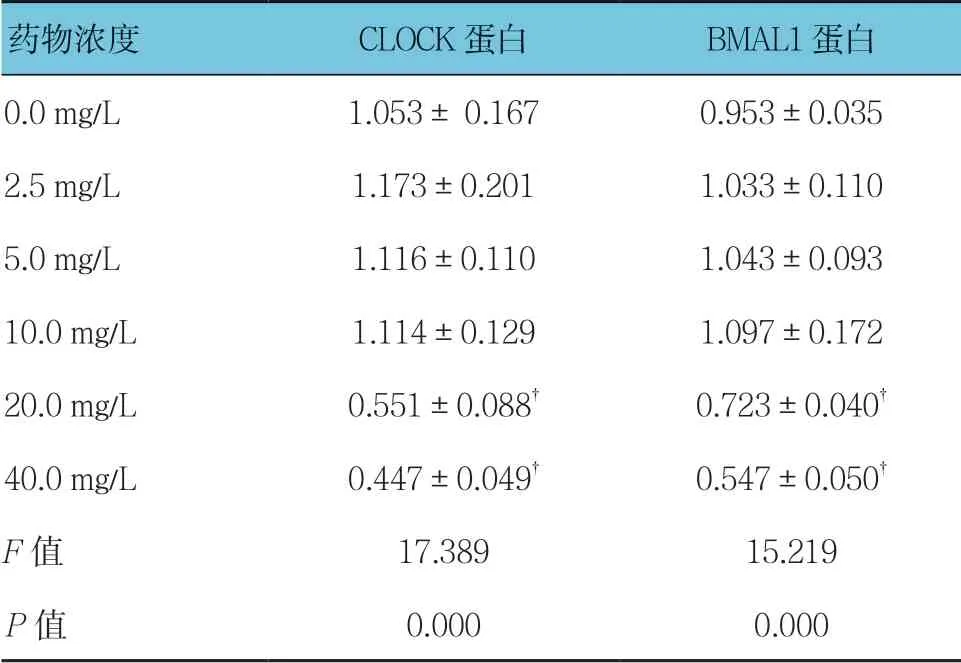
表7 不同质量浓度穗花杉双黄酮处理后CLOCK 和BMAL1蛋白相对表达量比较(±s)
注:†与0.0 mg/L比较,P <0.05
药物浓度CLOCK蛋白BMAL1蛋白0.0 mg/L1.053± 0.1670.953±0.035 2.5 mg/L1.173±0.2011.033±0.110 5.0 mg/L1.116±0.1101.043±0.093 10.0 mg/L1.114±0.1291.097±0.172 20.0 mg/L0.551±0.088†0.723±0.040†40.0 mg/L0.447±0.049†0.547±0.050†F值17.38915.219 P值0.0000.000
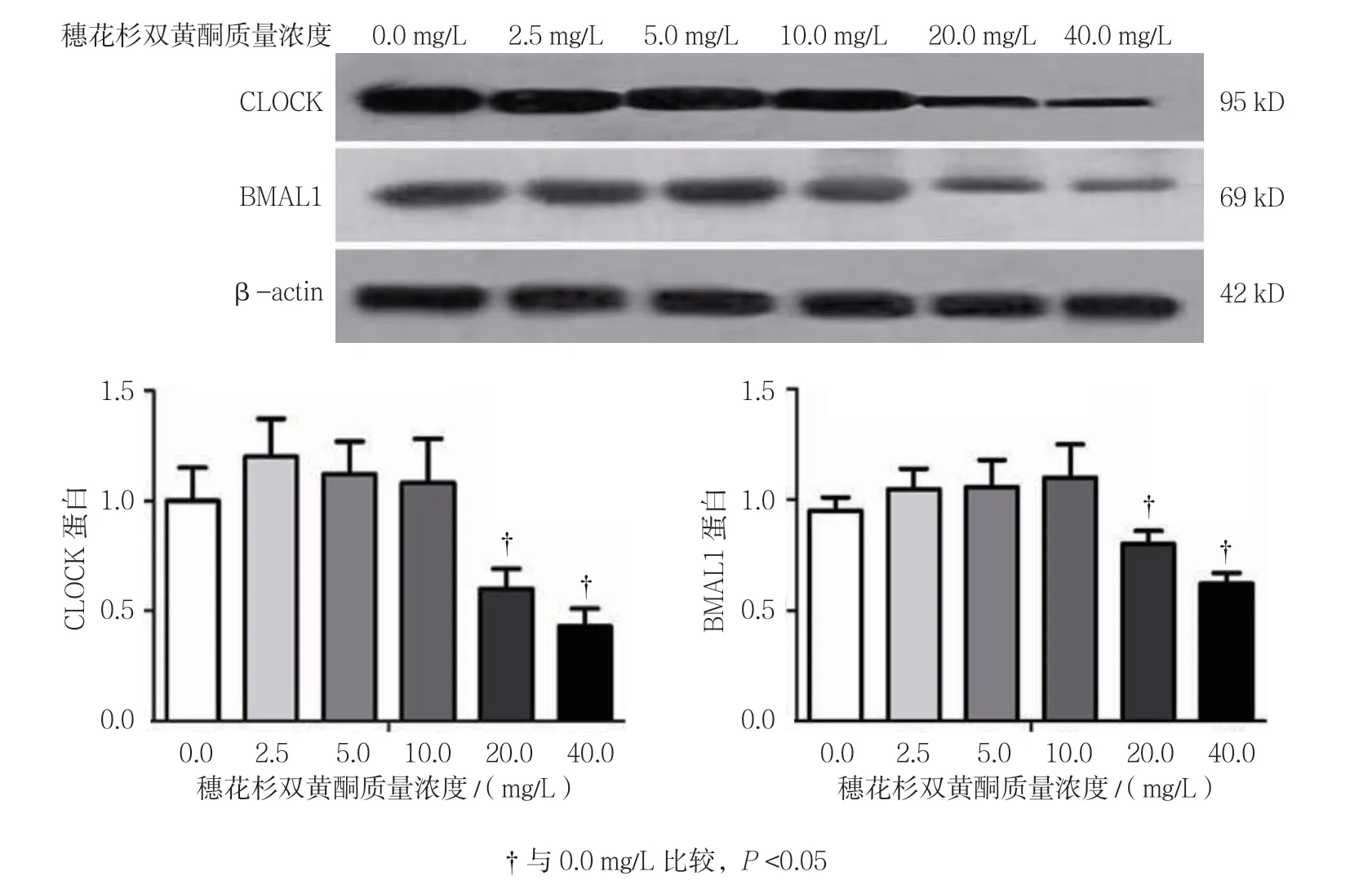
图5 不同质量浓度穗花杉双黄酮处理后BMAL1和CLOCK蛋白的表达变化(±s)
2.7 CLOCK基因对穗花杉双黄酮抑制3T3-L1细胞增殖的影响
药物组、联合组、对照组3T3-L1细胞增殖情况和CLOCK蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较经SNK-q检验,联合组EdU阳性细胞率和CLOCK蛋白相对表达量高于药物组(P<0.05),但低于对照组(P<0.05)。见表8和图6~8。
表8 不同处理对3T3-L1细胞增殖和CLOCK蛋白表达的影响(±s)

表8 不同处理对3T3-L1细胞增殖和CLOCK蛋白表达的影响(±s)
组别Edu阳性细胞率/%CLOCK对照组56.333±1.5280.984±0.127药物组19.333±2.0820.459±0.074联合组39.667±2.5170.734±0.065 F值237.71836.151 P值0.0000.000

图6 各组3T3-L1细胞增殖情况
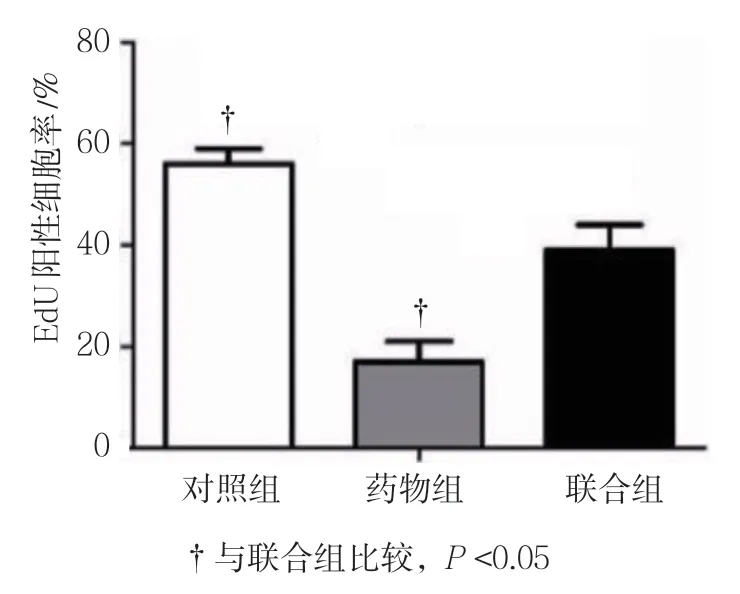
图7 3组EdU阳性细胞率比较(±s)
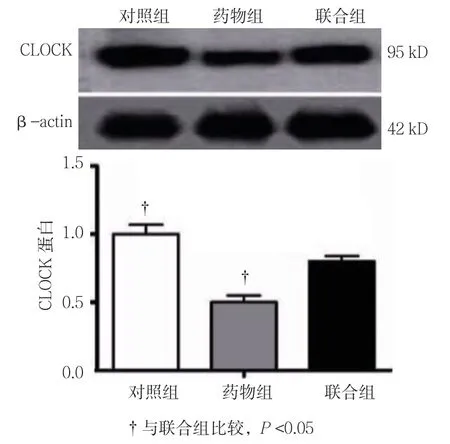
图8 3组3T3-L1细胞CLOCK蛋白相对表达量比较(±s)
3 讨论
24 h生物节律被称作昼夜节律。昼夜节律的形成与生物钟系统的表达密切相关[21]。现已知的生物钟基因主要有9种,在下丘脑视交叉上核的作用下,调节生物体的节律性活动。BMAL1基因处于生物钟体系的上游,其转录翻译后的蛋白产物是正反馈环路中的调节因子,并与CLOCK蛋白结合形成异二聚体,这些正性成分启动后经转录和翻译生成相应的蛋白。同时PER和CRY等负性成分表达,阻止正性成分的表达和功能,形成完整的反馈通路。
在离体3T3-L1细胞培养的过程中,笔者发现即使脱离机体中枢SCN生物钟的影响,脱离周期性的日光照射,离体3T3-L1细胞在无光照的培养箱中进行培养,其生物钟基因CLOCK和BMAL1仍然呈现出昼夜节律的周期性表达,其表达呈午时偏高,而凌晨和夜晚偏低的节律,这与TODA等[22]在离体情况所做的NIH3T3中相关基因的节律性表达相近似,也从侧面证实生物钟基因节律的形成可能与地球自转和公转 有关。
肥胖及其并发症在全球范围内广泛存在,其诱因相对复杂,主要由代谢异常引起。有资料显示,肥胖症的发生与倒班等昼夜节律异常有关[23]。研究发现,BMAL1基因在脂质代谢、糖平衡和能量代谢中也有十分重要的作用。与此同时,BMAL1与CLOCK组成的异二聚体在调节葡萄糖的动态平衡和胰岛素抵抗中意义重大。研究表明,BMAL1和/或CLOCK基因异常的小鼠表现出肥胖或体脂减少等症状,这些都表明BMAL1、CLOCK基因与肥胖密切相关。
穗花杉双黄酮有降血糖和抗氧化等作用[2],在抑制肥胖的发生中有十分重要的潜在药用价值。穗花杉双黄酮能否影响3T3-L1细胞中生物钟基因的转录、翻译,从而影响细胞的增殖和凋亡,尚未有明确的 结论。
细胞是生物体的基本组成部分,3T3-L1作为脂肪前体细胞在生物体脂肪细胞的形成及肥胖的发生过程中都有着十分重要的作用。穗花杉双黄酮在较低浓度时对3T3-L1细胞的增殖和凋亡影响不大,高浓度时抑制其增殖而促进其凋亡。Cleaved caspase-3是半胱氨酸天冬氨酸蛋白酶家族的成员,在细胞凋亡的执行阶段起重要作用,而Bcl-2通过结合Bax抑制细胞凋亡。结果显示,高浓度穗花杉双黄酮通过上调Cleaved caspase-3表达,下调Bcl-2的表达,促进凋亡的发生。这提示穗花杉双黄酮可能成为潜在的抑制肥胖发生的药物,但有待于在整体动物和临床试验中进一步验证。
通过检测不同质量浓度穗花杉双黄酮对生物钟基因CLOCK、BMAL1 mRNA和蛋白的影响发现,其mRNA和蛋白促进细胞增殖,抑制细胞凋亡,同时穗花杉双黄酮处理后,过表达CLOCK基因使被抑制的3T3-L1细胞增殖率得到一定恢复,这提示穗花杉双黄酮对3T3-L1增殖和凋亡的影响与生物钟基因的表达有关。
