一家系家族性Fahr病的临床及影像学表现并文献复习
2019-08-22高长泰陈国华赵经善粱玉霞刘梦云
高长泰,周 晟,陈国华,赵经善,粱玉霞,刘梦云
(1.武威职业学院附属中医院影像科,甘肃 武威 733000;2.甘肃省中医院放射影像科,甘肃 兰州 730050;3.甘肃省疾病预防控制中心,甘肃 兰州 730020)
家族性Fahr病又称家族性脑血管亚铁钙沉着症或家族性基底节钙化[1],多为常染色体显性或隐性遗传,也可性染色体遗传。该病属罕见病,发病率低于1/100万[2]。该病临床表现复杂多变,部分患者可无任何症状,多在检查时偶然被发现[3];其脑部影像学表现与甲状旁腺功能减退症几乎完全一致,极易误诊。我们对一家系3代人家族性Fahr病临床及影像学表现进行回顾性分析,以期提高对Fahr病的认识水平,避免漏诊和误诊。
1 资料与方法
1.1 一般资料
病例1,女,73岁,高血压病史20余年,血压最高达160/110 mmHg,未规律口服降压药;头痛、头晕十余年,治疗后可缓解;患者反应较迟钝,健忘,四肢肌力可,无明显感觉及运动障碍;近3年来间断出现肢体轻微抖动,偶有行走时步态欠稳,尚可独立行走。CT扫描见双侧基底节区、背侧丘脑区钙化,小脑齿状核钙化,CT诊断为“甲状旁腺功能减退症脑改变”,建议实验室检查血钙、血磷等以进一步明确诊断。患者血钙2.55 mmol/L,血磷1.38 mmol/L,均在正常范围;甲状腺功能正常。
病例2,男,44岁,为病例1儿子,职工,中等体格,体健,常有头痛、头晕症状,休息或服药后可缓解;健忘,无明显感觉及运动障碍,血压、血脂、血糖均正常。实验室检查血钙、血磷、甲状腺功能均正常。
病例3,男,17岁,高中就读,学习中等,为病例 1孙、病例2子,无任何症状及体征,无感觉及运动异常。实验室检查无异常。
1.2 检查方法
1.2.1 CT检查
CT为GE 64排128层小宝石螺旋CT(optima CT660),扫描基线听眦线,扫描管电压120 kV,管电流280 mA,矩阵512×512,常规重建层厚5 mm,层距5 mm,薄层重建层厚1.25 mm,层距 1.25 mm,DFOV:25 cm。
1.2.2 MRI检查
采用 Siemens avanto 1.5T超导型磁共振机,采用头颈复合交感线圈,扫描序列为常规SE T1WI(TR:550 ms,TE:8.7 ms)、TSE T2WI(TR:5 000 ms,TE 91 ms)、压脂 Flair(TR:9 000 ms,TE:92 ms,TI:2 500 ms)、DWI (TR:3 600 ms,TE:102 ms,b 值:1 000 s/mm2)、ADC 图,以横轴位为主,辅以矢状及冠状位扫描。
1.3 图像分析及诊断
CT图像传送至AW4.5工作站进行后处理及观察分析,MRI图像在SyngoB19工作站进行后处理及观察分析。所有图像均由2位从事影像诊断工作20年的副主任医师进行分析、诊断。CT图像根据需要进行冠状位、矢状位等多平面重建(MPR)及薄层图像观察;MR对血管进行分析、观察时,除了观察血管三维图像,还必须对原始容积扫描薄层图像进行逐层仔细观察分析,以减少三维图像伪影对诊断的影响。
2 结果
2.1 病例1结果
CT示双侧小脑齿状核较对称分布之小点片状钙化密度影(图1a);尾状核头部、豆状核区对称分布之片状钙化密度影,呈正“八”字形,CT值达643 HU,与颅板密度相仿;右侧尾状核与豆状核之间的内囊前肢似亦钙化,左侧尾状核头与豆状核之间的内囊前肢未见钙化;双侧背侧丘脑对称分布之片状钙化密度灶(图1b)。双侧尾状核、豆状核区钙化灶呈“小鸟对吻状”表现 (图1b)。侧脑室体旁之尾状核体部亦钙化(图 1c)。
综合病史、临床表现、实验室检查、影像学检查,排外甲状旁腺功能减退症,诊断为家族性脑血管亚铁钙沉着症(家族性Fahr病)。给予高蛋白、低脂饮食,给予降压、活血、神经营养等治疗。住院治疗1周,患者症状好转出院。建议其家族成员(子、孙等)到医院进行排查。
2.2 病例2结果
CT:双侧小脑齿状核、尾状核、豆状核区对称分布之片状钙化密度影,CT值达732 HU;5 mm层厚图像示双侧尾状核与豆状核之间的内囊前肢似钙化,1.25 mm薄层图像示内囊前肢并未钙化(图2a、2b),5 mm层厚图像所见内囊前肢钙化实际为容积效应所致(图2b)。双侧尾状核、豆状核区钙化灶亦呈“小鸟对吻状”表现(图2b),与病例1表现类似;双侧背侧丘脑见对称分布之片状钙化密度灶;双侧尾状核头-体部均钙化 (图2c);双侧额、顶、枕叶皮髓质交界区钙化灶(图 2c)。
MRI:双侧小脑齿状核较对称分布之长T1、短T2信号影;双侧尾状核、豆状核对称分布之钙化呈片状长T1(图2d)、短T2信号影,内囊前肢形态、信号大致如常,未见钙化;背侧丘脑钙化表现为短T1(图2d)、等T2信号。皮髓质交界区钙化MR显示不如CT直观,呈稍长T1、稍短T2信号。DWI(图2f)示双侧尾状核、豆状核、背侧丘脑钙化钙化呈低信号影。侧脑室体旁、半卵圆区重度脑白质脱髓鞘改变 (图2e)。TOF法MRA及其原始薄层图像示颅内动脉血管如常。
2.3 病例3结果
CT:双侧小脑齿状核较对称分布之片状钙化密度影;右侧豆状核、左侧尾状核、豆状核区片状钙化密度影,CT值达527 HU;双侧背侧丘脑未见钙化密度灶(图3a);右额叶白质区小片状钙化密度影。

图1 女,73岁,家族性Fahr病。CT图像。图1a:双侧小脑齿状核较对称分布之小点片状钙化密度影。图1b:尾状核、豆状核区对称分布之片状钙化密度影;右侧尾状核与豆状核之间的内囊前肢似亦钙化,左侧尾状核头与豆状核之间的内囊前肢未见钙化。双侧尾状核、豆状核区钙化灶呈“小鸟对吻状”。图1c:尾状核头-体部均钙化(侧脑室体旁)。Figure1. Female,73 yearsold,familial Fahr’s disease.Figure 1a~1c:CT images of the patient.Figure 1a:Small patchy calcification densities in bilateral cerebellar dentate nuclei with symmetric distribution.Figure 1b:Patchy calcification with symmetrical distribution of caudate and lenticular nuclei.The anteriorlimb of internal capsule between the right caudate nucleus and the lenticular nucleus appears to be calcified,while the anterior limb of the internal capsule between the left caudate nucleus and lenticular nucleus does not show calcification.The calcification foci in bilateral caudate and lenticular nuclei display “bird to kiss”.Figure 1c:Head-body calcification of caudate nucleus(near the lateral ventricle body).
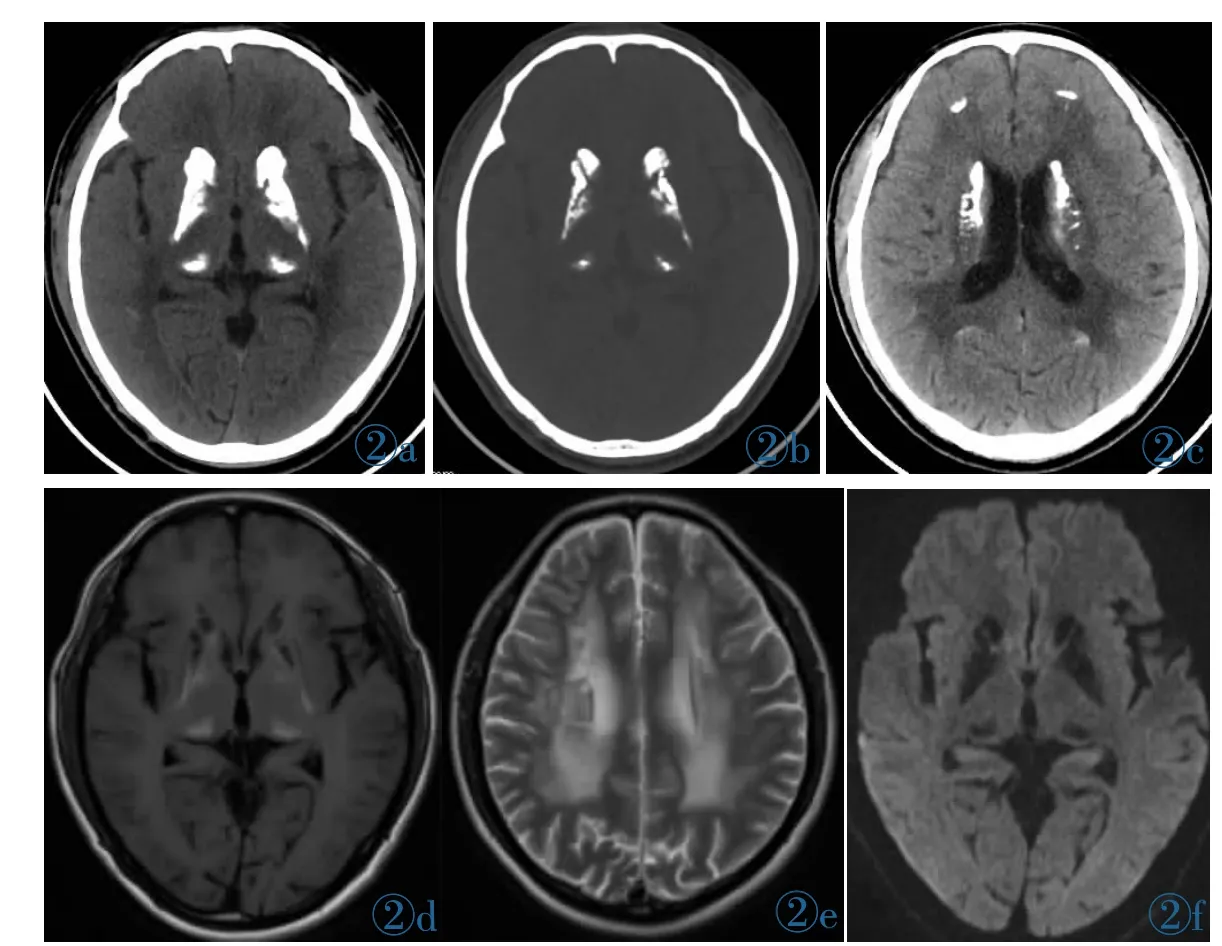
图2 男,44岁,家族性Fahr病。图2a~2c为CT图像,图2d~2f为MR图像。图2a:5 mm层厚、层距CT图像示尾状核、豆状核区对称分布之片状钙化密度影。双侧背侧丘脑呈对称分布之片状钙化密度灶。双侧尾状核、豆状核区钙化灶呈“小鸟对吻状”,具有一定特征性。图2b:1.25 mm薄层图像示尾状核头与豆状核之间之内囊前肢并未钙化,图2a所示内囊前肢钙化为容积效应所致。图2c:双侧尾状核头-体部均钙化(侧脑室体旁)。额叶、枕叶皮髓质交界区钙化灶。图2d:双侧尾状核、豆状核对称分布之钙化呈片状长T1信号影。内囊前肢形态大致如常,未见钙化;背侧丘脑钙化表现为短T1信号。图2f:皮髓质交界区钙化MR显示不如CT直观。DWI示双侧尾状核、豆状核、背侧丘脑钙化呈低信号影。图2e:示重度脑白质脱髓鞘改变。Figure 2. Male,44 years old,familial Fahr’s disease.Figure 2a~2c:CT images of the patient.Figure 2a:The CT images with 5 mm slice thickness and slice distance indicate the symmetrical distribution of patchy calcification density in the caudate and lenticular nuclei.The bilateral dorsal thalamus present symmetrical distribution of flaky calcification density lesions.The calcification foci in bilateral caudate and lenticular nuclei display “bird to kiss” and have certain characteristics.Figure 2b:1.25 mm thin layer image shows that the anterior limb of the internal capsule between the caudate nucleus head and the lenticular nucleus does not calcify.Figure 2c:Head-body calcification in both caudate nuclei(near the lateral ventricle body).Calcification in the junction of frontal and occipital cortex and medulla.Figure 2d~2f:MR images of the same patient.Long T1 signals(Figure 2d)of calcification in bilateral caudate and lenticular nuclei are symmetrically distributed,and no calcification is found in the anterior limb of the internal capsule.The dorsal thalamic calcification shows short T1signal (Figure 2d).MR imaging of corticomedullary junction calcification is not as intuitive as CT.DWI(Figure 2f)shows low signal of calcification in bilateral caudate nucleus,lenticular nucleus and dorsal thalamic.Figure 2e shows severe demyelination of brain white matter.
MRI:双侧小脑齿状核钙化于T1WI呈稍高信号(图3b)。右侧豆状核、左侧尾状核、豆状核区钙化于T1WI呈稍高信号(图3c),于T2WI呈大体等信号,于T2-Flair呈稍高信号。DWI示右侧豆状核、左侧尾状核、豆状核钙化灶呈低信号影。
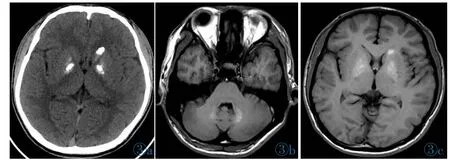
图3 男,17岁,家族性Fahr病。图3a:CT图像。右侧豆状核、左侧尾状核、豆状核区片状钙化密度影,CT值达527 HU;双侧背侧丘脑未见钙化密度灶。图3b,3c:同一患者MR图像。双侧小脑齿状核钙化于T1WI呈稍高信号(图3b)。右侧豆状核、左侧尾状核、豆状核区钙化于T1WI呈稍高信号(图 3c)。Figure 3.Male,17 years old,familial Fahr’s disease.Figure 3a:The CT image of the patient.The CT value of the calcification density shadow in bilateral lenticular nucleus and left caudate nucleus is 527 HU,and no calcification density foci are found in bilateral dorsal thalamus.Figure 3b,3c:the same patient's MR images.Bilateral cerebellar dentate nuclei calcification on T1WI present slightly higher signal(Figure 3b).Calcification in the right lenticular nucleus,left caudate nucleus and lenticular nucleus show slightly higher signal(Figure 3c)on T1WI.
3 讨论
3.1 Fahr病概述及诊断标准
Fahr病可发生于任何年龄阶段,发病率无明显性别差异,分散发性和家族性,病因尚不明确,散发性报道较家族性报道相对多见,部分原因可能为早期大部分病例无明显临床表现及未能进行以CT扫描为主的家族成员筛查所致。病理学改变主要是发生在双侧基底节区、丘脑、小脑的齿状核及皮层下中枢 (半卵圆中心区皮层下)基本对称性的钙质沉着[4]。病变区终末小动脉和小静脉周围钙盐沉着,部分血管壁发生玻璃样变性,部分血管出现纤维素样坏死,此外还包括黏多糖类物质及铁、铝、钾、磷等盐类沉着。钙盐沉着可由血管周围扩展到邻近的脑实质;钙化部位神经元丧失,神经胶质增生,部分有脱髓鞘改变。钙化发生部位依次为苍白球、尾状核、壳核、丘脑、额顶叶皮髓质交界区、小脑齿状核、小脑皮层、脑干中央部核团等。本文病例3为17岁少年,为此家系中第三代,因其祖母、其父被发现Fahr而被筛查出,双侧苍白球区钙化均出现,且钙化密度高,右侧尾状核尚未见钙化,左侧尾状核已钙化,且密度高;双侧小脑齿状核已出现钙化,但密度低,CT值78 HU,推测为钙化出现时间较晚,其表现符合上述钙化发生次序规律。
Fahr病家族遗传型与散发型临床表现有一定差异。痴呆、智力障碍、记忆力下降、精神症状、语言障碍、发作性意识障碍在家族遗传型 Fahr病中较散发型多见;运动功能障碍、眩晕则多见于散发型;头昏头痛、癫痫发作在二者的发病率中无明显差异。家族遗传型无症状者占28%;散发型无症状者占42%[3]。本文病例1、病例2为母子,主要症状为健忘、反应迟钝,符合上述规律。
目前临床上广泛使用的临床标准为1971年由Moskowitz等制定的诊断标准:①CT或X线上有对称性双侧基底节钙化;②无甲状旁腺功能减退症的临床表现;③血清钙、磷在正常范围;④肾小管对甲状腺素反应功能正常;⑤无感染、中毒和其他病等原因;⑥可有家族史,也可无家族史[5]。有家族史或遗传学依据的可称为家族性Fahr病。本文一家系3例病例符合家族性Fahr病的诊断标准。
3.2 Fahr病影像学特征
CT对Fahr病具有极高的诊断价值,CT对钙化的显示极为敏感、准确,可作为Fahr病的首选检查方法[6]。双侧尾状核、豆状核区钙化呈顺“八”字形,有时可形成典型的“小鸟对吻状”表现,具有一定特征性。层厚较厚时双侧尾状核与豆状核之间的内囊前肢似钙化,薄层图像可清晰显示尾状核头与豆状核之间之内囊前肢并未钙化,此点亦可被磁共振扫描所证实。双侧背侧丘脑钙化一般晚于豆状核、尾状核钙化,早期病例背侧丘脑钙化可不出现;双侧额叶、顶、枕叶钙化多出现在皮髓质交界区,少数在半卵圆中心白质区。
MRI检查具有多参数、多序列的特点,可以提供更为丰富的信息,但对钙化的显示不如CT直观。较致密的钙化一般表现为长T1、短T2信号,表现为双侧豆状核、尾状核头体部、小脑齿状核区、额顶叶皮髓质交界区对称分布之片状低信号影。部分钙化信号多变,可表现为短T1、等T2信号(如病例2、病例3所示),多见于早期及不甚致密的钙化,与钙盐在含水状态下水分子粘附在钙盐结晶表面,氢质子的进动频率可能接近于Larmor频率有关。DWI序列钙化多呈低信号表现。MR对脑白质脱髓鞘改变较CT敏感,显示效果好。
3.3 鉴别诊断
①本病与甲状旁腺功能减退(HP)与在影像学上很难进行区分,HP患者的血清甲状旁腺素(PTH)水平降低,血钙降低、血磷升高,而 Fahr病患者PTH、血钙及血磷水平均正常。②假性甲状旁腺功能减退有明确病史和血清钙、磷及甲状旁腺素的异常改变。③结节性硬化的钙化常见于侧脑室旁,呈结节样钙化,以室管膜下常见,临床上痴呆症状明显,多有面部皮脂腺瘤。④感染性疾病:如结核、巨细胞病毒、风疹病毒、弓形虫病、囊虫病等可引起基底节钙化,甚至遍布全脑形成大片状钙化灶,但其钙质沉积的部位及形态分布与Fahr病明显不同,结合临床、病史及实验室检查不难鉴别。⑤线粒体脑病:双侧基底节区钙化出现率约30%~70%,患者血、脑脊液乳酸升高,磁共振波谱成像(MRS)脑组织及脑脊液中可以检测到乳酸峰可以资鉴别。
