固相萃取-超高效液相色谱串联质谱测定茶产品中吡蚜酮
2019-08-21余焕周利林琴杨洁孙荷芝伍旭东王新茹张新忠陈宗懋罗逢健
余焕,周利,林琴,杨洁,孙荷芝,伍旭东,王新茹,张新忠,陈宗懋,罗逢健
固相萃取-超高效液相色谱串联质谱测定茶产品中吡蚜酮
余焕1,2,周利1*,林琴1,2,杨洁1,2,孙荷芝1,伍旭东3,王新茹1,张新忠1,陈宗懋1,罗逢健1*
1. 中国农业科学院茶叶研究所农产品质量安全研究中心,浙江 杭州 310008;2. 中国农业科学院研究生院,北京 100081;3. 普洱市质量技术监督综合检测中心,云南 普洱 665099
建立了Cleanert PCX固相萃取,超高效液相色谱-串联质谱(UPLC-MS/MS)测定干茶、抹茶和速溶茶粉中吡蚜酮残留量的分析方法。干茶、抹茶和速溶茶粉中的吡蚜酮经甲醇和水的混合溶液提取、Cleanert PCX固相萃取柱富集净化和Acquity BEH C18色谱柱分离后,通过UPLC-MS/MS多反应监测模式(MRM)测定,外标法定量。在0.005~1.000 mg·kg-1添加范围内,吡蚜酮的平均回收率为77.0%~95.1%,相对标准偏差(RSD,n=5)为1.8%~6.9%,方法的定量限(LOQ)为0.005~0.010 mg·kg-1。该方法在灵敏度、准确度和回收率上均符合农药残留检测的要求,可为茶产品中吡蚜酮残留量的测定和风险评估提供分析方法。
吡蚜酮;茶;农药残留;固相萃取法;高效液相色谱-串联质谱
茶叶是世界公认的健康饮品。我国是世界上茶叶种植面积和产量最大的国家,茶叶出口量占世界第二位。农药残留是影响茶叶及其加工产品质量安全的重要因素,分析方法是保障质量安全的必要手段。吡蚜酮(Pymetrozine,CAS 123312-89-0)属吡啶类杀虫剂,对小贯小绿叶蝉、茶绿盲蝽等害虫的防效优良,其使用会在一定程度上造成初级茶产品和茶叶加工产品中的农药残留。欧盟和我国制定的茶叶中吡蚜酮的最大残留限量分别为0.1 mg·kg-1和2 mg·kg-1。吡蚜酮一直被认为是农残测定中的“问题农药”[1-6],在多项多残留方法报道中其回收率达不到农残检测的要求,尤其在柑橘等酸性基质样品中[1,5]。吡蚜酮在水果、蔬菜、烟草等农作物中的提取净化方法主要包括液液分配方法(LLE)[7]和固相萃取方法(SPE)[8],但是LLE方法操作繁琐,二氯甲烷等有机溶剂毒性较高且用量大。SPE方法具有较高的回收率和灵敏度,氨基柱、C18柱、HLB固相萃取柱已应用于芹菜[9]、烟草[10]、菠菜[11]、棉籽[12]等基质中吡蚜酮残留量的测定,定量限(LOQ)在0.001~0.017 mg·kg-1。QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)方法也应用于番茄[13]、水稻和环境样品[14]中吡蚜酮残留量的测定,但该方法应用于速溶茶粉中的吡蚜酮测定时,回收率仅60%[15]。对于茶叶中吡蚜酮检测方法的研究较少,张田田等[16]采用SCX固相萃取柱测定了田间样品干茶和鲜叶中吡蚜酮的残留量,而对抹茶和速溶茶粉等茶产品中吡蚜酮的测定方法未见报道。
本研究优化了干茶、抹茶和速溶茶粉等茶产品中吡蚜酮残留量测定的前处理条件,建立了甲醇和水混合提取,PCX固相萃取净化,超高效液相色谱-串联质谱(UPLC-MS/MS)法测定吡蚜酮残留量的分析方法,可满足茶叶和茶产品中吡蚜酮残留量的测定要求。
1 试验部分
1.1 仪器与试剂
UPLC/Quattra Premier XE超高效液相色谱-三重四极杆质谱联用仪,ESI源,Mass Lynx 4.1质谱工作站软件(美国Waters公司);高速离心机(德国Sigma公司);R-210旋转蒸发仪(瑞士Buchi公司)。乙腈、甲醇(色谱纯,德国Merck公司);纯净水(杭州娃哈哈有限公司);甲酸(≥98.0%,CNW Technologies Gmb H);氨水(25%~28%,分析纯,上海试四赫维化工有限公司);盐酸(优级纯,国药集团);吡蚜酮标准品(99.5%,CNW Technologies Gmb H);Cleanert PCX混合阳离子交换固相萃取柱(60 mg/3 mL,天津博纳艾杰尔科技有限公司)。
1.2 试验方法
1.2.1 农药标准溶液的配制
准确称取吡蚜酮标准品0.050 0 g(精确至0.000 1 g)于50 mL容量瓶中,乙腈定容,配制成1 000 mg·L-1的标准储备溶液于–20℃保存。乙腈逐级稀释标准储备液配置所需浓度的标准工作溶液,于–20℃保存。
1.2.2 样品提取
干茶和抹茶:称取1.0 g粉碎成茶样品或抹茶样品于50 mL带盖离心管中,加入4 mL水,混匀静置10 min,加入16 mL甲醇,涡旋1 min,静置30 min。7 000 r·min-1离心5 min后取10 mL上清液于40℃条件下旋转蒸发至近干,吹干后加入10 mmol·L-1盐酸水溶液10 mL溶解残渣,待净化。速溶茶粉:取0.1 g茶粉样品于50 mL带盖离心管中,加入20 mL去离子水,混匀涡旋1 min后,加入1 mol·L-1盐酸水溶液200 μL混匀,待净化。
1.2.3 样品净化
Cleanert PCX固相萃取柱经5 mL甲醇和5 mL水活化后,上样全部待净化液,弃去全部流出液。用5 mL 2%甲酸水溶液和5 mL甲醇溶液依次淋洗PCX柱,弃去淋洗液。用3 mL 1%氨水甲醇溶液上柱洗脱,用空气泵抽干固相萃取柱填料层中的溶液,收集全部洗脱液于鸡心瓶,40℃条件下旋转蒸发至近干,吹干后以1 mL甲醇水溶液(甲醇∶水=8∶2)定容,过0.22 μm滤膜,待UPLC-MS/MS测定。
1.2.4 加标回收率试验
分别称取空白干茶1.0 g,抹茶1.0 g,茶粉0.1 g于50 mL离心管中,添加不同浓度水平的吡蚜酮标准溶液,按照1.2.2章节和1.2.3章节进行样品提取和样品净化步骤。同样处理不添加农药的空白干茶、抹茶和茶粉,作为基质空白溶液,用于配制基质匹配标准溶液,计算加标回收率。
1.2.5 液相色谱条件
ACQUITY UPLC®BEH C18色谱柱(2.1 mm×100 mm,1.7 µm)。流动相组成:流动相A为1‰甲酸乙腈,流动相B为纯净水。流动相洗脱程序:0~0.5 min,5% A;0.5~3.0 min,5%~30% A;3.0~4.0 min,30%~70% A;4.0~4.8 min,70%~99% A;4.8~5.8 min,99% A;5.8~7.3 min,99%~5% A。进样体积设置为5 µL;流速设置为0.25 mL·min-1;色谱柱柱温40℃。吡蚜酮保留时间2.54 min。
1.2.6 质谱条件
电离方式ESI+,多级反应监测MRM模式,毛细管电压3.5 kV,离子源温度150℃,去溶剂化温度350℃。锥孔反吹气N2气,流量50 L·h-1;脱溶剂气N2气,流量650 L·h-1。碰撞气Ar气,流量0.35 mL·min-1;倍增电压650 V。
2 结果与讨论
2.1 色谱-质谱条件的优化
全扫描方式进样吡蚜酮标准溶液,获得吡蚜酮特征离子,选择离子丰度最高的[M+H]+ m/z 218.1作为母离子,优化获得母离子最高响应时的锥孔电压为30 V。逐级增加碰撞能量,获得离子丰度最高的特征子离子m/z 105.1和79.1,最优碰撞能量分别为15 V和25 V,且m/z 218.1>105.1和218.1>79.0处无基质干扰,因此选择响应最高的m/z 218.1>105.1作为定量离子对,m/z 218.1>79.0作为定性离子对。
2.2 提取过程的优化
2.2.1 干茶和抹茶中吡蚜酮提取方法的确定
分别以甲醇、乙腈和丙酮3种有机溶剂和水的混合溶液(有机溶剂∶水=8∶2)作为提取溶剂,丙酮提取液颜色呈黑褐色,在后续净化过程中,PCX固相萃取柱堵塞严重。多项研究表明,中性和酸性乙腈作为水果和蔬菜中吡蚜酮的提取溶剂,其提取效率低于50%[17];本试验中乙腈作为干茶中吡蚜酮的提取溶剂,平均回收率在60%左右。甲醇和水作为提取溶剂,吡蚜酮的平均回收率高于80%,该结果与蜂蜜中吡蚜酮的研究结果相似[18]。因此确定干茶和抹茶提取过程中的有机试剂组成为甲醇。
提取溶剂中甲醇体积分数对回收率的影响如图1所示。采用纯甲醇作为提取溶剂,干茶中吡蚜酮的提取效率仅在60%左右;在提取溶剂中加入一定量的水,逐渐降低提取溶剂中甲醇的比例至80%,吡蚜酮的平均回收率升高至95.9%;继续降低甲醇体积分数,吡蚜酮回收率降低。研究表明,对于干茶样品中水溶解度较高的残留农药,常通过在提取溶剂中加入一定比例的水来提高该类农药的回收率[19]。吡蚜酮属较高水溶解度的农药(水溶解度为0.29 g·L-1),具有内吸性,易渗透进入植物组织,因此水的加入可提高干茶中吡蚜酮的提取效率。但是吡蚜酮在醇类中的溶解度远高于在水中的溶解度,因此过多的水含量不利于吡蚜酮在干茶中的提取。抹茶与干茶加工工艺不同,抹茶是以遮阴栽培的茶鲜叶为原料加工成干茶,再经研磨处理成的超微细粉。对比试验表明,提取溶剂中甲醇比例低于80%后,抹茶中吡蚜酮的回收率变化不大;但是60%甲醇条件下,由于提取后溶液中含有较高含量的水分,旋转蒸发过程耗时较长。综合考虑吡蚜酮的回收率和试验操作的时长,选择干茶及类似样品(如抹茶)中吡蚜酮的提取溶剂为甲醇和水的混合溶液(甲醇∶水=8∶2)。
提取溶剂体积对吡蚜酮回收率的影响表明,当提取溶剂体积为10 mL时,干茶中吡蚜酮的回收率达83.7%;抹茶中吡蚜酮的回收率随着提取溶剂体积的增加而增加(图2),提取体积大于15 mL时,吡蚜酮回收率大于80%;提取溶剂体积高于20 mL时,提取效率几乎不再增加。由显著性差异分析可知,提取溶剂体积为15 mL,20 mL和25 mL时,抹茶中吡蚜酮的添加回收率无显著性差异(>0.05)。为确保干茶和抹茶中吡蚜酮提取效率,选择干茶和抹茶中吡蚜酮提取溶剂的体积为20 mL。

图1 提取溶剂中甲醇体积分数对吡蚜酮提取效率的影响(n=3)
2.2.2 速溶茶粉中吡蚜酮提取方法的确定
速溶茶粉是一种方便快捷的茶叶消费产品,其制作方法多采用热水浸提,真空浓缩再喷雾干燥的方法获得。以干茶和抹茶中吡蚜酮提取方式提取速溶茶粉中的吡蚜酮,回收率低,因此甲醇和水的混合溶液不适合作为速溶茶粉基质的提取溶剂。根据速溶茶粉的工艺特征,以及速溶茶粉在一定条件下可完全溶解于水的特点,考察了水作为提取溶剂对速溶茶粉中吡蚜酮提取回收率的影响。结果表明,以20 mL水溶解并提取0.10 g茶粉中的吡蚜酮,平均回收率在90%,因此确定以水作为速溶茶粉中吡蚜酮的提取溶剂。

图2 提取溶剂体积对抹茶中吡蚜酮提取效率的影响(n=3)
Fig.2Effect of extract solvent volume on extraction efficiency of pymetrozine in matcha(n=3)
2.3 净化过程的优化
2.3.1 上样溶剂的选择
试验所用PCX固相萃取柱是以水可浸润型聚合物为基质的混合型弱阳离子交换固相萃取柱,保留机理为阳离子交换和反相保留机理,对碱性化合物有很好的保留特性[20]。分别以10 mmol·L-1盐酸水溶液、2%甲酸水溶液和2%乙酸水溶液溶解干茶和抹茶提取后的残渣,添加回收率结果表明(图3),10 mmol·L-1盐酸水溶液的添加回收率高于甲酸水和乙酸水溶液的对应处理。这可能是因为在酸性条件下吡蚜酮解离形成带正电的离子,净化过程中吡蚜酮通过正负电荷的相互作用吸附在阳离子交换柱上,而盐酸作为无机酸,使得吡蚜酮在水中的解离程度高于有机酸甲酸和乙酸,因此目标化合物吡蚜酮的阳离子化程度较高,在固相萃取柱中的吸附作用最强,所以选择使用10 mmol·L-1盐酸水溶液溶解残渣,作为待净化液。
2.3.2 洗脱溶剂的优化
试验中优化了1%氨水甲醇洗脱溶液的体积,分别采用3、5、7、9 mL 1%氨水甲醇溶液作为洗脱溶液,干茶中吡蚜酮的平均回收率如图4所示。洗脱溶剂体积为3 mL时,吡蚜酮的平均回收率高于80%;洗脱溶剂体积高于5 mL时,吡蚜酮的回收率稍有下降,可能是因为共洗脱杂质的增加影响了质谱响应。基于添加回收率要求和试验操作的实际需求,选择3 mL 1%氨水甲醇溶液作为洗脱液。

图3 上样溶剂中酸调节剂种类对干茶中吡蚜酮提取效率的影响(n=3)
2.4 方法确证
2.4.1 标准曲线和基质效应
电喷雾离子化效率易受样品基质的影响,色谱分离时共流出物质会影响待测成分的离子化效率,从而引起质谱信号的改变。质谱信号的增强或抑制作用通常以基质效应表示(ME):ME%=100×(i/0-1),i为基质匹配标准曲线的斜率,0为纯溶剂标准曲线的斜率。当ME<0时,则呈现基质减弱效应;当ME>0时,则呈现基质增强效应。在最优的提取、净化和测定条件下,分别用纯溶剂、干茶、抹茶和速溶茶粉空白基质准确配制含量为0.001~1.000 mg·L-1的吡蚜酮标准溶液,以5~8点构建标准曲线。吡蚜酮溶剂标准曲线的线性方程为=8 809 380+26 002,相关系数(2)为0.999 6;吡蚜酮在干茶、抹茶和速溶茶粉基质中的基质匹配标准曲线(表1)2为0.998 6~0.999 7。计算可知,吡蚜酮在干茶、抹茶和速溶茶粉基质中的ME在–11.62%~–34.05%,即吡蚜酮在3种基质中均存在一定的基质抑制效应。为了提高方法的准确性,本试验采用基质匹配标准溶液校正方法进行基质效应补偿。

图4 洗脱溶剂体积对干茶中的吡蚜酮提取效率的影响(n=3)
Fig.4Effect of elution volumes on recovery of pymetrozine in dry tea(n=3)
2.4.2 方法的准确度、精密度和定量限
在最优条件下,对吡蚜酮在3种基质中的添加回收率进行考察。如表1所示,在0.005~ 1.000 mg·kg-1的添加浓度下(n=5),吡蚜酮的添加回收率在77.04%~95.14%,相对标准偏差RSD为1.85%~6.91%,回收率和精密度数据均符合农药残留检测要求。以最小添加浓度作为方法的定量限LOQ,则吡蚜酮在干茶、抹茶和速溶茶粉中的LOQ分别为0.005、0.005mg·kg-1和0.010mg·kg-1。茶产品空白样品、添加样品和基质标准溶液中吡蚜酮的色谱图如图5所示。
2.5 实际样品测定
采用本文所建立的方法,对12份不同市场来源的茶叶、抹茶、速溶茶粉和1份田间药后的茶叶样品进行测定。结果表明,市场样品中均未检出吡蚜酮,田间茶叶样品中吡蚜酮的残留量为0.056 mg·kg-1(图5-A4)。

表1 方法确证参数
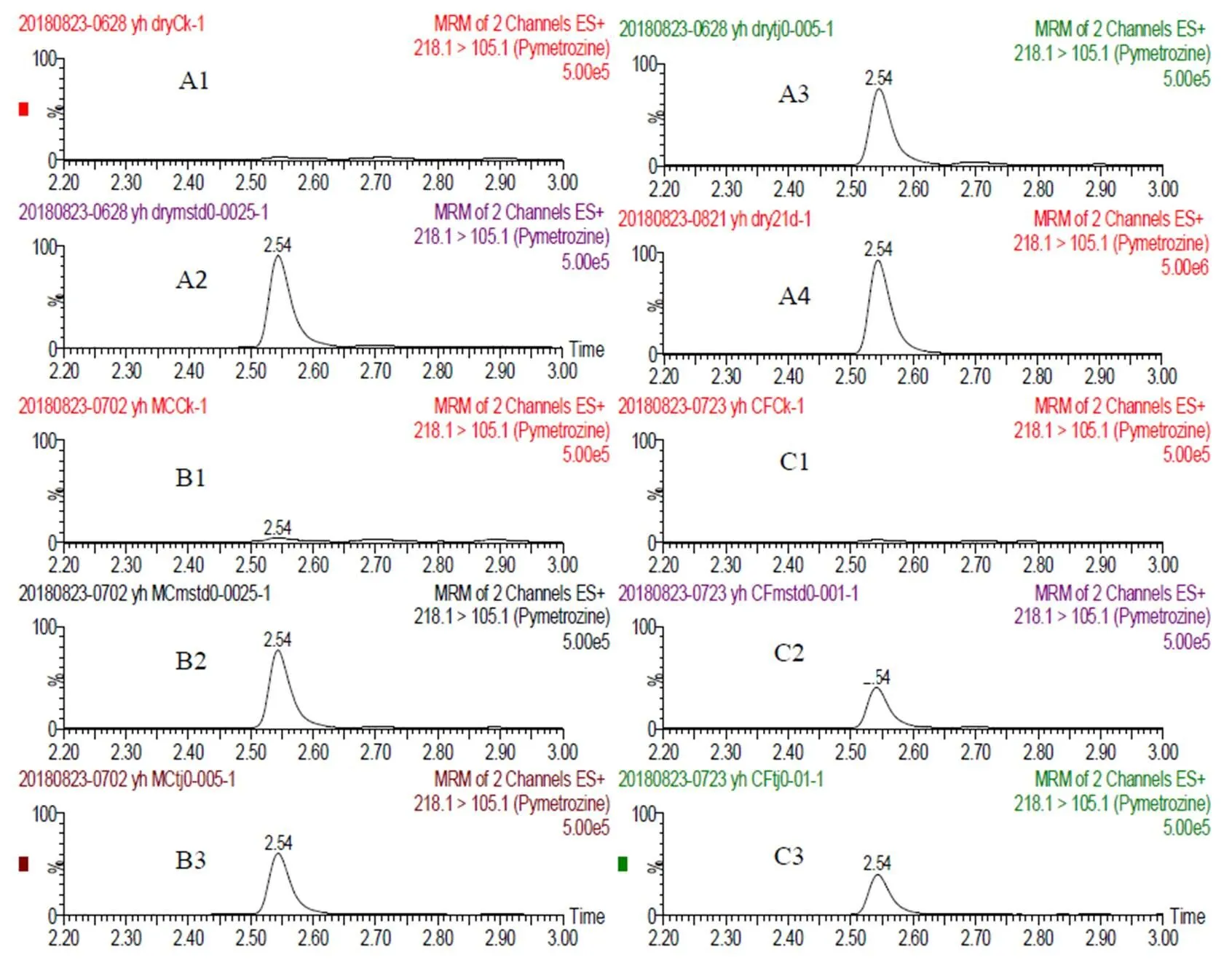
注:空白样品:干茶A1,抹茶B1,速溶茶粉C1;基质标准:A2 0.002 5 mg·L-1,B2 0.002 5 mg·L-1,C2 0.001 mg·L-1;添加样品:A3 0.005 mg·kg-1,B3 0.005 mg·kg-1,C3 0.01 mg·kg-1;干茶实际样品:A4
3 结论
本文利用甲醇和水混合提取、PCX固相萃取柱净化、超高效液相色谱-串联质谱技术测定,建立了干茶、抹茶和速溶茶粉中吡蚜酮残留量的测定方法,该方法简便快速、灵敏度高、有机溶剂用量少,在回收率、定量限和精密度等方面均能满足我国和其他茶叶进口国家或地区对茶叶中吡蚜酮检测的残留限量要求。
[1] Lehotay S J, de Kok A, Hiemstra M. Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables using gas and liquid chromatography and mass spectrometric detection [J]. Journal of AOAC International, 2005, 88(2): 595-614.
[2] Lehotay S J, Mastovská K, Lightfield A R. Use of buffering and other means to improve results of problematic pesticides in a fast and easy method for residue analysis of fruits and vegetables [J]. Journal of AOAC International, 2005, 88(2): 615-629.
[3] Komasawa N, Ueki R, Kaminoh Y. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables [J]. Journal of Chromatography A, 2010, 1217(16): 2548-2560.
[4] Lee S W, Choi J H, Cho S K, et al. Development of a new QuEChERS method based on dry ice for the determination of 168 pesticides in paprika using tandem mass spectrometry [J]. Journal of Chromatography A, 2011, 1218(28): 4366-4377.
[5] Hiemstra M, de Kok A. Comprehensive multi-residue method for the target analysis of pesticides in crops using liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography A, 2007, 1145(1/2): 3-25.
[6] Gonzálezcurbelo M Á, Lehotay S J, Hernándezborges J, et al. Use of ammonium formate in QuEChERS for high-throughput analysis of pesticides in food by fast, low-pressure gas chromatography and liquid chromatography tandem mass spectrometry [J]. Journal of Chromatography A, 2014, 1358: 75-84.
[7] Hong J H, Lee C R, Lim J S, et al. Comparison of analytical methods and residue patterns of pymetrozine in aster scaber [J]. Bulletin of Environmental Contamination & Toxicology, 2011, 87(6): 649-652.
[8] Li C, Yang T, Huangfu W, et al. Residues and dynamics of pymetrozine in rice field ecosystem [J]. Chemosphere, 2011, 82(6): 901-904.
[9] 赵瑞, 李二虎, 李桂红, 等. 高效液相色谱法测定芹菜中的吡蚜酮残留[J]. 农药科学与管理, 2014, 35(9): 33-36.
[10] 单菊菊, 程新胜, 黄兰. 固相萃取-高效液相色谱法测定烟叶中的“吡蚜酮”残留量[J]. 烟草科技, 2010, 49(5): 44-50.
[11] 占绣萍, 黄兰淇, 陈建波, 等. 吡蚜酮在保护地菠菜上的残留量分析及安全使用[J]. 农药科学与管理, 2017, 38(5): 29-34.
[12] 吴绪金, 马婧玮, 刘丹黎, 等. 吡蚜酮在棉叶和土壤中消解动态分析及棉子中残留量膳食摄入评估[J]. 农药, 2017(7): 506-509.
[13] Al-Rahman S H A, Almaz M M, Ahmed N S. Dissipation of Fungicides, Insecticides, and Acaricide in Tomato Using HPLC-DAD and QuEChERS Methodology [J]. Food Analytical Methods, 2012, 5(3): 564-570.
[14] 王全胜, 曹梦超, 刘雅楠, 等. QuEChERS结合UPLC-ESI-MS/MS分析吡蚜酮和异丙威SC在稻田中的残留特征[J]. 农业环境科学学报, 2015, 34(3): 431-437.
[15] 鲍鏖天, 裴少芬, 唐杏燕, 等. QuEChERS结合高效液相色谱串联质谱快速检测速溶茶粉中八种农药残留[J]. 食品与发酵工业, 2018, 44(5): 232-236.
[16] 张田田, 徐加利, 路兴涛, 等. 吡蚜酮防治茶树假眼小绿叶蝉的效果评价及其残留分析[J]. 山东农业科学, 2015, 47(5): 89-92.
[17] Zhan X P, Ma L, Huang L Q, et al. The optimization and establishment of QuEChERS-UPLC-MS/MS method for simultaneously detecting various kinds of pesticides residues in fruits and vegetables [J]. Journal of Chromatography B, 2017, 1060: 281-290.
[18] Hou J B, Xie W, Hong D, et al. Simultaneous determination of ten neonicotinoid insecticides and two metabolites in honey and Royal-jelly by solid-phase extraction and liquid chromatography-tandem mass spectrometry [J]. Food Chemistry, 2019, 270: 204-213.
[19] 周利, 罗逢健, 张新忠, 等. 纳米竹炭分散固相萃取/超高效液相色谱-串联质谱法测定绿茶中的农药多残留[J]. 分析测试学报, 2014, 33(6): 642-647.
[20] 周鹏, 林钦, 黄红霞, 等. 稳定同位素稀释超高效液相色谱-串联质谱法测定饲料中24种禁用兽药含量[J]. 分析化学, 2014, 42(2): 233-238.
Determination of Pymetrozine in Tea Products by Solid Phase Extraction-Ultra High Performance Liquid Chromatography-Tandem Mass Spectrometry
YU Huan1,2, ZHOU Li1*, LIN Qin1,2, YANG Jie1,2, SUN Hezhi1, WU Xudong3, WANG Xinru1, ZHANG Xinzhong1, CHEN Zongmao1, LUO Fengjian1*
1. Research Center of Quality Safety for Agricultural Products, Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008,China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China;3. Pu'er Comprehensive Technical Testing Center, Pu'er 665099, China
An analytical method for the determination of pymetrozine residues in tea products, including dry tea, matcha and instant tea powder, was established based on Cleanert PCX solid phase extraction-ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The residual pymetrozine in dry tea, matcha and instant tea powder was extracted by a mixture of methanol and water, cleaned up and concentrated by a Cleanert PCX SPE column, and separated on an Acquity BEH C18column. Pymetrozine level was detected by UPLC-MS/MS on multiple reaction monitoring (MRM) mode and quantified with external standard method. In the spiked range of 0.005-1.000 mg·kg-1,the average recovery of pymetrozine was 77.0%-95.1%, and the relative standard deviation (RSD, n=5) ranged from 1.8%-6.9%. The limit of quantitation (LOQ) was 0.005 to 0.010 mg·kg-1. The sensitivity, precision and recovery of the developed method meet the requirements for residual pesticides analysis in various tea products. The results of this study can provide an analytical method for the determination and risk assessment of pymetrozine in tea products.
pymetrozine, tea, pesticide residue, solid phase extraction, UPLC-MS/MS
S571.1;S482
A
1000-369X(2019)04-440-07
2018-12-13
2019-02-15
国家重点研发计划(2016YFD0200207)、浙江省自然科学基金(LY18C160005)、中国农业科学院创新工程(CAAS-ASTIP-TRICAAS)
余焕,女,硕士研究生,主要从事农药残留方面的研究,yhteawork@163.com。*通信作者:lizhou@tricaas.com,lfj@tricaas.com
