A型口蹄疫病毒多肽抗原表位的原核表达及多克隆抗体的制备
2019-08-20程凯慧沈付娆邹积振苗自利解晓莉张亮杨宏军何洪彬
程凯慧 沈付娆 邹积振 苗自利 解晓莉 张亮 杨宏军 何洪彬

摘要:为构建A型口蹄疫病毒多肽抗原表位的原核表达载体,并制备多克隆抗体,利用基因合成技术将不同株的A型口蹄疫病毒抗原表位A-A10-61-VP1(第141~160位氨基酸)、A-A10-61-VP1(第200~212位氨基酸)、A22Iraq-VP1(第 136~164位氨基酸)串联,在其间引入合适的linker序列,重组得到pET-28a(+)质粒中,转化大肠杆菌BL21(DE3)感受态细胞,诱导表达重组蛋白,免疫新西兰兔制备多克隆抗体。成功构建了A型口蹄疫病毒抗原表位原核表达载体,获得高纯度重组蛋白和含A型口蹄疫病毒抗体的兔抗血清,为A型口蹄疫病毒诊断试剂盒的研发和A型口蹄疫病毒表位多肽疫苗的研究奠定基础。
关键词:A型口蹄疫病毒;抗原表位;重组蛋白;多肽疫苗
中图分类号:S852.65 文献标志码: A
文章编号:1002-1302(2019)08-0184-03
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒(FMDV)引起一种急性、高度接触性传染病,除可以感染家畜外,还可以感染多种野生动物,包括象[1]、大额牛[2-3]、牦牛[4]、水鹿、梅花鹿和野生水牛[5]等。本病以流行范围广、传播速度快和发病率高为特点,一旦暴发会给畜牧业造成严重的经济损失,被国际兽医局列为第一类烈性传染病。作为一种全球范围内的重大动物疫病,已成为当前动物及其产品国际贸易的主要障碍。
FMDV属于小RNA病毒科,极易变异,根据交叉保护试验已确定的病毒血清型有7个:O、A、C、SAT1、SAT2、SAT3和Asia1型。在亞洲地区,主要流行A、O和Asia1型,近几年尤其A型较多。其基因组编码4个结构蛋白和8个非结构蛋白,结构蛋白包括VP1、VP2、VP3和VP4。其中,VP1、VP2和VP3位于病毒表面,VP4位于病毒内部。VP1上有B细胞和T细胞抗原表位,能诱导机体产生中和抗体,因此VP1蛋白的抗原表位常被作为诊断抗原,用于FMDV相应亚型抗体水平的检测和表位疫苗的研制。
FMDV抗原结构十分复杂,不同血清型、基因型和分离株间抗原位点和抗原表位都有所差别,不同的株系有不同的研究成果,如A5亚型有2个抗原位点能够诱导产生中和抗体,一个位于VP1的羧基末端,另一个位于VP2的B-C环上[6]。FMDV A10包括4个抗原位点,分别位于VP1的G-H环、VP1的169位、VP1的羧基端、VP3上的部分残基[7]。有试验验证发现位于VP1第21~40位氨基酸和161-羧基端的2个表位能够增强FMD合成肽疫苗的免疫原性[8]。VP1的第135~144位氨基酸和第150~160位氨基酸也已被证实能够在牛的免疫作用中起辅助作用[9]。VP1的140~160位合成肽能够显著刺激牛外周血单核细胞增殖[10]。
综上所述,本试验利用原核表达系统将串联的A型口蹄疫VP1多肽抗原表位进行了表达,获得A型口蹄疫病毒多肽抗原表位,一方面可以建立A型口蹄疫病毒的检测方法,为临床样本的检测提供方便;另一方面可以建立抗原表位多肽疫苗的技术平台,为A型口蹄疫肽苗的研制打下坚实的基础。
1材料与方法
1.1菌株与试剂
原核表达载体PET-28a由山东省农业科学院奶牛研究中心实验室保存,DH5α感受态细胞、BL21(DE3)感受态细胞、NotⅠ/EcoRⅠ限制性内切酶、质粒提取试剂盒等,均购自宝生物工程(大连)有限公司;过硫酸铵、TEMED、硝酸纤维素膜、透析袋等,均为国产或进口分析纯;溶菌酶、弗氏完全佐剂、弗氏不完全佐剂、HRP标记兔抗牛IgG,购自Sigma公司;2~3 kg/只的新西兰白兔,购自山东省农业科学院种兔试验基地。
1.2A型FMDV多肽抗原表位原核表达载体的构建
根据我国及周边国家FMDV流行株的抗原表位基因,确定多肽抗原表位基因,同时考虑密码子偏嗜性,利用化学合成的方法将A型FMDV流行株的抗原表位基因利用柔性氨基酸串联,两端并设计有NotⅠ/EcoRⅠ酶切位点。全基因共969 bp,将目的片段连接到PET-28a上,双酶切鉴定,并送北京六合华大基因生物技术有限公司测序鉴定。
1.3串联抗原表位的诱导表达
重组质粒经酶切鉴定正确后,转化BL21(DE3)感受态细胞,挑取单菌落,摇菌,37 ℃,200 r/min培养到D600 nm为0.8左右时,分别加入IPTG,终浓度分别为0.1~2.0 mmol/L,诱导时间分别从3~7 h不同时间点收集菌液,离心收集菌体,加入1%的SDS和蛋白上样缓冲液(4 ∶1比例),煮沸5 min处理样品,12 000 r/min离心1 min,取上清10 μL,沉淀加入1%的SDS和蛋白上样缓冲液(4 ∶1比例)处理,上清和沉淀同时进行SDS-PAGE电泳,电泳结束后用考马斯亮蓝染色,并脱色鉴定。
1.4表达蛋白的纯化
按照最佳诱导表达条件大量诱导目的蛋白,收集诱导表达的菌体,按照每10 mL菌液收集的菌体加入630 μL裂解缓冲液、70 μL溶菌酶、10 μL PMSF(100 mmol/L)、1 μL胃蛋白酶抑制剂、1 μL胰蛋白酶抑制剂,重悬菌体,超声破碎细胞,当菌液变为半透明时13 000 r/min离心30 min收集上清,依照 Ni-NTA 纯化试剂盒说明书纯化蛋白,并进行蛋白的复性。
1.5表达蛋白的western-blot分析
取纯化的蛋白10 μL进行12% SDS-PAGE电泳,将SDS-PAGE凝胶上的目的条带转移到硝酸纤维素膜上,用5%的脱脂奶粉封闭,以His单抗作为一抗,HRP-山羊抗鼠IgG作为二抗,ECL显色观察。
1.6间接ELISA方法的建立
純化的蛋白作为抗原按不同的浓度包被96孔板酶标板,用牛A型FMDV阳性血清做一抗,按照1 ∶4、1 ∶8、1 ∶16、1 ∶32、1 ∶64、1 ∶128的比例稀释,与蛋白稀释度形成矩阵,HPR-兔抗牛IgG 1 ∶5 000稀释作为二抗,摸索蛋白和一抗的最佳浓度,初步建立A型FMDV间接ELISA检测方法。
1.7多克隆抗体的制备及鉴定
根据参考文献中的方法,试验组免疫新西兰大白兔2只,并以PET-28a作为空白对照组,免疫前采血,一免用完全弗式佐剂与蛋白1 ∶1的比例乳化,二免三免用不完全弗式佐剂与蛋白1 ∶1的比例乳化,对兔进行皮下多点免疫注射,每次免疫蛋白总量保证200 μg,免疫3次,每次免疫间隔期为2周,每次免疫前采血留样,三免后14 d心脏采血,分离血清。采用建立的间接ELISA方法进行多克隆抗体效价的检测,并进行Western-Blot验证。
2结果与分析
2.1原核表达载体的双酶切及测序鉴定
将构建成功的原核表达载体用NotⅠ/EcoRⅠ限制性内切酶双酶切,经电泳鉴定得到PET-28a(5 369 bp)和目的条带(969 bp),和预期结果大小保持一致(图1),测序结果显示目的条带与化学合成的多肽抗原表位基因序列保持一致,说明多肽抗原表位的原核表达载体构建成功。
2.2蛋白的纯化
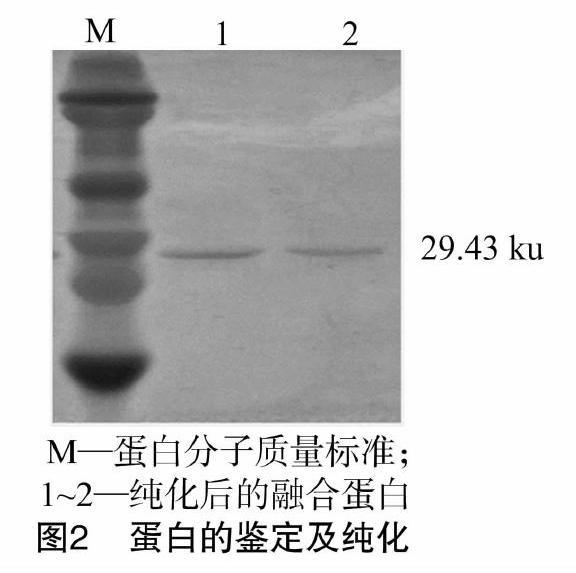
按照探索规范的条件对目的蛋白进行大量诱导纯化,经SDS-PAGE鉴定,发现成功诱导纯化出与预期大小一致的目的蛋白条带(图2),约29.43 ku。
2.3Western-Blot分析
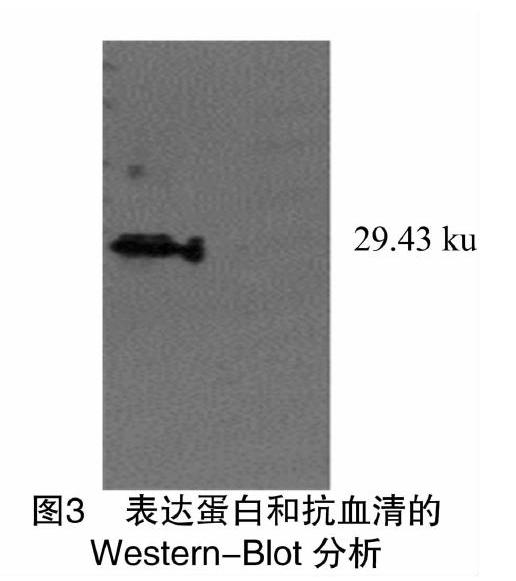
将纯化的蛋白进行Western-Blot验证分析,结果显示有单一目的条带出现(图3),与预期结果一致,进一步验证纯化的蛋白是所需目的条带。
2.4间接ELISA方法的建立
用矩阵的方法测得结果见表1,蛋白包被最佳浓度为 2.30 μg/mL,血清稀释浓度为1 ∶20时,检测效果最佳,其 P/N 为13.85。ELISA方法建立中P/N值越高,证明阳性值和阴性值差异越明显,检测方法越灵敏。成功建立FMDV-A型间接ELISA检测方法。
2.5多克隆抗体抗体水平的检测
FMDV-A型VP1蛋白抗原表位多肽融合蛋白与抗FMDV-A兔血清Western-Blot鉴定结果见图4,有单一的目的条带,结果说明FMDV-A型VP1蛋白抗原表位多肽融合蛋白免疫兔只能产生抗该抗原表位的抗体。
3讨论
抗原表位是蛋白质抗原性的基础,是抗原分子中诱导特异性免疫应答的基本结构和功能单位。严格来说,抗体的特异性是针对表位而不是针对完整的抗原分子,这些抗原表位重组蛋白理论上与A型相对应,但处于不同进化谱系的FMDV流行株刺激机体所产生的不同中和抗体之间,均可发生中和反应,为拓展宿主防御系统对病毒表位的识别提供可能。有研究表明,根据对FMDV主要抗原表位的研究结果,出现了许多的多肽疫苗。其中,Brown等将第141~148位氨基酸和第200~213位氨基酸用链接肽连接起来,通过原核表达系统获得了表达,免疫猪、牛等动物都取得了良好的免疫效果[11];Dimarch等同样选用VP1上的第141~148位氨基酸和第200~213位氨基酸,用1个丝氨酸和2个脯氨酸组成的链接肽使多肽具有空间立体结构,使免疫脉鼠后的抗体水平得到极大的提高[8];VP1基因的第140~160、200~213位氨基酸肽段是决定FMDV免疫原性的主要B细胞抗原表位, 串联
起来可以增强抗原的免疫原性[12]。本研究对FMDV-A型流行株VP1蛋白上的该2个抗原表位进行多次重复串联,同时注意各抗原表位的长度不宜太长,防止形成空间结构或者存在疏水基,这样不利于后期蛋白的纯化,过少的抗原表位抗原位点偏少,不能很好地与抗体结合,不能产生足够的中和抗体。同时,各抗原表位之间利用柔性氨基酸进行连接,使各抗原表位之间不形成空间结构,保证各抗原表位的线性结构或独立的空间构象,保持其独立的生物学特性。最终选取了由不同毒株FMDV-A型VP1蛋白上的3个抗原表位进行串联组成多表位抗原,同时进行了3次重复。另外,根据大肠杆菌密码子的偏爱性,对A型串联抗原表位基因上的部分密码子进行了同义突变,这样可提高串联抗原表位基因在大肠杆菌中的表达效率。
因此,针对FMDV-A型VP1基因的抗原表位进行研究,不但对口蹄疫基因遗传变异有指导作用,而且对口蹄疫病毒的毒株型和亚型的分析、流行病毒调查及疫源地追踪,甚至对研制最新型的口蹄疫疫苗具有很好的支撑。
参考文献:
[1]Pyakural S,Singh U,Singh N B. An outbreak of foot-and-mouth disease in Indian elephants(Elephas maximas)[J]. Veterinary Record,1976,99(2):28-29.
[2]Dutta P K,Mahanta P N,Chakraborty A K. FMD in mithun[J]. Veterinary Record,1979:113-114.
[3]Verma N D,Sarma D K. Note on foot-and-mouth disease in mithun in arunachal Pradesh[J]. Indian Journal of Virology,1997,13(1):75-76.
[4]Barman N N,Sarma D K,Das S,et al. Foot-and-mouth disease in wild and semi-domesticated animals of the northeastern states of India[J]. Indian Journal of Animal Sciences,1999,69(10):781-783.
[5]Vosloo W,Boshoff K,Dwarka R,et al. The possible role that buffalo played in the recent outbreaks of foot-and-mouth disease in south Africa[J]. Annals of the New York Academy of Sciences,2002,969:187-190.
[6]Saiz J C,Gonzalez M J,Borca M V,et al. Identification of neutralizing antigenic sites on VP1 and VP2 of type A5 foot-and-mouth disease virus,defined by neutralization-resistant variants[J]. Journal of Virology,1991,65(5):2518-2524.
[7]Thomas A A,Woortmeijer R J,Puijk W,et al. Antigenic sites on foot-and-mouth disease virus type A10[J]. Journal of Virology,1988,62(8):2782-2789.
[8]Collen T,Dimarchi R,Doel T R. A T cell epitope in VP1 of foot-and-mouth disease virus is immunodominant for vaccinated cattle[J]. Journal of Immunology,1991,146(2):749-755.
[9]Zamorano P,Wigdorovitz A,Chaher M T,et al. Recognition of B and T cell epitopes by cattle immunized with a synthetic peptide containing the major immunogenic site of VP1 FMDV 01 Campos[J]. Virology,1994,201(2):383-387.
[10]van Lierop M J,Wagenaar J P,van Noor J M,et al. Sequences derived from the highly antigenic VP1 region 140 to 160 of foot-and-mouth disease virus do not prime for a bovine T-cell responseagainst intact virus[J]. Journal of Virology,1995,69(7):
4511-4514.
[11]Brown F,Benkirane N,Limal D,et al. Delineation of a neutralizing subregion within the immunodominant epitope(GH loop) of foot-and-mouth disease virus VP1 which does not contain the RGD motif[J]. Vaccine,1999,18(1/2):50-56.
[12]Morgan D O,Moore D M. Protection of cattle and swine against foot-and-mouth disease,using biosynthetic peptide vaccines[J]. American Journal of Veterinary Research,1990,51(1):40-45.
