热胁迫对杜鹃叶片叶绿素荧光特性的影响
2019-08-20刘婉迪袁媛王威谢倩陈清西
刘婉迪 袁媛 王威 谢倩 陈清西
摘要:以耐热杜鹃(Rhododendron L.)品种天章和不耐热品种霞红的4年生扦插苗为试验材料,研究不同高温胁迫(35、45、50 ℃)对杜鹃离体叶片光系统Ⅱ活性的影响,以揭示高温胁迫对杜鹃叶片光合机构的行为特征。结果表明,2个品种的杜鹃叶片经过3个温度的热胁迫后,PSⅡ的最大量子效率(Fv/Fm)、光化学淬灭系数(qP)、PSⅡ有效量子产量[Y(Ⅱ)]均降低,其中霞红叶片的Fv/Fm经过45、50 ℃胁迫后下降显著,qP、Y(Ⅱ)在3个温度胁迫后均显著降低,天章叶片的Fv/Fm、qP在50 ℃胁迫后显著下降,Y(Ⅱ)在45、50 ℃脅迫后也显著下降;2个杜鹃品种的叶片NPQ在3种热胁迫处理后均上升;天章叶片的调节性能量耗散[Y(NPQ)]在45、50 ℃处理后相比对照显著增加,霞红叶片的 Y(NPQ) 则在35、45 ℃处理后显著增加,50 ℃处理后显著减小;天章叶片的非调节性能量耗散[Y(NO)]在50 ℃处理后显著增加,霞红叶片的Y(NO)在45、50 ℃胁迫处理后显著增加。天章、霞红叶片经50 ℃处理后,激发能分配不平衡偏离系数(β/α-1)相比对照显著上升。由此可以看出,天章叶片的叶绿素荧光特性受热胁迫的影响小于霞红,耐热杜鹃天章叶片的PSⅡ热稳定性高于不耐热杜鹃霞红;此外,对热胁迫伤害的协调保护机制,一方面表现在过剩的激发能量会从以Y(NPQ)为主转向以Y(NO)为主,另一方面也可能表现在通过调节PSⅡ与PSⅠ之间激发能分配平衡性的天线系统的状态转换上。
关键词:杜鹃;叶绿素荧光参数;热胁迫;光系统Ⅱ
中图分类号: S685.210.1文献标志码: A
文章编号:1002-1302(2019)08-0144-04
杜鹃(Rhododendron simsii Planch)是杜鹃花科(Ericaceae)杜鹃属常绿灌木,其品种繁多,花色丰富,是我国传统的十大名花之一,具有很高的观赏及经济价值[1],其生长适宜的温度为12~25 ℃。目前,杜鹃花的多数品种由于耐热性差,使得夏季的高温成为制约其生长发育的主要环境因子,严重影响了杜鹃在夏季园林绿化造景中的应用。
高温会引起植物生长和发育的不可逆损伤,直接导致蛋白质变性和膜脂流动性增加,间接导致叶绿体中酶的失活,抑制蛋白质的合成,加速蛋白质降解并使膜的完整性丧失[2];此外,高温还通过影响PSⅡ的电子传递过程,进一步改变光合反应速率[3]。PSⅡ对热敏感,其活性会受到高温的严重抑制[4],如疏叶骆驼刺叶片处于短时间的高温环境中时,PSⅡ是主要的热敏感位点,在重度热胁迫下,PSⅡ会发生永久性损伤[5];在高温胁迫下,柑橘叶片的PSⅡ光化学效率显著降低,且光合速率显著下降[6]。目前,国内外对杜鹃的研究主要集中于其种质资源的调查[7]以及干旱、低温胁迫等对杜鹃生理的影响等方面[8-9],对杜鹃耐热生理的研究主要集中于分析传统生理指标[10],关于杜鹃在热胁迫下光合系统的研究,尤其是叶绿素荧光系统对高温的响应及其耐热机制研究非常有限。
本研究以2个具有不同耐热性的杜鹃品种为材料,从叶绿素荧光动力学特征入手,探讨不同热激胁迫对杜鹃叶绿素荧光特性的影响,旨在揭示热胁迫与叶绿素荧光特性及相关指标之间的关系,以期为耐热杜鹃新品种的选育提供理论依据和参考指标。
1材料与方法
1.1材料
供试杜鹃品种为耐热品种天章和不耐热品种霞红,由永根杜鹃花培育有限公司提供。试验于2016年3月在福建农林大学园艺设施温室内进行。挑选4年生扦插苗,栽植于塑料花盆中(长×宽×高=20 cm×20 cm×30 cm),于温室中适应3个月后,选取长势一致、无病虫害的植株进行试验。
1.2试验设计
将杜鹃植株于黑暗条件下处理30 min后,从上到下选取第5~6张大小一致、无病虫害的叶片,完全浸于不同温度的水浴锅中,温度分别设为25(对照)、35、45、50 ℃,10 min,进行叶绿素荧光参数的测定。试验全程均在黑暗条件下进行,重复3次。
1.3叶绿素荧光参数的测定
试验仪器为调制式IMAGING-PAM(德国WALZ公司生产)。测定的叶绿素荧光参数包括初始荧光(F0)、最大荧光(Fm)、PSⅡ的最大量子效率(Fv/Fm)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)、PSⅡ有效量子产量[Y([QX(Y15]Ⅱ[QX)])]、调节性能量耗散[Y(NPQ)]、非调节性能量耗散[Y(NO)]、光下最大荧光(Fm′)、荧光(F)、“湖泊模型”中处于开放态PSⅡ反应中心的分数(qL)。相关计算公式如下:
qP=(Fm′-F)/(Fm′-F0′);
NPQ=(Fm-Fm′)/Fm′;
Y(Ⅱ)=(Fm′-F)/Fm′;
Y(NPQ)=1-Y(Ⅱ)-1/[NPQ+1+qL(Fm/F0-1)];
Y(NO)=1/[NPQ+1+qL(Fm/F0-1)];
F0′=F0/(Fv/Fm+F0/Fm′)。
式中:F0′为光下最小荧光。
参考Braun等的公式[11]计算光系统间的激发能分配不平衡偏离系数(β/α-1),其中PSⅡ激发能分配系数的计算公式为β=1/(1+f),PSⅠ激发能分配系数的计算公式为α=f/(1+f),f=(Fm-F)/(Fm-F0′)。其中:α为PSⅠ激发能分配系数;β为PSⅡ的激发能分配系数;f为常数。
1.4数据分析
用SPSS 13.0和Graphpad Prism 7.0软件进行试验数据的统计与分析,数值均以平均值±标准差表示。统计方法采用Duncans新复极差检验法(α=0.05)和One-Way方差分析(ANOVA)。
2结果与分析
2.1热胁迫对天章和霞红叶片Fv/Fm的影响
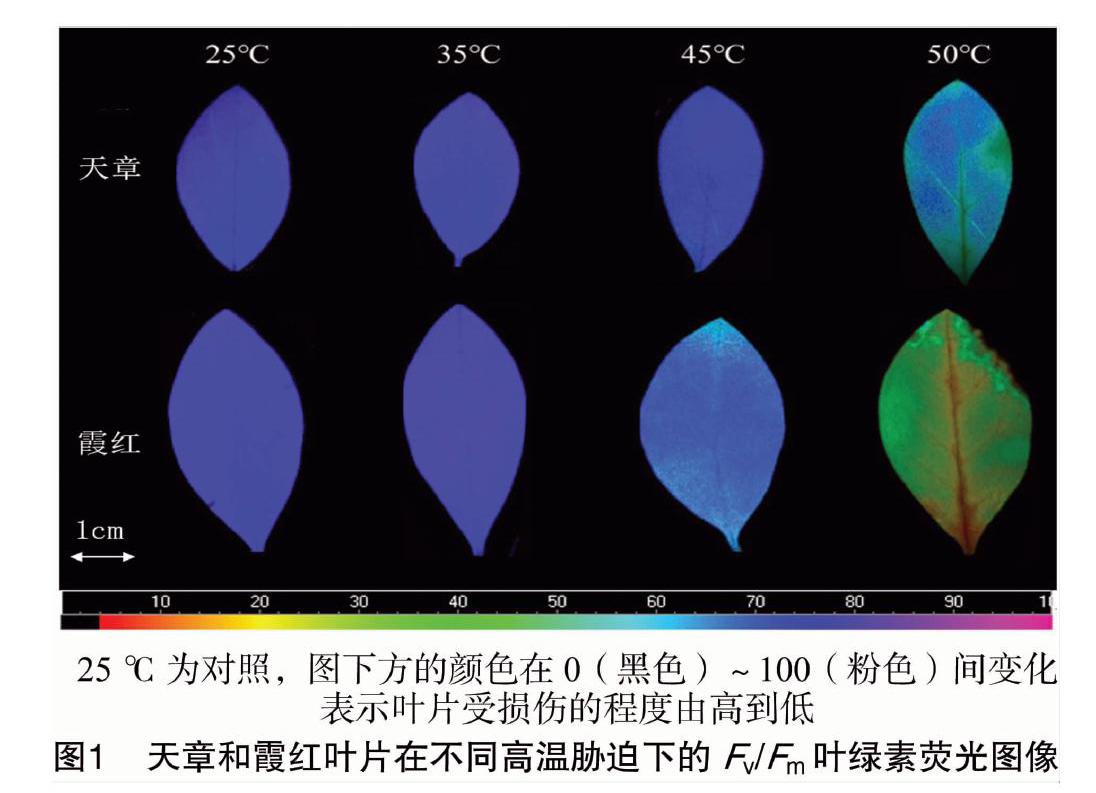
由图1可见,经35 ℃热胁迫后,天章、霞红叶片的Fv/Fm图像与对照相比变化不明显;经45 ℃热胁迫后,霞红叶片的Fv/Fm图像与对照相比出现明显变化,而天章叶片的Fv/Fm图像仍处于蓝色区域;经50 ℃热胁迫后,天章、霞红叶片的Fv/Fm图像变化都较明显,并且霞红的图像变化更明显。
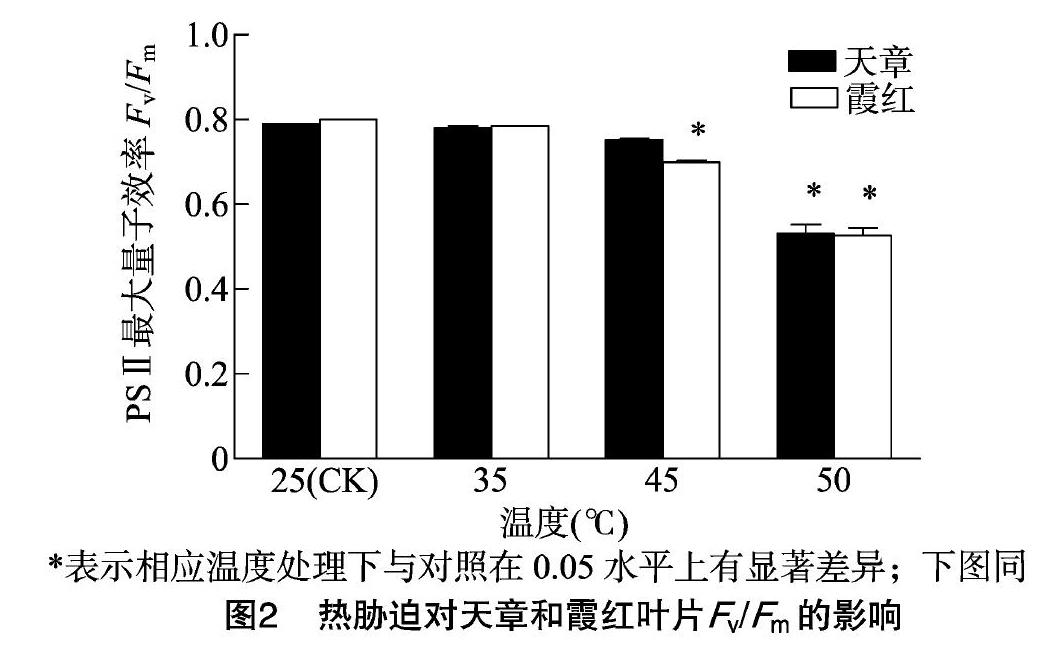
由图2可以看出,与25 ℃(对照)温度处理相比,不同温度的热胁迫使得天章、霞红叶片的Fv/Fm均下降,其中天章在经50 ℃热胁迫后,叶片的Fv/Fm显著下降。而霞红在经45、50 ℃热胁迫后,叶片的Fv/Fm均显著减小。天章叶片的Fv/Fm在25 ℃时为0.79,在经35、45、50 ℃热胁迫后分别下降了1.3%、5.1%、32.9%;霞红叶片的Fv/Fm在25 ℃时为0.8,在经35、45、50 ℃热胁迫后分别下降了2.5%、11.25%、38.8%;在经45、50 ℃热胁迫后,霞红叶片的Fv/Fm相比对照下降的幅度较天章更大。
2.2热胁迫对天章和霞红叶片qP和Y(Ⅱ)的影响
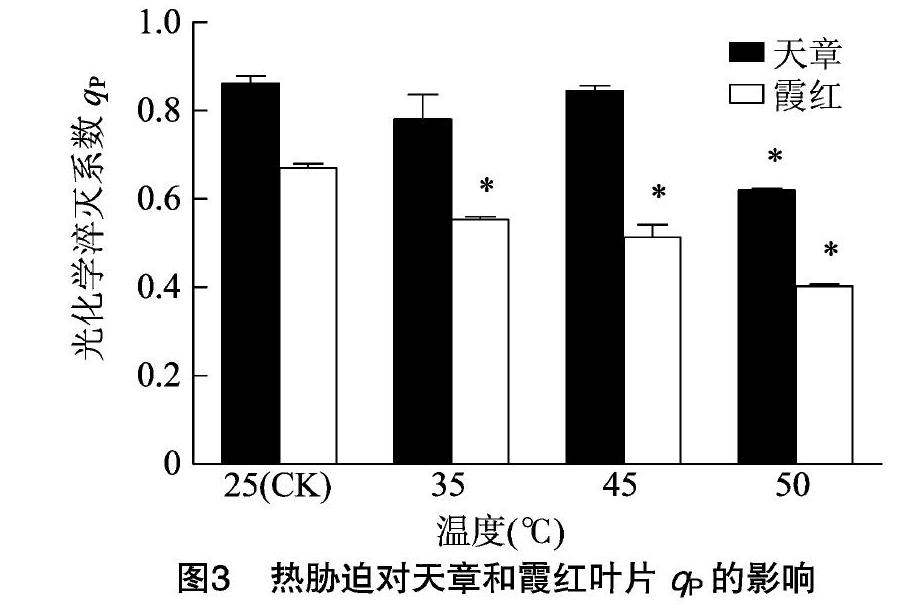
由图3可以看出,35、45、50 ℃的热胁迫导致霞红叶片的qP显著降低,与对照相比分别下降了17.9%、23.9%,40.3%。
而天章叶片在50 ℃热胁迫下,qP显著下降,与对照相比下降了27.9%,经其他温度处理后qP有所下降但与对照相比变化不显著。
由图4可以看出,经35、45、50 ℃热胁迫后,霞红叶片的Y(Ⅱ)的下降幅度均明显高于天章。经35、45、50 ℃热胁迫后,霞红叶片的Y(Ⅱ)均显著减小,与对照相比分别下降了24.5%、23.3%、40.3%。而天章在经过35 ℃热胁迫后,叶片的Y(Ⅱ)变化不显著,经45、50 ℃热胁迫后Y(Ⅱ)显著减小,分别比对照减少了23.2%、63.2%。
2.3热胁迫对天章和霞红叶片NPQ、Y(NPQ)和Y(NO)的影响
由图5可以看出,2个品种的杜鹃在经过3种热胁迫后,叶片的NPQ均提高,其中天章在经45、50 ℃热胁迫后,叶片的NPQ相比对照显著提高,分别是对照的2.5、1.4倍。霞红叶片的NPQ在经35、45 ℃热胁迫后,相比对照显著提高,分别是对照的1.9、1.4倍。天章叶片的NPQ在经45 ℃热胁迫处理后,提高幅度明顯高于另2个温度处理下的提高幅度,而霞红叶片的NPQ则在35 ℃热胁迫后的提高幅度明显高于另外2个胁迫处理。
由图6可以看出,天章叶片在经45、50 ℃热胁迫后,Y(NPQ) 显著增加,分别比对照增加了1.3、1.6倍,经过 35 ℃ 热胁迫后没有明显变化。霞红叶片在35、45 ℃热胁迫后,Y(NPQ)显著增加,分别比对照增加了17.1%、37.1%,而经 50 ℃ 热胁迫后又显著减小,相比对照下降了25.7%。
由图7可以看出,天章叶片的Y(NO)在经35、45 ℃热胁迫后没有显著变化,经50 ℃热胁迫后显著增加,为对照的1.8倍;霞红叶片在经45、50 ℃热胁迫后,Y(NO)显著增加,分别为对照的1.3、2.2倍。
2.4热激胁迫处理对天章和霞红叶片表面PSⅡ与PSⅠ激发能分配的影响
在3个温度热胁迫处理后,分配给PSⅠ的激发能α下降,分配给PSⅡ的激发能β上升。由图8可见,天章、霞红叶片在经35、45 ℃热胁迫后,PSⅡ和PSⅠ间的激发能分配不平衡偏离系数β/α-1相比于对照上升,但是上升幅度不大,在经 50 ℃ 热胁迫后,β/α-1显著提高,分别为对照的 4.4、1.9倍。
3讨论
在较短的时间内,叶片温度高出其生长适宜温度10~15 ℃ 时往往会造成热胁迫,导致植物生理代谢紊乱[12]。PSⅡ 对环境胁迫非常敏感,其功能和结构在高温胁迫下会发生一系列变化[13],Fv/Fm表示PSⅡ的潜在量子产量,是植物光合表现的一个敏感指标[14]。本研究发现,不耐热品种霞红在经45、50 ℃处理后的Fv/Fm均显著减小,而耐热品种天章在经50 ℃处理后的Fv/Fm显著减小,与梁雪等对耐热和不耐热大葱Fv/Fm对热胁迫响应的结果[15]一致。表明耐热品种在较高温度胁迫下,可降低热胁迫对PSⅡ反应中心的损伤,有利于维持PSⅡ较高的光化学活性[16]。而热胁迫导致不耐热品种的PSⅡ反应中心受损或失活,抑制了光合作用的原初反应[17]。
光化学反应和热耗散的变化会引起叶绿素荧光淬灭(包括光化学淬灭和非光化学淬灭)过程的相应变化,光化学淬灭与PSⅡ电子传递和初始电子受体QA的氧化还原有关[18]。赵丽丽等对金荞麦在高温下的叶绿素荧光特性研究发现,高温胁迫下金荞麦各种质的qP、Y(Ⅱ)降低[19]。陈梅等在高温胁迫对苋菜叶绿素荧光的影响研究中发现,在40 ℃以上高温胁迫下,上述指标均有所下降[20]。在本试验中不同温度胁迫下,2个品种的qP、Y(Ⅱ)整体上均显著降低,与赵丽丽等的研究结果[19]一致,这进一步证实高温使这2个品种的天线色素光能转换效率和PSⅡ反应中心开放部分的比例明显下降[21],过量的激发能在PSⅡ反应中心积累[22],PSⅡ的QA电子受体的氧化性增强[23],电子传递受到抑制[24]。此外,在qP下降的同时,Y(Ⅱ)也随着下降,这个结果与这2个参数在PSⅡ反应中心相对应的关系一致。天章的qP、Y(Ⅱ)下降幅度较小,说明耐热品种在热激胁迫下的光能捕获与转化能力仍然较强,能够保持较高的光能利用效率,是其对高温具有抗性的光合生理原因[24]。非光化学淬灭是植物体内光合量子效率调节的一个重要方面,反映了植物体可以将过剩的光能以热的形式耗散的部分[25]。在本研究中,霞红叶片在经 35 ℃ 热胁迫后,天章叶片在经45 ℃热胁迫后的NPQ急剧提高。该结果表明,霞红叶片在35 ℃时,天章叶片在45 ℃时的NPQ积极响应,通过调节自身大小而使qP保持在一个稳定的状态,保证CO2固定和电子的传递速率达到一致,将PSⅡ反应中心接受的多余激发能以热形式耗散[26]。此外,本研究结果还表明,35 ℃这个不足以使天章NPQ显著响应的温度已经对霞红产生了显著影响,其NPQ需要立即响应以使qP维持稳定。
当胁迫温度达到50 ℃时,2个杜鹃品种的叶片调节性能量耗散Y(NPQ)减小,而非调节性能量耗散Y(NO)显著增加,与任子蓓等对热胁迫对连翘离体叶圆片光系统Ⅱ活性影响的研究结果一致,说明50 ℃时热耗散不足以将植物吸收的光能完全消耗掉,过剩的光能导致光系统发生光抑制,甚至损坏,反映了热耗散机制从调节性能量耗散为主向非调节性能量耗散为主转换[27]。PSⅡ通常被认为是光抑制的主要位点,且PSⅡ较PSⅠ对热更加敏感[28]。王俊玲等在对番茄果实表面光系统活性的研究中发现,随着胁迫温度的升高,β/α-1提高,热胁迫使2个光系统间的激发能分配出现不平衡,PSⅠ和PSⅡ间的协调性降低[29]。任子蓓等研究发现,随着热胁迫温度增加,连翘离体叶圆片的β/α-1先骤然增大而后又骤然降低[27]。本试验发现,2个杜鹃品种叶片在不同温度胁迫下β/α-1均提高,β/α-1在经50 ℃胁迫后的提高幅度显著高于其他2个温度胁迫后的结果。这个结果与王俊玲等的研究结果[29]一致,与任子蓓等的结果[27]有所差异,可能由于在50 ℃下,对PSⅡ已构成损伤,而这种激发能分配从倾向于PSⅡ而后转向于PSⅠ的現象可能与光合机构的状态转换[30]有关,其具体机制尚待进一步研究。
综上所述,在相同胁迫程度下,不耐热杜鹃品种的叶绿素荧光动力学参数变化幅度明显高于耐热品种,即霞红在45 ℃热胁迫下,其PSⅡ就已经出现明显的光抑制,而天章则是在50 ℃时才出现明显的光抑制。说明在高温下,与霞红相比,耐热品种天章的PSⅡ光能转换效率更高,光合机构的过剩激发能更少,产生活性氧的概率更低,PSⅡ反应中心的开放程度更大,对光合电子传递速率的影响较小,有效地保护了光合机构。
参考文献:
[1]张春英. 杜鹃花的育种发展及现代育种[J]. 山东林业科技,2005(3):77-79.
[2]Zhang H,Liu K,Wang Z Q,et al. Abscisic acid,ethylene and antioxidative systems in rice grains in relation with grain filling subjected to postanthesis soil-drying[J]. Plant Growth Regulation,2015,76(2):135-146.
[3]Gorbe E,Calatayud A. Applications of chlorophyll fluorescence imaging technique in horticultural research:a review[J]. Scientia Horticulturae,2012,138(2):24-35.
[4]Baker N R. A possible role for photosystem Ⅱ in environmental perturbations of photosynthesis[J]. Physiologia Plantarum,1991,81(4):563-570.
[5]薛伟,李向义,林丽莎,等. 短时间热胁迫对疏叶骆驼刺光系统Ⅱ、Rubisco活性和活性氧化剂的影响[J]. 植物生态学报,2011,35(4):441-451.
[6]Guo Y P,Zhou H F,Zhang L C. Photosynthetic characteristics and protective mechanisms against photooxidation during high temperature stress in two citrus species[J]. Scientia Horticulturae,2006,108(3):260-267.
[7]赵冰,张果,司国臣,等. 秦岭野生杜鹃花属植物种质资源调查研究[J]. 西北林学院学报,2013,28(1):104-109.
[8]张长芹,罗吉风,苏玉芬. 六种杜鹃花的耐旱适应性研究[J]. 广西植物,2002,22(2):174-176.
[9]余丽玲. 西洋杜鹃四个品种抗寒性对比研究[D]. 福州:福建农林大学,2014.
[10]张乐华,孙宝腾,周广,等. 高温胁迫下五种杜鹃花属植物的生理变化及其耐热性比较[J]. 广西植物,2011,31(5):651-658.
[11]Braun G,Malkin S. Regulation of the imbalance in light excitation between photosystem Ⅱ and photosystem Ⅰ by cations and by the energized state of the thylakoid membrane[J]. Biochimica et Biophysica Acta-Bioenergetics,1990,1017(1):79-90.
[12]Wahid A,Gelani S,Ashraf M,et al. Heat tolerance in plants:an overview[J]. Environmental and Experimental Botany,2007,61(3):199-223.
[13]陈大印,刘春英,袁野,等. 不同光强与温度处理对‘肉芙蓉牡丹叶片PSⅡ光化学活性的影响[J]. 园艺学报,2011,38(10):1939-1946.
[14]Maxwell K,Johnson G N. Chlorophyll fluorescence—a practical guide[J]. Journal of Experimental Botany,2000,51(345):659-668.
[15]梁雪,颜坤,梁燕,等. 高温对耐热大葱品种PSⅡ和抗氧化酶活性的影响[J]. 园艺学报,2012,39(1):175-181.
[16]吴玉香,魏建康,沈少炎,等. 遮光对西洋杜鹃花期、光合参数、叶绿素荧光参数的影响[J]. 江苏农业科学,2017,45(8):113-116.
[17]Sun Y J,Geng Q W,Du Y P,et al. Induction of cyclic electron flow around photosystem Ⅰ during heat stress in grape leaves[J]. Plant Science,2017,256:65-71.
[18]杨志晓,丁燕芳,张小全,等. 赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响[J]. 生态学报,2015,35(12):4146-4154.
[19]赵丽丽,邓蓉,向清华,等. 高温对金荞麦光合气体交换和叶绿素荧光特性的影响[J]. 草业科学,2015,32(4):560-569.
[20]陈梅,唐运来. 高温胁迫下苋菜的叶绿素荧光特性[J]. 生态学杂志,2013,32(7):1813-1818.
[21]Murata N,Takahashi S,Nishiyama Y A. Photoinhibition of photosystem Ⅱ under environmental stress[J]. Biochimica et Biophysica Acta-Bioenergetics,2007,1767(6):414-421.
[22]Schreiber U,Neubauer C. O2-dependent electron flow,membrane energization and the mechanism of non-photochemical quenching of chlorophyll fluorescence[J]. Photosynthesis Research,1990,25(3):279.
[23]Maxwell D P,Falk S,Trick C G,et al. Growth at low temperature mimics high-light acclimation in Chlorella vulgaris[J]. Plant Physiology,1994,105(2):535.
[24]Hou W,Sun A H,Chen H L,et al. Effects of chilling and high temperatures on photosynthesis and chlorophyll fluorescence in leaves of watermelon seedlings[J]. Biologia Plantarum,2016,60(1):148-154.
[25]Hideg E,Kós P,Schreiber U. Imaging of NPQ and ROS formation in tobacco leaves:heat inactivation of the water-water cycle prevents down-regulation of PSⅡ[J]. Plant Cell Physiol,2008,49(12):1879-1886.
[26]Baker N R. Chlorophyll fluorescence:a probe of photosynthesis in vivo[J]. Annual Review of Plant Biology,2008,59(1):89-113.
[27]任子蓓,王俊玲,史寶胜. 热胁迫对连翘离体叶圆片光系统Ⅱ活性的影响[J]. 林业科学,2015,51(4):44-51.
[28]Anderson J M,Park Y I,Soon W S. Unifying model for the photoinactivation of photosystem Ⅱ in vivo under steady-state photosynthesis[J]. Photosynthesis Research,1998,56(1):1-13.
[29]王俊玲,高志奎,赵飞. 热激胁迫对番茄果实表面光系统活性的影响[J]. 园艺学报,2011,38(4):675-682.
[30]许大全. 光合作用效率[M]. 上海:上海科学技术出版社,2002:23-25.
