重组猪源IFN-λ1 植物乳杆菌的构建与表达验证
2019-08-20付婷婷马彬尧王茂鹏韩继成姜宇航金宁一
付婷婷,马彬尧,王茂鹏,韩继成,许 汪,陈 竞,姜宇航,金宁一,李 昌
(1.扬州大学兽医学院,江苏 扬州225009;2.军事医学研究院军事兽医研究所,省部共建吉林省人兽共患病预防与控制重点实验室,吉林 长春130122;3.温州大学病毒学研究所,浙江 温州325000)
干扰素(Interferon,IFN)是一类干扰病毒复制和感染产生的细胞因子。根据生物学活性可分为3类,Ⅰ型是由病毒诱导白细胞和纤维母细胞产生的α 和β 干扰素;Ⅱ型是由病毒诱导淋巴细胞产生的γ 干扰素;Ⅲ型干扰素(也称为IFN-λs 或IL-28/29)是2003 年发现的新类型,在结构和遗传上同IL-10家族成员相似,但显示Ⅰ型IFN 样活性,主要通过JAK-STAT 信号通路,发挥抗病毒、抗肿瘤和免疫调节作用[1-2]。目前人源Ⅲ型干扰素有IFN-λ1、IFNλ2、IFN-λ3 和IFN-λ4,鼠源Ⅲ型干扰素包含IFN-λ2和IFN-λ3,猪源Ⅲ型干扰素仅有IFN-λ1 和IFN-λ3两种被克隆和表达[3-4]。Lin Li 等发现,猪源IFNλ1 主要作用于肠黏膜上皮细胞并表现强大的抗病毒活性,对PEDV 感染具有较强的抑制作用[5]。Lan F 等发现,IFN-λ1 有利于健康鼻黏膜中金黄色葡萄球菌的清除,并通过IFN-λ1-IL-28R-ROS-JAK-STAT信号通路增强巨噬细胞的抗菌功能[6]。IFN-λs 受体表达主要在上皮细胞,包括表皮、呼吸道和胃肠道上皮细胞。相对于Ⅰ型干扰素,Ⅲ型干扰素由于其受体(IFN-λs)的靶向优势,其引起的副作用相对较小。另外,IFN-λs 是黏膜、上皮组织中抗病毒反应的重要介质,并且对GI 上皮的保护至关重要,可能是靶向黏膜感染的潜在抗病毒治疗剂,同时也在黏膜免疫中发挥重要作用[7-8]。
乳酸菌(Lactic acid bacteria,LAB)作为一种被公认为安全(Generally regarded as safe,GRAS)的益生菌,在生物医学LAB 应用方面,包括LAB 佐剂、免疫刺激剂和治疗药物递送系统。其中植物乳杆菌对肠道上皮细胞的粘附作用有助于在肠道定植,抑制病原菌在肠道定植和增强植物乳杆菌与肠道细胞之间的信号交流。近年来,乳杆菌作为基因工程菌逐渐受到广泛应用。如干酪乳杆菌表达PEDV的N 蛋白[9],罗伊氏乳杆菌表达霍乱弧菌的CTB 蛋白[10]。本试验基于植物乳杆菌作为表达异源蛋白的优势菌,选用植物乳杆菌Lp18 表达含植物乳杆菌锚定信号肽(1320 信号肽)的猪源IFN-λ1 基因,选择乳球菌NZ3900 作为克隆中间宿主;再使用植物乳杆菌Lp18 作为表达宿主菌构建表达猪源IFN-λ1的重组菌,为猪源IFN-λ1 的开发应用奠定理论基础。
1 材料与方法
1.1 试剂、菌株 质粒DNA 小量提取试剂盒、Bioflux 凝胶回收试剂盒,购自苏州康宁生命科技有限公司;MRS、M17 培养基,购自海博生物公司;His单抗、HRP 标记抗鼠二抗和FITC 标记抗鼠二抗,购自Protein 公司;Clone Express Multis One Step Cloning Kit 和Phanta Max Super-Fidelity DNA Polymerase,购自Vazyme 公司;诱导肽SppIP 于南京金斯瑞生物科技公司合成;植物乳杆菌Lp18、乳酸乳球菌NZ3900 由本实验室保存;pSIP411 载体由山东大学祁庆生教授赠予;含优化的pIFN-λ1 基因由本实验室合成并保存。
1.2 引物设计及合成 根据GenBank 中基因序列(FJ455508.1),利用Primer5.0 软件设计引物和用于扩增基因序列,引物pIFN-λ1-F 和pIFN-λ1-R 用于扩增IFN-λ1 序列,片段长度为650 bp;通用引物SF 和SR 用于筛选阳性菌落;引物由吉林省库美生物科技有限公司合成。引物信息见表1。
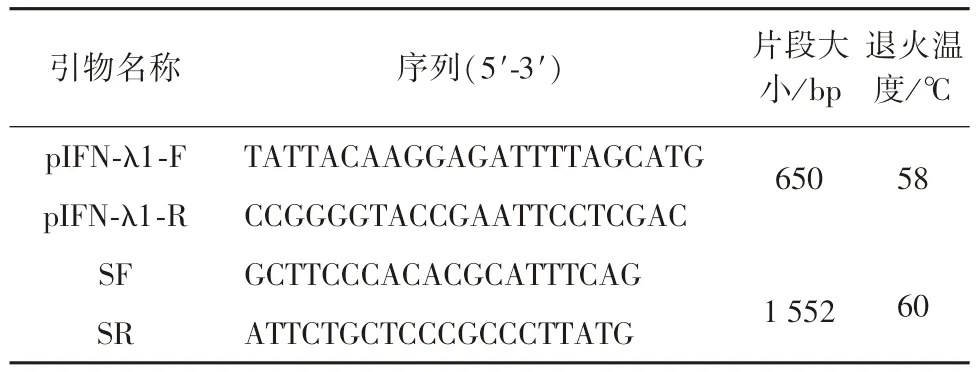
表1 引物序列
1.3 pIFN-λ1 基因的扩增 以本试验保存的pIFNλ1 基因为模板,进行PCR 扩增。反应体系:KOD Plus 0.5 μL、模板1 μL、引物pIFN-λ1-F 和pIFN-λ1-R 各1 μL、10×Buffer 2.5 μL、dNTPs 2.5 μL、MgSO41 μL、ddH2O 补足25 μL。反应条件:95 ℃2 min,58 ℃30 s,72 ℃1 min,共30 个循环。扩增产物经1%琼脂糖凝胶电泳鉴定,并按照胶回收试剂盒进行回收产物。
1.4 重组菌表达质粒的构建及鉴定 采用无缝克隆技术将1.3 的胶回收产物连接到pSIP411 载体中,电转化到克隆宿主乳球菌NZ3900 中,涂布于(红霉素浓度为25 mg/L)的M17 固体平板上,30 ℃培养过夜;挑取单个菌落用通用引物SF 和SR 进行克隆PCR 检测,验证正确后送至公司测序。提取正确的重组表达质粒再次电转入植物乳杆菌Lp18,涂布于(红霉素浓度为25 mg/L)的MRS 固体平板上,37 ℃培养过夜;挑取单个菌落用通用引物SF 和SR进行克隆PCR 鉴定。
1.5 重组植物乳杆菌的诱导表达 挑取阳性重组植物乳杆菌Lp18:pSIP-pIFN-λ1 及植物乳杆菌Lp18分别1%接种于MRS 液体培养基(红霉素浓度为25 mg/L),当OD 值为0.3 ~0.5 时,添加SppIP(浓度为50 μg/L),继续培养10 h。4 000 r/min 离心收集菌体,用PBS 清洗用以去除MRS 培养基,再用PBS 重悬菌体。加入玻璃珠使用研磨机进行研磨,收集蛋白液体,-80 ℃保存备用。
1.6 重组植物乳杆菌表达产物的Western Blot 鉴定 取-80 ℃保存的蛋白液体适量,加入5×SDS-PAGE Loading Buffer 混合均匀,沸水煮6 ~8 min。12%SDS-PAGE 电泳后,通过半干式转膜转印PVDF 膜上用于Western Blot 分析:5%脱脂乳室温封闭3 h,PBST 洗3 次;1∶5 000 His 标记抗鼠一抗进行4 ℃过夜孵育,PBST 洗3 次;HRP 标记的抗鼠二抗孵育1 h,PBST 洗3 次;ECL 显影观察并拍照。
1.7 外源基因表达条件的优化 为获得植物乳杆菌表达最佳的pIFN-λ1 蛋白,进行重组植物乳杆菌不同表达条件的摸索。选择不同诱导时间的优化,在2 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h 时间点进行制备蛋白样品,对其进行Western Blot 检测。
1.8 外源基因表达的免疫荧光分析 1%重组植物乳杆菌接种于液体MRS 培养基中(红霉素浓度为25 mg/L),培养10 h 后收集菌体用等量PBS 洗2遍。一抗用含1∶50 的鼠源Anti-His 标签抗体孵育过夜,PBS 清洗5 遍,FITC 标记的二抗1∶200 孵育2 h,PBS 清洗5 遍。进行制片,油镜下观察外源基因的表达情况。
1.9 外源基因表达的流式细胞分析 1%重组植物乳杆菌接种于液体MRS 培养基中(红霉素浓度为25 mg/L),培养10 h 后收集菌体用等量PBS 洗2遍。一抗用含1∶50 的鼠源Anti-His 标签抗体孵育过夜,PBS 清洗5 遍,FITC 标记的二抗1:200 孵育2 h,PBS 清洗5 遍。取适量PBS 重悬菌体用于流式细胞仪。
2 结果
2.1 目的基因的扩增与鉴定 PCR 扩增产物pIFNλ1 片段经1%琼脂糖凝胶电泳鉴定,获得了1 条约650 bp 的特异条带,与预期大小相符合(图1)。
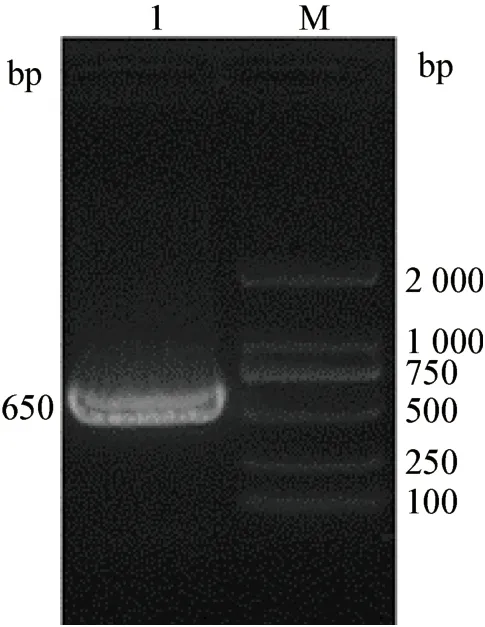
图1 pIFN-λ1 基因PCR 扩增产物
2.2 重组表达质粒的构建与鉴定 通过无缝克隆技术构建含有pIFN-λ1 的重组质粒Lp18:pSIPpIFN-λ1(图2),将该质粒电转入克隆宿主菌乳球菌NZ3900 后,在含有红霉素抗性的平板上挑取多个单克隆,提取阳性质粒送公司测序鉴定。经公司测序正确后,重组质粒再次电转入表达宿主菌植物乳杆菌Lp18 中,挑取3 个单克隆进行菌液PCR 鉴定。1%琼脂糖凝胶电泳可见1 552 bp 目的条带,与预期相符合(图3)。表明重组质粒成功电转入植物乳杆菌Lp18 中,验证正确的重组植物乳杆菌命名为Lp18:pSIP-pIFN-λ1。
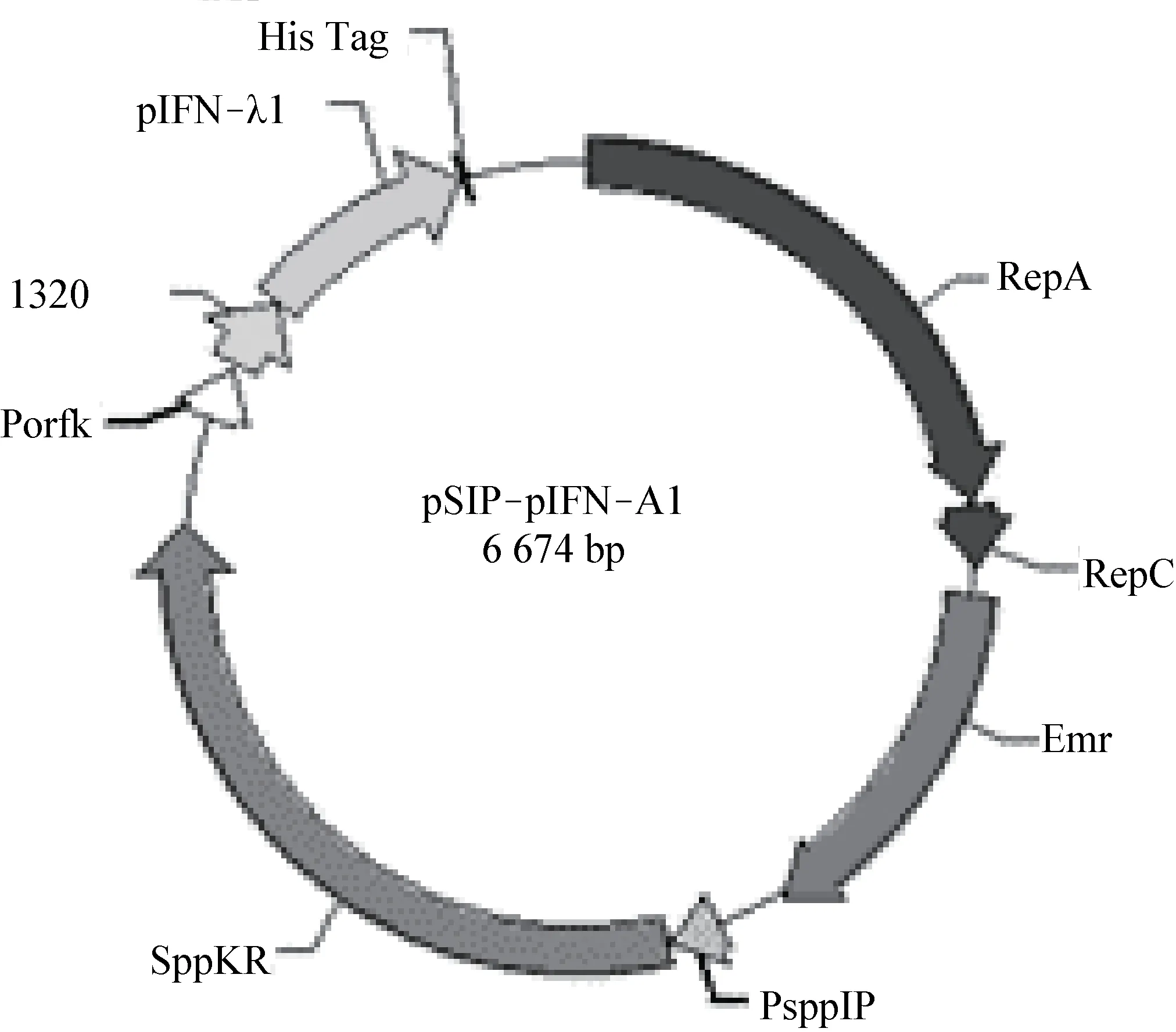
图2 重组质粒pSIP-pIFN-λ1 示意图
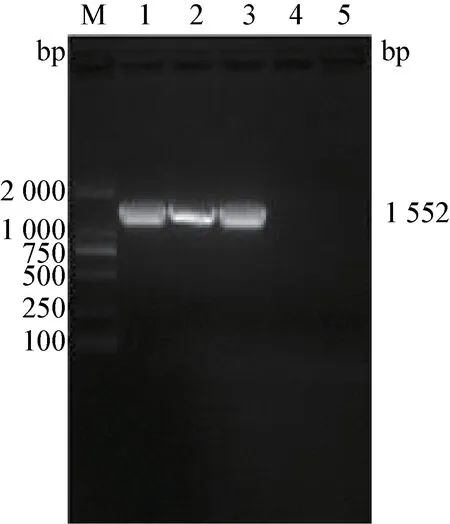
图3 重组植物乳杆菌Lp18:pSIP-pIFN-λ1 的验证
2.3 外源基因表达的Western Blot 鉴定 将鉴定正确的重组植物乳杆菌进行诱导表达,加入SppIP(50 μg/L)诱导剂,再继续培养10 h,植物乳杆菌Lp18 作为对照。结果表明,重组植物乳杆菌中未加诱导剂的蛋白中均未检测到蛋白条带,而重组pIFN-λ1 的植物乳杆菌加诱导剂可见27 kDa 左右的特异性条带(图4),表明pIFN-λ1 基因在植物乳杆菌Lp18 中成功表达。
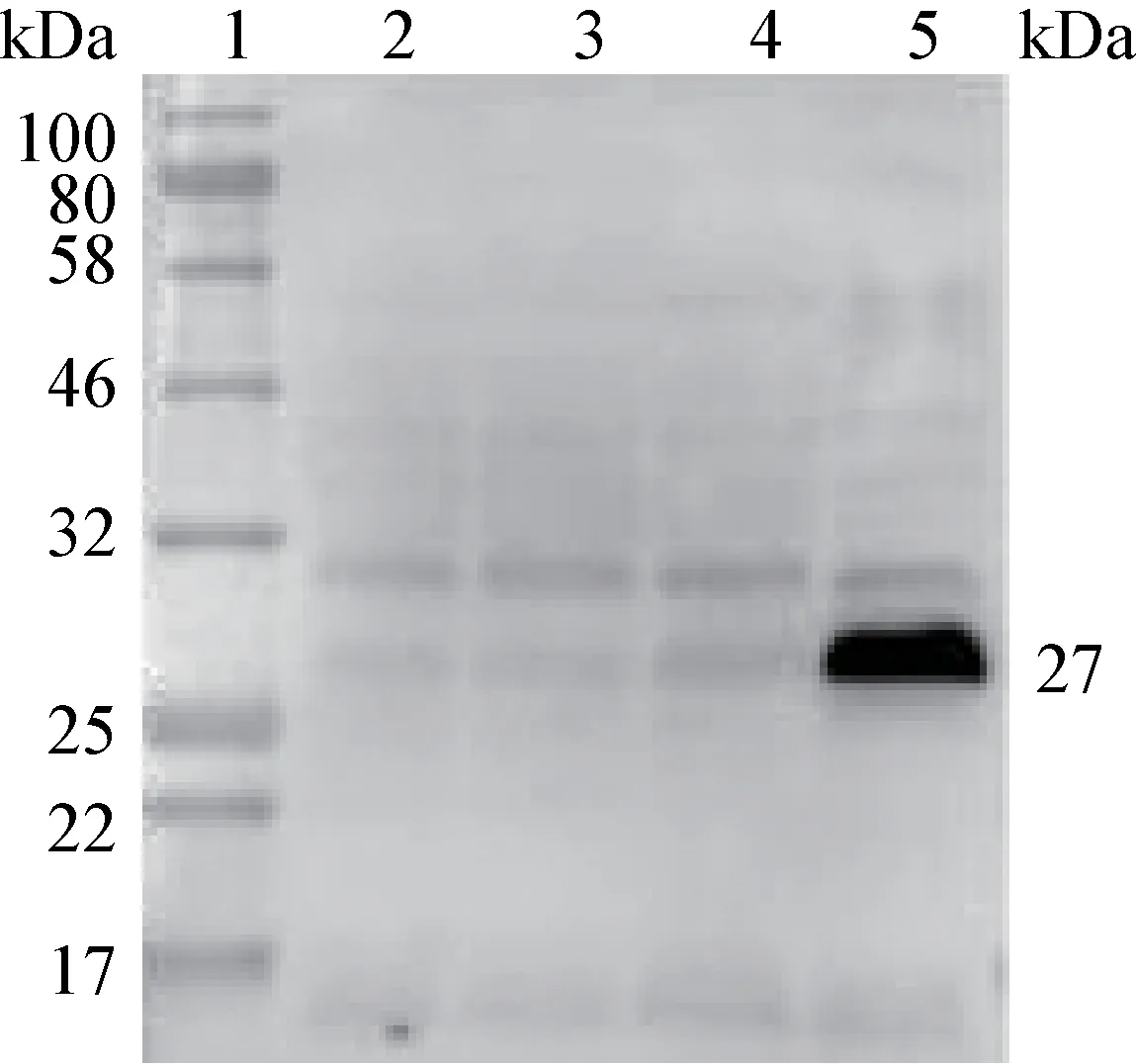
图4 Western Blot 检测pIFN-λ1 蛋白在重组植物乳杆菌Lp18 中的诱导表达
2.4 外源基因表达时间的确定 为了更好的进行外源基因的表达,对重组植物乳杆菌Lp18:pSIPpIFN-λ1 诱导表达时间进行了确定。结果如图5 所示,由图可以看出,重组蛋白在4 h 就开始表达,且随着重组植物乳杆菌培养时间的延长,重组蛋白的表达随之提高,在18 h 时可持续表达,根据成本与时间,我们在后期研究中选用12 h 表达的蛋白进行相关研究。

图5 Western Blot 检测不同时间点对重组蛋白pIFN-λ1
2.5 外源基因表达的免疫荧光分析 通过免疫荧光,对表达的外源蛋白进行鉴定。由图6 可知植物乳杆菌Lp18 未见荧光,而重组植物乳杆菌Lp18:pSIP-pIFN-λ1 可见单个菌体荧光,进一步表明目的基因能够在植物乳杆菌Lp18 中表达,而且表达的外源基因可以展示到乳杆菌表面。
2.6 流式细胞分析 通过流式细胞术对植物乳杆菌Lp18 和重组植物乳杆菌Lp18:pSIP-pIFN-λ1 进行鉴定分析。 由图7 可知植物乳杆菌Lp18 为4.31%,重组植物乳杆菌Lp18:pSIP-pIFN-λ1 的阳性率为22.96%。
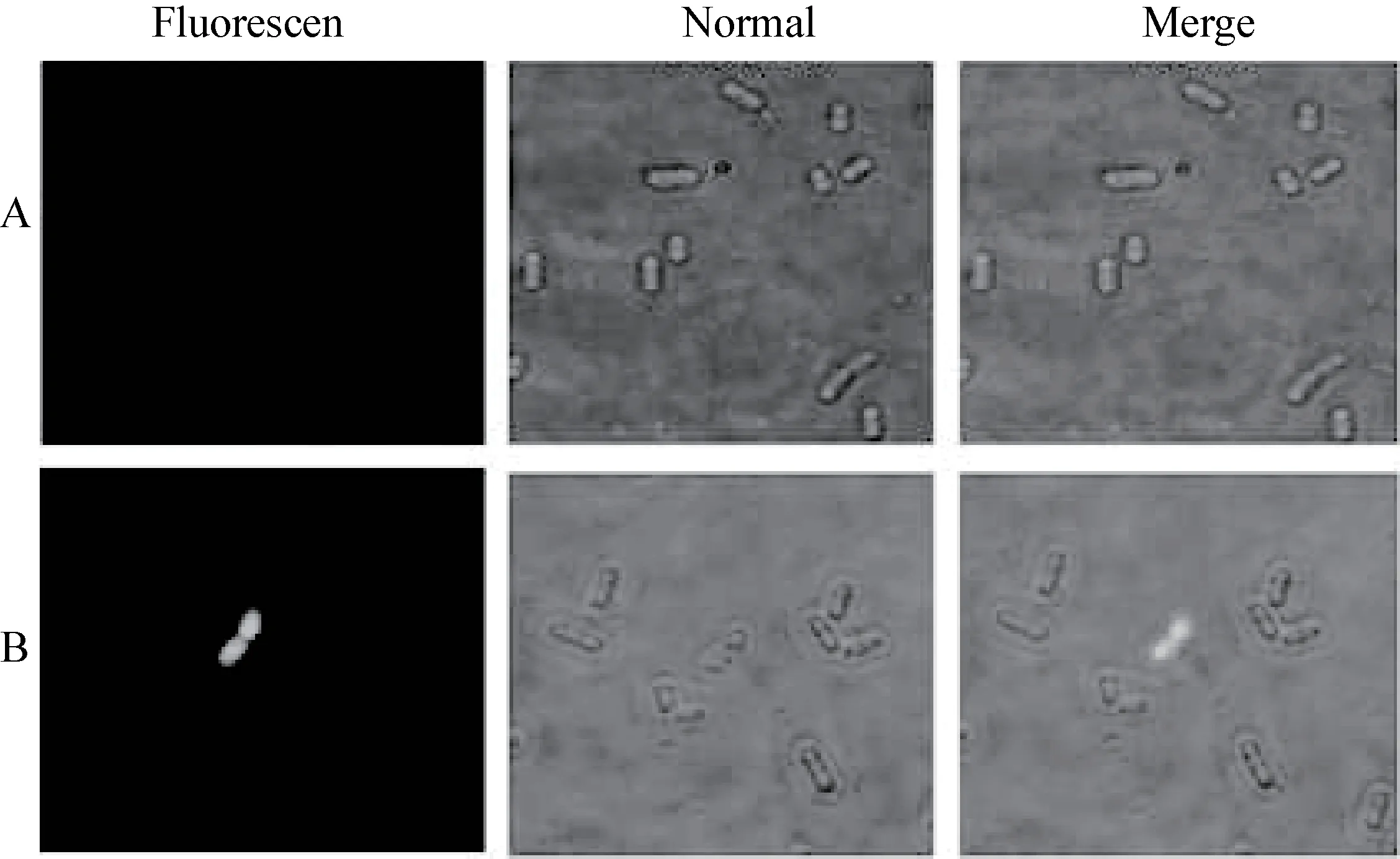
图6 免疫荧光鉴定重组菌表面表达
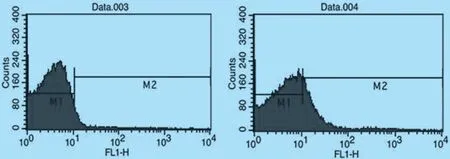
图7 流式分析重组菌表达
3 讨论
Ⅲ型干扰素作为一种黏膜型细胞因子在黏膜表面显示出广谱的抗病毒作用[11],是一种非常具有前景的临床应用细胞因子。目前人源IFN-λ1 已应用于抗病毒和抗肿瘤且有上市治疗产品[12],因此对于猪源IFN-λ1 的抗病毒黏膜作用有待深入研究。
植物乳杆菌作为基因工程菌具有天然优势:较强的肠道上皮细胞的定植能力和粘附能力,对肠道黏膜免疫具有调节作用。因此植物乳杆菌作为基因工程菌表达异源蛋白近几年来逐渐被应用,Yang等利用植物乳杆菌递送FaeG-DCpep 融合抗原,并在小鼠中评估免疫应答反应[13],Fredriksen 等利用植物乳杆菌表面表达侵袭素细胞外结构域(D1-D5,D4-D5)来增加植物乳杆菌的促炎性质,并且当与细胞培养物中的单核细胞相互作用时,重组菌是NFkappaB 的有效激活剂[14]。刘永仕等利用植物乳杆菌NC8 表达猪源IFN-λ3,且重组菌显著抑制PEDV在IPEC-J2 中的复制和ISGs 的高表达[15]。Lin Li等表明,pIFN-λ3 表现出比pIFN-λ1 更强效或至少相似的抗病毒活性对于特定肠上皮细胞中。猪源IFN-λ3 和IFN-λ1 仅有54.2%氨基酸相似性[16]。目前,并未见植物乳杆菌表达猪源IFN-λ1 蛋白的报道。
Karlakas 和Sorvig 等证实了优化pSIP 表达系统能够高效表达异源蛋白[17-18],Wang 等使用植物乳杆菌表达pSIP411-VP1 重组质粒,也证实了pSIP411表达载体的高效性[19]。因此本研究选用高粘附性的宿主菌Lp18,通过优化pSIP411 表达载体及表达蛋白基因,成功表达猪源IFN-λ1 蛋白。通过1320信号肽将异源抗原表达于细胞表面,荧光检测结果证明了其表面展示能力,这有助于刺激机体的免疫反应。丰富植物乳杆菌表达异源蛋白的可行性和为研究不同猪源IFN-λs 提供理论基础。本研究通过摸索不同条件的表达情况来确定最佳的表达量,随着时间增长IFN-λ1 蛋白表达量越高。优化的重组植物乳杆菌表达蛋白结合pIFN-λ 的抗黏膜病毒作用,可增强抗病毒效果。本研究成功构建了一株稳定表达的重组植物乳杆菌具有潜在黏膜免疫应用价值,为猪源IFN-λ1 的开发应用研究提供理论基础。
