血清淀粉样蛋白A联合腺苷脱氨酶在自身免疫性肝炎的价值分析
2019-08-19贾铭丽汪云
贾铭丽 汪云
自身免疫性肝炎(autoimmune hepatitis,AIH)的患病率约为15/10万,可发生于任何年龄,但40岁以上者多见[1]。AIH病理检查最大的局限性是其自身具有的有创性,导致部分患者不愿意接受检查而漏诊。血清淀粉样蛋白A(serum amyloid protein A,SAA)主要用以评估急性相反应程度[2]。近年发现巨细胞动脉炎患者血清SAA可有慢性升高,特别是在评估巨细胞动脉炎中具有潜在价值[3]。腺苷脱氨酶(adenosine deaminase,ADA)属核酸代谢酶。近期,Torgutalp等人[4]研究指出,ADA水平与AIH肝脏组织活动性积分呈正相关。本研究收集AIH患者及健康人群血液样本检测SAA和ADA,并对AIH患者进行16到60个月的随访,报道如下。
资料与方法
一 、研究对象
纳入2012年1月至2016年1月期间病理确诊AIH共64例为病例组,诊断标准符合《自身免疫性肝炎诊断和治疗共识》[5]。收取我院确诊的非自身免疫性肝炎患者68例为非自身免疫性肝炎组,包括乙型肝炎病毒性肝炎40例,阿米巴性肝炎10例,与酒精性肝炎18例。收取同期来我院健康体检者78例为正常对照组。从患者入院开始对纳入的64例AIH患者进行随访,截止至2017年1月,随访时间为16到60个月。本研究经医院伦理会批准。
二、临床资料采集
由专业人员对所有纳入对象的年龄、性别、ALT、AST、GGT、TBil水平及AIH患者界面性肝炎轻重程度等临床资料进行采集。AIH患者界面性肝炎轻重程度以肝组织学为依据[5],分为轻度界面性肝炎43例,中度界面性肝炎13例,重度界面性肝炎8例,标准如下:轻度:局部或少数门管区破坏;中度:小于50%的门管区或纤维间隔破坏;重度:大于50%的门管区或纤维间隔破坏。
三、临床样本采集与检测方法
分别使用EDTA抗凝采血管和含促凝剂采血管抽取研究对象静脉血2 mL和10 mL,进行血常规(中国迈瑞公司BC-5000血球仪)、生化(美国贝克曼库尔特公司AU5800生化仪)等指标的检测。血清SAA的检测采用胶乳比浊法(美国贝克曼库尔特公司AU5800生化仪);血清ADA的检测采用谷氨酸脱氢酶偶联速率法(美国贝克曼库尔特公司UniCel DxI 800分析仪)。质控品均采用英国朗道公司高、低值质控品,质控判断标准为Westgard多规则分析。
四、 统计学分析

结 果
一、 临床基本信息三组之间的年龄、性别、GGT和TBil水平差异均无统计学意义(P>0.05)。与正常对照组相比,病例组与非自身免疫性肝炎组ALT和AST水平显著增高(P<0.05),见表1。
二、 研究对象血清SAA和ADA水平比较
三组研究对象血清SAA和ADA水平,见表2。与非自身免疫性肝炎组和正常对照组相比,病例组血清SAA和ADA水平均增高(P<0.05)。血清SAA和ADA水平在非自身免疫性肝炎组与正常对照组之间无显著差异(P>0.05)。
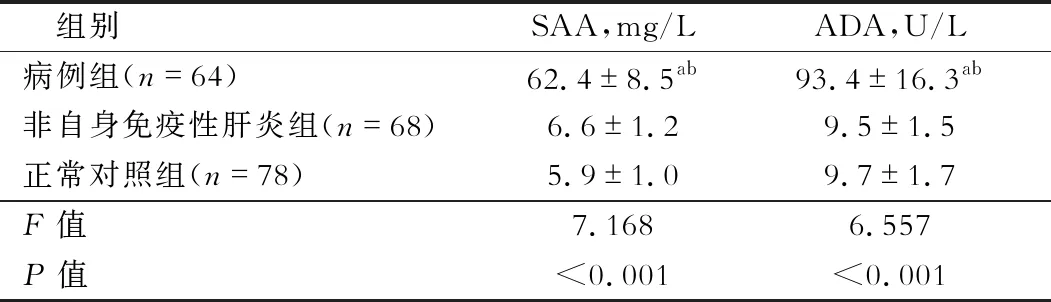
表2 研究对象血清SAA和ADA水平
注:a:非自身免疫性肝炎组相比,P<0.05;b:与正常对照组相比,P<0.05
三、 血清SAA和ADA水平与AIH各指标的关系
如表3所示,AIH患者血清SAA和ADA均与界面性肝炎程度(SAA:r=0.587,P<0.001;ADA:r=0.602,P<0.001)呈正相关。而其他临床特征分组如年龄、性别等中,各组血清SAA和ADA水平的差异均无统计学意义(P>0.05)。

表1 研究对象的临床基本信息
注:a:与正常对照组比较,P<0.05

表3 血清SAA和ADA水平与AIH临床病理特征间的关系
注:n:例数;AIH:自身免疫性肝炎;SAA:血清淀粉样蛋白A;ADA:腺苷脱氨酶
四、 血清SAA和ADA对AIH鉴别诊断的ROC曲线分析
血清SAA和ADA鉴别AIH和非AIH(非自身免疫性肝炎组及正常对照组)的AUC分别为0.692(95%CI:0.615~ 0.769,P<0.001)和0.833(95%CI:0.775~ 0.891,P<0.001);对应的灵敏度/特异度分别为:63.4%/68.3%和62.6%/93.3%;对应的临界值分别为:43.8 mg/L和75.1 U/L。运用logistics回归模型将上述SAA和ADA这2个指标(变量)拟合后得到的新的变量—“PRE-1值”,而后将“PRE-1值”带入ROC曲线进行分析,发现当联合血清SAA和ADA在鉴别AIH和非AIH的AUC为0.899(95%CI:0.853~ 0.944,P<0.001),灵敏度为80.9%,特异度为91.7%,见图1。
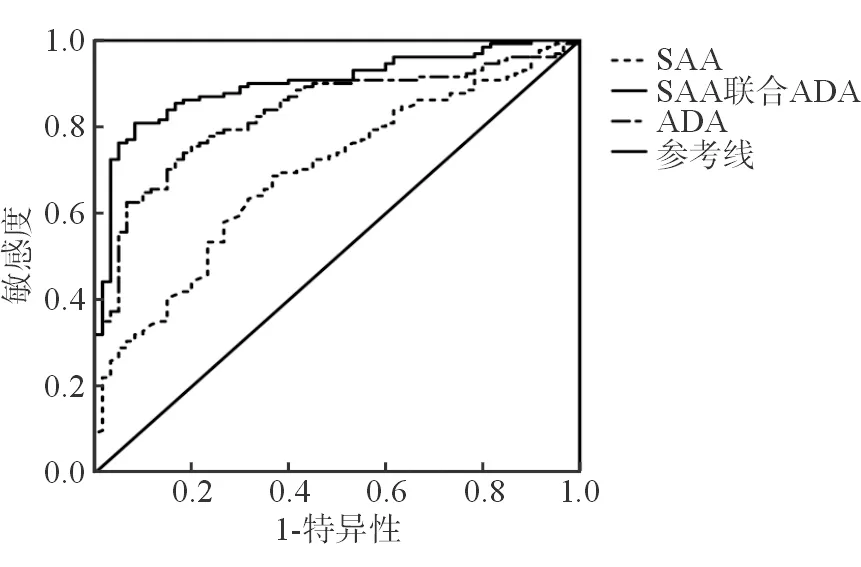
图1 血清SAA和ADA对AIH鉴别诊断的ROC曲线分析
五、血清SAA和ADA与AIH患者预后的相关性分析
对AIH患者进行随访,并评估血清SAA和ADA水平与AIH患者的总体生存期的相关性。64例AIH患者依据SAA和ADA水平的中位数分别被分为高SAA与低SAA组、高ADA与低ADA组。同低SAA组相比,高SAA组患者的生存时间显著降低(log-rankP=0.023,图2A);同低ADA组相比,高ADA组患者的生存时间也显著降低(log-rankP=0.005,图2B)。Cox分析显示界面性肝炎程度、SAA及ADA的表达水平是影响AIH患者生存期的危险因素,如表4所示。
讨 论
AIH患者的肝脏组织学表现为慢性炎症的持续活动,如果不能及时、早期的进行干预则极有可能发展至肝硬化[6]。因此,提高AIH检出率至关重要。本研究发现,与非自身免疫性肝炎组及正常对照组相比,AIH患者血清SAA和ADA水平均显著增高。SAA是评估机体急性相反应程度的重要生物学指标,其在提示机体氧化应激状态下所引起的炎症反应方面具有较高的灵敏度,已在脓毒症等疾病中有所研究报道[7]。郑志方等[8]在对95例肾病综合征患者的研究中发现,SAA在对肾病综合征患者诊断及预后评估中价值显著,特别是对肾炎型肾病患者其临床价值高于hs-CRP及降钙素原。本次研究我们证实AIH患者血清SAA水平升高,提示SAA在AIH疾病进程中也发挥重要作用。ADA是评估肝细胞受损的敏感指标,在重症肝炎发生胆酶分离时,尽管ALT不高,而血清ADA水平却能明显升高;既往研究已经指出腺苷是一种重要的内源性抗炎分子,而ADA水平的增高会降低体内腺苷水平从而诱发机体炎症反应的加剧[9]。土耳其的一项研究者指出,血清ADA水平与AIH患者肝脏组织活动性炎症积分呈正相关[4],而我们的研究发现AIH患者血清SAA和ADA均与界面性肝炎程度呈正相关,与Torgutalp等[4]的研究结果相一致,提示SAA和ADA异常表达参与AIH疾病的发生发展中。

注:A图示高SAA与低SAA组间的生存分析比较;B图示高ADA与低ADA组间的生存分析比较

表4 预后因素的Cox比例风险模型
通过ROC曲线进一步分析显示,血清SAA和ADA鉴别AIH和非自身免疫性肝炎组及正常对照组时具有较高的价值,两者的灵敏度/特异度分别为63.4%/68.3%和62.6%/93.3%;当联合血清SAA和ADA在鉴别AIH和非自身免疫性肝炎组及正常对照组的灵敏度显著提高达到80.9%,而特异度为91.7%,提示血清SAA和ADA具有较高的诊断价值。最后,我们本次研究首次对SAA和ADA在AIH中的预后评估价值进行了分析,发现高SAA组和高ADA组的生存时间均显著低于低SAA组和低ADA组,提示AIH患者血清SAA和ADA水平在评估患者预后中也具有较好的价值。而经过Cox风险评估发现,SAA及ADA的表达水平是影响AIH患者生存期的危险因素。本研究仍然存在如下不足:(1)本次研究我们仅获取了64例AIH患者的临床数据和随访资料,因此我们的结论有待今后更大样本量的研究来进一步论证;(2)本次研究所收集的AIH患者均来自于我院,可能会对研究结果造成一定的偏倚,有待多中心临床研究对结果进一步验证。
综上,通过本次实验我们发现血清SAA和ADA在AIH诊断及评估患者预后中具有重要的临床意义,有望为AIH患者的诊疗及预后改善提供新的途径与思路。
