机器人辅助腹部骶骨固定术的研究进展
2019-08-19刘畅杨盼盼张傢钧刘翠萍倾丽梅王晓慧
刘畅,杨盼盼,张傢钧,刘翠萍,倾丽梅,王晓慧
盆腔器官脱垂(pelvic organ prolapse,POP)主要是指子宫、阴道前后壁及其相邻器官(膀胱或直肠)向下移位。POP的治疗与管理是多模式、多学科的,这就要求临床医生熟悉所有可用策略的优缺点,并且根据个体特征给予最优治疗策略[1]。POP患者的手术方式从经阴道缝合修补发展到经腹骶骨固定术(abdominal sacrocolpopexy,ASC)。随着微创技术的发展,腹腔镜骶骨固定术(laparoscopic sacrocolpopexy,LSC)以微创、复发率低、治愈率高及网片相关并发症低等优点被广泛认可。2004年Di Marco等[2]首次在机器人辅助下完成阴道骶骨固定术。2005年,美国食品药品监督管理局(FDA)批准达芬奇手术系统用于妇科手术。目前矫正POP的方式众多,提供最佳的功效性、安全性和耐久性组合是一个新的目标[3]。已证实,与传统腹腔镜手术相比,机器人辅助骶骨固定术(robotic-assisted sacrocolpopexy,RASC)具有失血少、内部恢复快、补片暴露风险小的优点,同时在术后短中期保持与ASC等效的脱垂支持,但远期疗效及成本效益仍有争议[4]。本文主要对RASC修复POP的手术技术、现状及展望进行综述。
1 术前评估
术前评估是对患者脱垂症状的治疗方式进行讨论,包括对保守治疗措施以及各种外科修复风险、益处和替代方案的讨论。术前评估完毕后患者必须详细了解自己的治疗方案。
1.1 病史 患者的病史不仅包括就诊前的妇科手术史,还要着重询问脱垂的症状、有无尿失禁和泌尿系统疾病。若既往无子宫切除术史,则应根据患者年龄及个人意愿决定是否切除子宫。此外,应详细询问有无任何功能失调性子宫出血或异常宫颈细胞学涂片病史,并根据情况完善宫颈细胞学及宫腔镜检查。
1.2 分度及评估 根据2016年国际妇科泌尿协会(IUGA)/国际尿控协会(ICS)关于女性POP术语的联合报告行POP-Q分度[5]。评估患者有无压力性尿失禁,从而可以选择在脱垂修复的同时进行抗尿失禁手术。此外,还应评估患者耐受气腹和陡峭特伦德伦伯格卧位的能力。
2 患者体位
RASC在安置镜头及套管针前需要将患者双腿充分外展外旋,以容纳第二辅助外科医生和机器人手术车,然后调整患者体位为特伦德伦伯格卧位(倾斜角度为30°)以使肠管远离骨盆区域,套管安置完毕后调整为低特伦德伦伯格卧位(倾斜角度大于45°)。因此患者的手臂及肩部周围可进行适当地填充和固定,以避免任何神经损伤及术中体位的滑动[6]。另外,还需要行阴道手术或抗尿失禁手术的患者,其会阴部应突出床外足够远,但不超过10 cm[7]。
3 手术辅助技术
3.1 套管位置
3.1.1 传统套管位置 机器人镜头位置通常在脐部切口,并且镜头端口位置和耻骨联合之间的距离约为16~18 cm。若距离过大,则机器人器械可能无法到达骨盆;若距离较小,则影响医生对骶骨岬角解剖操作。端口放置通常以“W”配置执行,脐部切口放置直径12 mm相机套管,左侧在与脐水平线下夹角30°距相机套管8~10 cm处放置2个机器人辅助套管端口(直径8 mm),右腹部区域放置1个机器人套管(直径8 mm/12 mm),并在右侧肋下区根据需要放置一个直径5 mm的套管针,辅助外科医生将其用于引入缝线和抽吸、冲洗。所有端口应至少间隔9 cm,以确保足够的空间用于机器人对接和防止手臂碰撞[6](见图1)。
3.1.2 机器人单孔硅质端口 通常经脐部皮肤创建垂直的2.5 cm切口,向下打开至腹膜水平,并安置大小合适的切口保护器,以便在手术的最后过程中移除组织。通过切口保护器的开口插入第三代达芬奇手术机器人(Si)Single-Site的硅质端口,随后插入直径8.5 mm插管,将其插入镜头并定位于子宫底。调整患者体位为特伦德伦伯格卧位并向右侧结肠侧倾斜使右侧结肠缩回,以便于解剖骶前空间。将两根长度为250 mm(直径10 mm或5 mm)的弯曲套管与直径5 mm(根据需要替换直径10 mm)附件套管针插入剩余3个硅质端口,并将单极钩和双极钳分别通过弯曲套管放置。
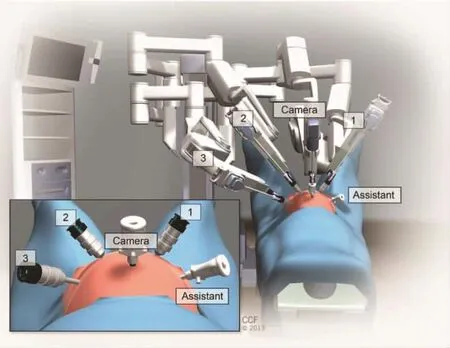
图1 RASC端口放置与旁侧对接机器人[6]
3.2 单点腕式针头驱动器(Single-Site Wristed) 常规LSC是一种需要多次进出缝合且缝合技术难度较大、时间较长的一类手术。随着机器人操作平台系统的不断开发,Lee[8]首次报道在达芬奇手术机器人平台使用单点腕式针头驱动器,使需要进行多次腹腔镜缝合和打结的各种手术技术得以简化并明显缩短手术时间,不仅为机器人手术提供优势,还可以为患者提供单端口手术的美容优势。而且第四代达芬奇手术机器人(Xi)已经步入临床,各国也逐渐加大对单孔腹腔镜手术机器人系统的研发力度,相信不久单孔手术机器人就会出现在大众面前。
3.3 V-Loc倒刺缝合线 近些年,可吸收缝合线广泛应用于RASC中固定阴道和骶韧带,并在中期随访中证实使用可吸收缝线治疗是有效的[9]。Liu等[10]研究发现V-Loc缝合线使倒钩在组织内自锚定,防止缝合线的反向运动,在缝合过程可以保持均匀的组织网张力,并且由于切口边缘缝合牢固,不仅促进切口的愈合,也使发生隐匿性血肿的可能性减小,还可减少操作者的学习曲线。延迟可吸收缝合线的一般吸收时间大约为180 d,这为组织愈合和瘢痕形成提供了足够的时间。但目前为止,关于其有效性的长期随访并没有相关文献报道,临床应用仍需根据病情选择合适的缝合线以及网片缝合方式。
4 手术技术
4.1 骶骨岬解剖 通过机器人第三臂及第一辅助外科医生将小肠及结肠拨至左上腹区域,充分暴露骶骨岬。第一辅助外科医生帮助识别骶骨岬并将机器人的机械臂及镜头安置到恰当的位置,然后识别出骨盆缘的乙状结肠内侧和搏动的髂动脉侧。暴露骶骨岬的过程尤其注意左侧髂总静脉,因为它比髂总动脉更靠近操作区,可能在暴露期间损伤。一旦确定了骶骨岬,便用单极剪刀切开表面覆盖的腹膜,暴露缝合相对安全区,通常认为S1椎体盆腔面的前纵韧带为骶骨固定术的相对安全缝合区域(上界为骶骨岬下10 mm,下界为骶骨岬下方40 mm,水平宽度为15 mm)。此外,距离S1椎体盆腔面最近的大血管为右髂内静脉,手术中应注意避免损伤[11]。在解剖过程中应注意避免损伤任何骶骨浅表血管,如果出血,可以将气腹压力增加至20 mmHg(1 mmHg=0.133 kPa)对出血区域施加直接压力进行压迫止血,或用可吸收缝合线缝合出血点。当以上方法都不能有效止血时,可用骶前止血钉或骨锚控制骶前区域的持续出血[12]。但是,如果机器人镜下不能有效止血,则应进行开放性手术。
4.2 建立隧道 将覆盖骶骨岬的腹膜在中线垂直切开,暴露出下面的腹膜后间隙。隧道切口通常建立在骶骨上方2~3 cm处,在骶骨和左右髂动脉分叉处建立隧道切口也较常见。根据特征性蠕动识别右侧输尿管并外推,以防输尿管损伤,隧道沿乙状结肠方向向内侧延伸,充分暴露前纵韧带和中骶部血管,识别下腹部神经,尽量减少可能导致内脏功能障碍和疼痛的神经损伤。然后通过向前钝性分离和扫拨运动来创建隧道,在腹膜后腔内创建空间。完成后的隧道位于直肠右侧和右侧输尿管之间。与传统打开后腹膜的方式相比,隧道的建立使在骶骨前纵韧带上缝合固定时更容易调节和维持网状张力,减少操作时间和黏附形成[13]。
4.3 网片的固定 通常单极内切器放置在第一个机械臂上,双极电凝器放置在第二个机械臂上,持钩放置在第三个机械臂上。将子宫底部用持钩抓住,在宫颈水平的两侧阔韧带上各开一个2~3 cm的“窗”,让T型/Y型网片通过。然后在双侧阔韧带切口处向前切开至前腹膜,打开膀胱子宫腹膜反折,将膀胱腹膜下推约2~3 cm,实现子宫、宫颈及膀胱腹膜的分离,形成膀胱和子宫颈前段、阴道前壁之间的平面。同样的位置采用同样的方法切开后腹膜,在子宫颈后段和腹膜之间形成一个平面。根据盆腔器官前壁脱垂的程度,可在子宫颈或阴道前壁的位置将T型/Y型网片的两个短端由后向前穿过之前在阔韧带两侧创建的“窗”并缝合固定,也可以将网片远端包裹在子宫体和后壁周围进行缝合固定,网片尾部通过隧道固定在骶骨韧带上。
5 RASC的现状
随着年龄、肥胖以及分娩等多种危险因素的增加[14],到2050年POP甚至将成为影响46%成年女性的常见疾病[15]。美国一项流行病学研究表明,美国成年女性患病率为12.9%,估计80岁前女性因压力性尿失禁或POP而接受手术的终生风险为20.0%[16],三分之一的女性甚至需要再次手术[17]。对于患者来说首要治疗目标是提高生活质量,因此临床医生应平衡恢复阴道支持的效果和特殊干预后潜在的并发症,并结合患者的个人期望、合并症、生活方式以及对潜在风险的承受能力进行个体化治疗。
传统LSC的主要限制因素为二维视觉和缝合技术繁杂,而RASC为医生提供了高倍的手术视野以及三维立体结构的可视化骨盆,而且其配套技术不断更新,配合使用精细仪器在深骨盆进行解剖及缝合,可以完成诸多复杂手术。与ASC和LSC相比,RASC是一种安全有效的治疗方法,术中失血量更少,住院时间更短,网片侵蚀等并发症发生风险小,患者接受度高,虽然存在初始手术时间较长的弊端,但随着手术学习曲线的改善,尤其是当需要多次缝合时,手术时间会显著缩短[18]。目前RASC短期及中期的主观和客观效果均较满意,其术后发生继发性脱垂等并发症的风险仍需大量长期随访研究[19]。Jong等[20]通过对RASC手术史的患者进行回顾性研究并随访3~7年发现,RASC在患者满意度、功能改善、解剖成功率等方面具有良好、稳定的远期效果,表明RASC在治疗有症状的POP上具有耐久性。2016年,我国Li等[13]首次进行RASC临床效果研究得出相同结论。
RASC的主要劣势为机器固有成本及维护成本昂贵,这也是开展随机临床研究的主要障碍。患者的手术费用大约是传统腹腔镜手术的4倍,主要是因为机器人手术费用不在国家医疗保险报销范围内[21]。而且机器人手术在POP的学习曲线早期比传统腹腔镜手术花费的时间更长,并且在初始学习阶段无法充分利用机器人的人体工程学及技术优势[22]。由于需要精确的患者定位以及机器人的对接和解除对接,也无形中增加了操作时间[6]。此外,也有个别短期研究表明RASC和ASC在手术成功率、症状改善、住院时间和解剖恢复方面无显著差异,RASC甚至会造成术后疼痛的增加和住院时间的延长[4,23]。
6 结语
综上所述,RASC不但具有失血少、内部恢复快、补片暴露风险小等优点,而且其术后短中期修复效果与ASC相当。虽然存在兴起时间短及高成本的限制,但是机器人辅助加上优秀的手术医师,并结合不断更新的配套技术,会逐渐克服一些缺点,不仅可以完成长期疗效已经确定的手术,还可以实现切口美观等其他需求。尽管RASC的研究证据尚不支持将其称为最优治疗方式,需要结合更多高质量的长期研究及术后随访,但其对许多女性来说是一个较优的选择。
