精子在体外两种培养液获能的实验比较研究*
2019-08-19梁晓东骆强翔张伟明莫淦文郭江华廖勇彬
梁晓东,骆强翔,张伟明,莫淦文,郭江华,廖勇彬
(江门市中心医院a.生殖医学诊疗中心;b.病案科,广东江门 529000)
辅助生殖实验室在胚胎培养时需要各种不同种类的培养液,这些培养液的质量好坏直接影响到辅助生殖技术的成功率。其中所使用的精子培养液,是在精子优化分离后添加的精子悬浮液,由于它能影响受精结局,有必要通过性能评估实现实验室试剂的质量控制。目前评估的方法主要是精子存活试验,这个试验是通过观察精子在不同时间点精子的活力来分析精子培养液质量的方法。然而,精子活动能力只是评价的一个方面,更重要的是受精过程中培养液是否能使精子获能或顶体反应等环节得到最大的发挥。能否通过检测获能环节相关的标记物的改变来反映培养液质量呢?现已知道,精子获能伴有膜胆固醇外流的现象,最终使脂筏结构重新分布[1-2],从而使脂筏结构内单唾液酸四己糖神经节苷脂(GM1)的位置改变。GM1是分布于细胞膜上的一种富含唾液酸的鞘糖脂,是构成脂筏结构的重要成分,可通过分析GM1的位置改变反映精子获能相关膜脂筏结构的改变[3]。由于GM1能与霍乱毒素B亚基(CTB)发生迅速结合,只要把荧光素标记在霍乱毒素B亚基上,就可以对精子膜上的GM1进行定位染色检测[4-5]。本研究将尝试用CTB对精子膜进行染色,并且从不同时间点对不同培养基精子的染色结果进行计数检测,探讨提供精子功能环境所适合的精子培养液。
1材料与方法
1.1 研究对象 男性精液样本来自于本中心日常做精液检查的患者。简单了解男方职业和不良生活史等信息后,选取非高温环境工作、没有不良生活史患者留取的精液标本。只有完全液化的且高于WHO第五版精液检查的正常参考值的精液标本才纳入本研究中。所有患者均知情同意并经医院伦理委员会批准。
1.2 试剂和仪器
1.2.1 试剂:密度梯度离心液选用CooperSurgical公司的PureCeptionTM(40/80)(REF ART-2040,ART-2080),Vitrolife IVF plus培养液购自Vitrolife公司,Quinn’s HTF精子培养液(REF ART-1020)购自CooperSurgical公司,精子标记染色液采用Thermofisher公司的CTB-AlexaFluor 488连接物(REF C22841),固定液多聚甲醛来自于北京索莱宝生物有限公司。
1.2.2 仪器:计算机辅助精液分析系统(西班牙Microptic公司)和Nikon 80i荧光显微镜(日本Nikon公司)。
1.3 方法
1.3.1 精液采集:精液标本留取当天要求禁欲3~5天,采用手淫法取精且收集到无毒的容器内。
1.3.2 精液分析:精液标本待其完全液化后按照WHO第五版精液检查的操作规程测量精液量、精子浓度、精子活力及形态。
1.3.3 精液处理:采用不连续的密度梯度离心法分离精子,精子洗涤后分别用Quinn’s HTF培养液和Vitrolife IVF plus培养液重悬。然后再次分析处理后的精子浓度与活力。把精子浓度调整成(5~10)×106/ml后分别把两种培养液中精子悬液分装成5份,置于37℃,5%(v/v)CO2培养箱中获能培养。于0,4,6,8和10 h五个时间点分别把精子悬液取出,进行GM1的定位染色。
1.3.4 精子膜GM1的定位染色:参照MOODY等[6]的方法。基本步骤为:先把精子悬液离心去上清,用2 g/dl多聚甲醛于37℃固定15 min,用磷酸盐缓冲液(PBS)洗涤三次后,再次调整精子浓度为20×106/ml左右,然后加入等体积的50×10-6g/ml的CTB-Alexa Fluor 488连接物染色15 min。染色结束以后再次使用PBS洗涤三次,重悬精子沉淀物并涂片。使用荧光显微镜在激发波长492 nm,发射波长520 nm滤光片下观察分析染色结果,再按照MOODY等[6]的方法对至少200条精子进行分类计数,计算顶体区有荧光的精子百分率(AA%)。
2结果
2.1 精液样本的总体情况分析 符合条件的精液样本共有48份,其中:精液量为3.7±1.6 ml,精子浓度为(58.75±7.88)×106/ml,精子活动率(前向运动加非前向运动百分率)为(51.55±15.62)%,精子形态正常率为(6.04±2.31)%。
2.2 精子膜GM1的定位染色 染色结果见图1。其中顶体前区(AA)发出绿色荧光信号的是已获能的精子(图1黑色箭头),而精子头部没有荧光信号的是非获能精子(图1白色箭头),与MOODY等[6]的研究结果一致。

(40×,激发波长492 nm,发射波长520 nm)
2.3 两种培养液之间GM1染色结果的分析比较 各时间点精子的活动率和AA%见表1和图2。从图2可以看出,AA%随着时间延长而升高,表明获能精子随着时间的延长而增加,而两种培养液曲线基本接近。把测量时间作为重复因子,培养液分组作为主体,使用混合效应模型进行分析,结果显示两种培养液之间的AA%差异无统计学意义(t=0.096,P=0.923)。
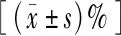
表1 两种培养液在不同时间点的精子活动率与AA%结果比较
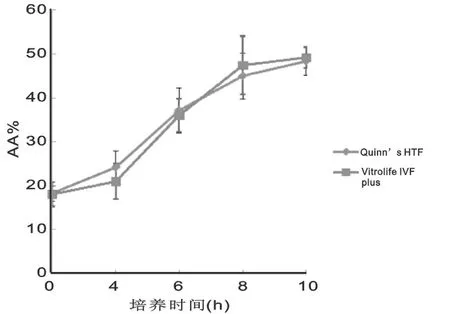
图2 不同时间点两种培养液的AA%
3讨论随着宫腔内人工授精技术和常规体外受精技术在辅助生殖领域的广泛应用,人们对于技术中所使用培养液的质量越来越重视。培养液的好坏直接关系着妊娠结局和实验室的质量控制结果。在这些辅助生殖技术中,精液处理过程是其中重要的一环,当中所用的精子培养液可以提供精子超激活运动中的能量需要,因此目前对于精液培养液在维持精子活动方面的评判,主要通过在不同的培养时间点分析精子活力或者精子运动轨迹参数来进行[7]。而在另一方面,这些培养液还具有在体外条件下使精子发生获能的功能,以进一步为精卵的结合提供环境[8]。故此研究者更关心的可能是精子受精能力的获得及精子功能的发挥等对精卵融合的直接影响因素。GM1在精子获能时重新定位的现象,为我们提供了一种研究工具用于评估精液培养液在发挥精子受精功能方面的作用。先前已经有学者报道使用这一工具对比了几种商品化的精子培养液,发现各种培养液在促进精子功能方面的不同[9]。由于我中心生殖实验室经常使用Vitrolife IVF plus培养液和Quinn’s HTF培养液作为精子维持液,故此研究中使用了这两种培养液来比较,结果说明两种培养液均能提供发挥受精功能的环境,但这一结论仍需要生殖实验室的各种胚胎培养数据的支持和结合实际受精情况综合分析[10]。
本研究在对比两种培养液的实验过程中采用了CTB结合染色法,主要基于GM1能与CTB能发生迅速结合的原理,但这种方法的关键是如何确定精子GM1在获能条件和非获能条件下的分布定位。MOODY等[6]选取了凝集素受体作为参照,对每一条精子使用CTB与花生凝集素(PNA)对精子进行双染色,证实获能精子的GM1分布于顶体区。在本研究中,GM1在获能条件下的定位染色结果与MOODY等[6]基本一致。另外,人类精子膜有着很高的胆固醇/磷脂的比例,故人类精子中需要较长的时间才可以获能。这个时间跟使用的诱导物也有关系,实验室常用的培养液中的诱导物来源于清蛋白[11-12],而添加清蛋白的培养液中至少要6 h才开始观察到获能现象的出现[13]。在本研究中,从4 h开始观察不同时间点的顶体区有荧光信号的精子百分率(AA%),发现AA%随时间延长而增加,表明获能精子的数量逐渐增加。
一项有效的功能检测技术应当与临床诊断相关性好,能指导辅助生殖技术的使用策略,而且方法简单可行。对于不孕不育原因和辅助生殖技术结局的分析,传统的精液参数如精子浓度、形态等显然已经不能满足临床的需要,亟待开发新的精子功能分析项目,如精子DNA碎片检测等对精子发生、受精等过程出现的异常寻找男性不育的病因和指导辅助生殖技术的选择策略[14]。而精子受精功能分析凭借其能在体外模拟精卵结合环境的优势被日益重视,在众多评估手段中使用CTB检测精子GM1定位的方法是一项独立于传统精液参数又能用来分析男性不育的病因的技术[15]。过去人们基于获能现象及其信号传导途径的认识,逐渐发展出以蛋白质酪氨酸磷酸化的方法来检测精子获能。这种方法要做免疫印迹,耗时较长,而使用CTB的荧光素结合物来检测获能的方法简单,耗时短,花费少[16],这些优点有望成为一项易于推广的精子功能分析的检测技术。
综上所述,本研究建立了使用CTB检测精子GM1定位的方法并以其对比分析了两种不同培养液中精子获能情况,为进一步研究培养液对临床结局的影响及该方法的临床价值打下了基础。
