镉暴露对背角无齿蚌鳃和消化腺的氧化应激
2019-08-17井维鑫林子根
井维鑫,林子根,郎 朗,刘 娜,王 茜,王 兰
(山西大学生命科学学院,山西太原030006)
镉(Cd)主要毒性形式是镉离子(Cd2+),是淡水水生态系统中广泛和长期存在的、具有致癌作用的重金属污染物[1-2]。在我国多个湖泊(尤其是东部和中部湖泊)沉积物中,Cd 污染程度达到中度到重度,其潜在的生态风险系数最高[3]。Cd2+与钙离子(Ca2+)等必需金属离子竞争进入细胞[4],可以诱导细胞内活性氧(ROS)的生成[5]。当机体内形成的ROS过多时,可导致细胞损伤,破坏细胞结构与功能,并诱导细胞凋亡或细胞坏死[1]。
软体动物双壳类由于种类、数量较多,广泛分布于世界范围内江河湖海之中,直接与水体和沉积物接触,且运动能力弱,还具有低代谢率、高滤水率和抗逆性强等特点[6],是较理想的水体中Cd 等重金属污染的监测生物[5]。研究发现,当贝类受到重金属暴露时,其抗氧化系统可以起到消除ROS 的作用,可防止或减轻氧化损伤的发生[7],对环境污染起到早期预警作用[8]。
背角无齿蚌(Anodonta woodiana)在我国分布广泛[9],具有改善水质的作用和较高的经济价值[10],其生长速度快,适应能力强,作为“淡水贝类观察”的指示生物,用于监测和评估淡水环境Cd 等重金属污染[11-12]。目前,就Cd2+致背角无齿蚌急性毒性的研究虽已有报道,但大多数检测生物标志物的种类不超过4 种[9,13-15],且单个或少数几个抗氧化酶的测定,不足以说明完全的抗氧化防御[16-17]。鳃和消化腺是双壳类动物Cd2+暴露的重要靶器官[18],在以往研究中,同时分析这2 种组织相关生物标志物也较为少见[19],且不同试验条件对生物标志物有不同的影响,很难准确评估生物标志物的敏感性和指示性[16]。
本研究用亚慢性Cd2+暴露背角无齿蚌,检测鳃和消化腺中7 种生物标志物的变化,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽硫转移酶(GST)、抗氧化剂谷胱甘肽(GSH)、总抗氧化能力(T-AOC)和脂质过氧化产物丙二醛(MDA),旨在筛选出用于淡水环境Cd污染监测与评估的生物标志物,为背角无齿蚌作为“淡水贝类观察”的指示生物积累相关的研究资料。
1 材料和方法
1.1 试验材料
背角无齿蚌购于山西太原五龙口水产品批发市场。购回后置于实验室内,用曝气48 h 的自来水清洗,去除蚌体表面附着物及泥沙等杂质,而后在实验室条件下(水温(14.65±0.31)℃,溶解氧(9.75±0.26)mg/L,pH 值8.34±0.12)饲养28 d。前14 d 不喂食,后14 d 投喂小球藻(每只每天喂食3.5×104个)。
1.2 主要试剂
氯化镉水合物(CdCl2·2.5H2O)(分析纯),上海阿拉丁生化科技股份有限公司;30%过氧化氢(H2O2)(分析纯),天津市天力化学试剂有限公司。SOD、CAT、GPx、GST、GSH、MDA 和T-AOC 测试盒均购于南京建成生物工程研究所。
1.3 试验方法
1.3.1 试验设计 根据96 h Cd2+的LC50(134.9 mg/L)[15]设置Cd2+质量浓度为2.698 mg/L,进行Cd2+暴露,试验设4 个平行。选取大小相近的背角无齿蚌(20 只)置于聚丙烯塑料饲养箱(72 cm×52 cm×44 cm)内,染毒液体积为20 L。每2 d 换水一次,每天喂食一次。试验过程中未发现死亡个体。
1.3.2 样品制备 在Cd2+暴露0(CK),7,14,21,28 d,随机选取4 只蚌,解剖取鳃和消化腺,用滤纸吸净组织表面水分,迅速称质量后用液氮速冻,保存于低温冰箱(-80 ℃)备用。以预冷的PBS 缓冲液在冰上制备20%的组织匀浆液,2 800 r/min 4 ℃离心10 min,取上清,用于各生物标志物的测定。
1.3.3 测定方法 SOD、CAT、GPx、GST、GSH、MDA和T-AOC 的测定均按照试剂盒说明书进行操作。试验中吸光度的测定均通过多功能酶标仪(SpectraMax M5,美国MD 公司)进行检测。
1.4 数据处理
以Excel 2010 和SPSS 20.0 软件对试验数据进行处理与分析,对各组间数据进行单因素方差分析并应用Tukey HSD 方法比较显著性差异(P<0.05)。试验结果用“平均值±标准差”表示,以GraphPad Prism 6 进行柱状图的绘制。
2 结果与分析
2.1 镉对背角无齿蚌脂质过氧化产物MDA 的影响

背角无齿蚌经Cd2+暴露后,鳃MDA 含量随暴露时间的延长而逐渐升高,除在7 d 与对照组间无显著差异外,其余各组均显著高于对照组(P<0.05)。消化腺MDA 含量虽有升高的趋势,但与对照组比较均无显著差异(图1)。
2.2 镉对背角无齿蚌抗氧化酶SOD、CAT、GPx和GST 活性的影响
背角无齿蚌经Cd2+暴露后,鳃SOD 活性与对照组相比均显著降低(P<0.05),且随暴露时间的延长表现出先降低后升高的趋势,并在21 d 达到最低值,为对照组的71%。消化腺SOD 活性在Cd2+暴露14,28 d 显著高于对照组(P<0.05),分别是对照组的1.3 倍和1.2 倍(图2)。
背角无齿蚌鳃和消化腺CAT 活性的变化如图3 所示。经Cd2+暴露后,鳃CAT 活性与对照组相比均显著降低(P<0.05)。消化腺CAT 活性除7 d 外,均显著高于对照组(P<0.05),且随着暴露时间的延长表现出先升高后降低的趋势,在21 d 达到最高值,是对照组的1.7 倍。



背角无齿蚌鳃GPx 活性在Cd2+暴露14 d 显著 低于对照组(P<0.05);消化腺GPx 活性除在14 d与对照组间无显著差异外,其余暴露时间均显著高于对照组(P<0.05)。鳃和消化腺GPx 活性变化随Cd2+暴露时间的延长均表现出先降低后升高的趋势,都在14 d 达到最低值(图4)。
Cd2+暴露后,背角无齿蚌鳃GST 活性表现出先升高后降低的趋势,除在28 d 与对照组相比无显著差异外,其余暴露时间均显著高于对照组(P<0.05)。消化腺GST 活性表现出先降低后升高的趋势,在7,28 d 均显著高于对照组(P<0.05)(图5)。

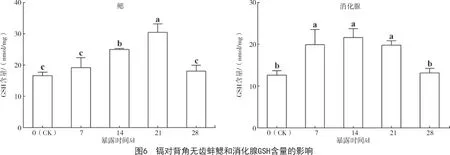
2.3 镉对背角无齿蚌抗氧化剂GSH 含量的影响
Cd2+暴露后,背角无齿蚌鳃和消化腺GSH 含量高于对照组。鳃GSH 含量在14,21 d 显著高于对照组,且在21 d 达到最高值,是对照组的1.8 倍。消化腺GSH 含量除在28 d 与对照组间无显著差异外,其余暴露时间均显著高于对照组(P<0.05),并在14 d 达到最高值,是对照组的1.7 倍(图6)。
2.4 镉对背角无齿蚌T-AOC 水平的影响
背角无齿蚌鳃T-AOC 水平随Cd2+暴露时间的延长而逐渐升高,并在28 d 达到最高值且显著高于对照组(P<0.05)。消化腺T-AOC 水平则表现出先升高后降低的趋势,在21 d 达到最高值且显著高于对照组(P<0.05)(图7)。

3 讨论
在正常条件下,机体内ROS 的生成和清除是动态平衡的[1,5]。当重金属等外界环境胁迫因素作用时,机体产生大量的ROS,过量ROS 的积累破坏了这种平衡状态[5],导致蛋白氧化、脂质过氧化和DNA损伤[17]。MDA 是脂质过氧化的重要产物,可以反映生物体受ROS 攻击的程度[20],是脂质过氧化和氧化应激的重要生物标志物[21]。许多研究发现,双壳类动物经Cd2+暴露后,机体内MDA 的含量升高[8,18,22]。但也有文献报道,经Cd2+暴露后,淡水双壳类Pyganodon grandis 消化腺[23]和太平洋牡蛎(Crassostrea gigas)鳃[24]MDA 含量无显著变化。本研究中,背角无齿蚌经Cd2+暴露后,鳃MDA 含量在14,28 d 显著高于对照组,而消化腺MDA 含量却与对照组无显著差异。表明鳃受到的氧化损伤更大,或消化腺应对Cd2+暴露的抗氧化能力更强[8]。
生物体的抗氧化系统(包括抗氧化酶和非酶抗氧化剂)可以清除多余的ROS[7],以保护生物体免受氧化损伤[5]。SOD 和CAT 是对抗氧化应激的第一道防线[1]。SOD 广泛存在于有机体中,可将超氧阴离子(O2-·)转化为过氧化氢(H2O2)[7],随后被CAT 和(或)GPx 分解[5,8]。研究发现,SOD、CAT 和GPx 在抗氧化防御上具有一定的协同性[17,25]。本研究也发现,鳃和消化腺的SOD、CAT 和GPx 活性呈现一致性的结果,这3 种抗氧化酶活性在鳃中均表现出不同程度的抑制,而在消化腺中则表现出不同程度的诱导。有文献报道,背角无齿蚌经Cd2+暴露24~96 h,鳃SOD 和CAT 活性被诱导,GPx 活性无显著变化[15];葡萄牙牡蛎(Crassostrea angulata)经Cd2+暴露28 d,鳃SOD、CAT 和GPx 活性被抑制[26]。本研究中,背角无齿蚌鳃SOD、CAT 和GPx 活性均被抑制,表明经过较长时间的Cd2+暴露后,鳃可能聚集了大量的ROS,使得SOD 过度消耗[17]。也有可能是Cd2+改变了SOD 的空间构象,造成SOD 活性的降低[14]。除此之外,Cd2+也会对SOD 基因表达造成影响,从而使其酶活性降低[14]。而SOD 活性的降低也使其歧化反应产物H2O2减少,导致CAT 和GPx 没有被激活。Cd2+可结合GPx 前体,使GPx 的合成受到抑制[27],也可结合GPx 的活性部位(Se-Cys),使GPx 失活[28]。据文献报道,葡萄牙牡蛎经Cd2+暴露28 d,消化腺SOD活性无显著变化、CAT 活性被抑制、GPx 活性被诱导[26];背角无齿蚌经Cd2+暴露72 h,消化腺SOD 和CAT 活性被诱导[14];文蛤(Meretrix meretrix)经Cd2+暴露5 d,消化腺SOD 和CAT 活性被诱导,GPx 活性被抑制[22]。本研究中,背角无齿蚌消化腺SOD、CAT 和GPx 活性被诱导,表明Cd2+暴露后,当大量的Cd2+被转运至消化腺并诱导其产生了大量O2-·,促使机体启动抗氧化系统,诱导SOD 活性升高,以保护机体免受损伤[14]。同时,机体内H2O2也由于SOD活性的升高而增多[29],促使机体内CAT 和GPx 活性升高,从而清除过量的H2O2[30]。Cd2+暴露28 d,CAT活性稍有降低,但仍显著高于对照组,同时GPx 活性继续升高,这也充分说明二者共同清除H2O2,起到保护机体的作用[7]。
GST 是一种Ⅱ相解毒酶[17],也是一种重要的抗氧化酶[19],可催化Cd2+与GSH 的巯基(-SH)偶联,形成复合物GS-Cd 进行解毒[7]。GSH 是一种三肽,是维持水生生物氧化还原平衡的主要抗氧化剂[7],可以直接清除ROS[8],同时也是GST 和GPx 催化解毒反应的共同底物[17]。有研究报道,背角无齿蚌经Cd2+暴露96 h,鳃GST 活性表现为抑制—诱导,GSH 含量显著低于对照组[19]。本研究中,鳃GST 活性均表现为诱导,但GSH 含量显著高于对照组。随Cd2+暴露时间的延长,鳃SOD、CAT 和GPx 活性均表现为抑制—恢复,而GST 和GSH 则表现为诱导—恢复。同时,鳃GST 与GPx 活性在Cd2+暴露14~28 d呈明显的负相关。说明一方面在SOD、CAT 和GPx活性受到抑制时,GST 和GSH 代偿性的发挥了抗氧化作用[25];另一方面,GST 与GPx 也在争夺共同的反应底物GSH[17]。鳃GSH 含量和GST 活性随暴露时间延长的变化趋势均是升高—降低,这可能说明鳃GSH 主要用作GST 反应底物,而不是用来清除ROS。另外有研究发现,背角无齿蚌经Cd2+暴露96 h,消化腺GST 活性被诱导[19],菲律宾蛤仔(Ruditapes philippinarum)经Cd2+暴露48 h,消化腺GST活性被抑制[31];背角无齿蚌经Cd2+暴露96 h[19],文蛤经Cd2+暴露5 d,消化腺GSH 含量显著低于对照组[22]。本研究中,消化腺SOD、CAT、GPx 和GST活性均表现为诱导,GSH 含量也显著高于对照组,GST 与GPx 活性呈正相关。这表示消化腺中这些抗氧化酶(剂)被共同调动抵抗Cd2+暴露带来的氧化损伤。随Cd2+暴露时间的延长,消化腺GST 活性变化趋势为诱导—恢复—诱导,GSH 含量的变化趋势是升高—降低。这可能表明,消化腺GSH 除了给GST 和GPx 作为反应底物,同时也直接参与ROS清除。消化腺是双壳类动物的重要解毒器官,Cd2+可从体内其他器官转运至消化腺[32],产生较多的ROS导致GSH 大量消耗[8]。
T-AOC 是反映机体内抗氧化酶和抗氧化剂共同的抗氧化能力,也是监测水体重金属污染的重要生物标志物[16]。背角无齿蚌经Cd2+暴露24~96 h,鳃T-AOC 表现为持续升高,消化腺先升后降[33],这和本研究中T-AOC 的变化趋势一致。鳃T-AOC 的不断增强,表示其正积极对抗Cd2+暴露带来的氧化损伤。Cd2+暴露28 d,鳃SOD 等抗氧化酶活性和GSH 含量与对照组相比无显著升高,表明鳃可能也通过过氧化物酶(POD)、金属硫蛋白(MT)等其他抗氧化酶(剂)抵抗Cd2+作用。SOD 等抗氧化酶在Cd2+暴露28 d 仍保持较高的活性,这可能说明消化腺其他抗氧化酶(剂)受到明显的抑制。而消化腺T-AOC 在28 d 的降低,可能预示着随着Cd2+暴露时间的延长,消化腺氧化损伤的程度将加重。
背角无齿蚌经Cd2+暴露后,鳃和消化腺抗氧化指标的不同表现主要是由组织特异性所导致的[1]。双壳类软体动物具有多片鳃,与水直接接触,可以反映短期内镉污染状况[34]。而消化腺与哺乳动物的肝脏类似,具有解毒的重要生理功能,是中长期Cd2+暴露的靶器官[41]。同时,在应对Cd2+暴露,消化腺比鳃的能力更强[8,17]。本研究中关于MDA 的试验结果也证明消化腺受到的氧化损伤更小。
4 结论
本研究结果表明,背角无齿蚌经Cd2+暴露后,鳃和消化腺共同应对Cd2+暴露带来的氧化损伤。其中,鳃SOD、CAT 和GPx 活性受到抑制,GST 和GSH 代偿性的发挥抗氧化作用;消化腺SOD、CAT、GPx、GST 和GSH 均受到诱导。消化腺比鳃的抗氧化能力更强,受到的氧化损伤也更小。另外,对比各生物标志物与对照组的差异,鳃SOD 和CAT 的敏感性和指示性最强,消化腺CAT 在Cd2+暴露中后期、GSH 在Cd2+暴露中前期的指示性较好,可用作指示水体Cd2+污染的生物标志物。
