高直链淀粉玉米的研究进展
2019-08-16鲁守平陈波张晗菡刘霞孟昭东张华穆春华
鲁守平 陈波 张晗菡 刘霞 孟昭东 张华 穆春华
摘要:高直链淀粉玉米是指籽粒直链淀粉占总淀粉含量55%~85%的特用玉米,它在抗性食品、包装材料、医疗保健和降解材料等多个产业中占有重要地位。本研究在介绍直链淀粉用途的基础上,综述了玉米直链淀粉合成关键基因、检测方法和高直链淀粉种质创制、选育及存在问题。
关键词:直链淀粉;玉米;研究进展
中图分类号:S513-1 文献标识号:A 文章编号:1001-4942(2019)06-0169-06
Abstract High amylose corn refers to the special corn with 55%~85% amylose content of seed total starch. It plays an important role in many industries such as resistant food, packaging materials, health care and degradable materials. Based on the introduction of amylose use, we reviewed the key genes for amylose synthesis, amylose test methods, high amylose corn material creation and breeding and existing questions.
Keywords Amylose; Corn; Research progress
籽粒淀粉含量(直链淀粉和支链淀粉的总量)超过74%时,该玉米品种被称为高淀粉玉米。普通玉米籽粒胚乳约含25%直链淀粉和75%支链淀粉。高支链淀粉玉米又称糯玉米或蜡质玉米,其支链淀粉含量占总淀粉的95%以上,甚至达到100%。在中国,高直链淀粉玉米是指直链淀粉含量占总淀粉含量55%~85%的玉米[1],而美国则将它认定为直链淀粉含量占50%以上的玉米品种[2]。
直链淀粉是由D-吡喃葡萄糖组成的线性聚合物,各葡萄糖单体以α-1,4-糖苷键连接。支链淀粉是具有树枝形分支结构的多糖,通过α-1,4-糖苷键将D-吡喃葡萄糖单位连接成一直链,又通过α-1,6-糖苷键形成侧链,在侧链上再出现另一个分支侧链[3]。直链淀粉的聚合度一般有500~6 000个葡萄糖残基,支链淀粉则由A链、B链和C链构成。C链作为支链淀粉结构的主链,有一个还原末端,聚合度为60个左右的葡萄糖残基;B链为C链上的支链,聚合度一般为45~55个葡萄糖残基;A链是位于B链上的支链,聚合度为14~18个葡萄糖残基[4]。
1 玉米淀粉产业概况
玉米现已是我国第一大粮食作物,2017年种植面积约为3 544.52万公顷,总产量为2.16亿吨。除用作饲料外,玉米还被用于工业原料,约占玉米消费的25%。2017年,全国玉米深加工消耗量在7 000万吨左右,深加工方式主要包括淀粉加工(占比为68%)、酒精加工(16%)及味精、柠檬酸和赖氨酸等加工[5]。预计2018—2022年玉米淀粉產能可从2017年的3 680万吨上升到5 000万吨左右,按照1吨玉米产0.67吨淀粉来算,仅淀粉加工消耗玉米将超过7 000万吨。因此,玉米淀粉消费的国内市场潜力巨大。
玉米直链淀粉因其独特理化性质,是一种高附加值的淀粉,目前已发展成为重要的工业原料,并用于开发30多个领域的5 000多种工业产品。国内年均直链淀粉消费量约200万吨,因国内没有高直链淀粉玉米推广种植,所以玉米直链淀粉多由美国进口,每吨价格为14 000~16 000元,约是普通玉米淀粉价格的6倍左右。少量国产的玉米直链淀粉均以普通玉米淀粉为提取原料,提取效率约为30%~50%[6],加工成本较高。因此,高直链淀粉玉米品种的缺乏影响了国内玉米直链淀粉的工业化进程[5]。
2 玉米直链淀粉的用途
直链淀粉具有特殊的分子结构和理化性质,加之独特的营养功能、消化特性和加工性能,因此用途广泛,涉及食品、医疗保健、材料、纺织、造纸、包装、环保等多个领域。随着人们对直链淀粉理化性质研究的深入,它的应用前景也更加广阔[7]。
2.1 抗性淀粉
将健康者小肠中不吸收的淀粉及其降解产物综称为抗性淀粉。抗性淀粉是食品膳食纤维的功能成分,将它广泛应用于食品加工行业,不仅可提高纤维含量,还可提高食品品质,改善传统膳食纤维的某些缺点,使消费者能够在享受食品原有品质的前提下得到健康和营养。抗性淀粉的得率与原料中直链淀粉含量成正比[8],随着直链淀粉与支链淀粉比例的提高,抗性淀粉的产率可由7.61%提高至36.45%,上升4倍之多[4]。
2.2 休闲食品
膨化食品多以淀粉及淀粉衍生物为原料进行生产。直链淀粉和支链淀粉有显著不同的膨化效果,食品加工中通常通过调节两种淀粉的比例以获得不同的膨化效果。直链淀粉较支链淀粉具有更强抗拉伸力,能够增加产品的脆性和强力。直链淀粉含量高的面团成型性较好,可增强面团的干燥及切割性能;支链淀粉可在面团中形成网状结构,而该网状结构在面团膨化过程中可形成多孔组织,所以支链淀粉有助于增大膨化体积,增强食品的松脆性。
2.3 食品包装材料
直链淀粉可用于生产一种半透明纸,该纸不透氧气和氮气,透二氧化碳和脂肪也很少,可食用。该纸多用于面包酶的包装,在食品工业中的用途广泛。美国申请了一种直链淀粉生产薄膜的专利,这种膜在冷、热条件下都不溶化,因此既可包装粉状产品又可包装速冻食品。
2.4 环境保护
目前大量使用的塑料袋、快餐盒等塑料制品至少需要100年才能被土壤中的微生物所降解。直链淀粉具有近似纤维的性能,制作的薄膜具有好的透明度、柔韧性、抗张强度和水不溶性,且无毒、无污染,广泛应用于密封材料、包装材料和耐水耐压材料的制造。利用高直链淀粉代替聚苯乙烯生产光降解塑料可应用于包装工业和农用薄膜加工业,是解决目前日益严重的“白色污染”的最为有效的途径之一。
2.5 医疗保健
高直链淀粉制作的食品是糖尿病人的理想食品,亦被称为“功能性食品”,也因具有防止胆结石形成及降低血液胆固醇的作用成为胆结石及高血压病人的理想食品。
3 玉米直链淀粉合成的关键基因
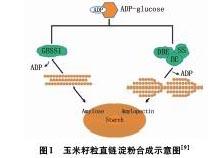
玉米支链淀粉与直链淀粉合成途径(图1)已经研究的比较透彻,关键酶相关基因如wx[10]、sebIIb[10,11]、sebI[10]、ae[1]等的序列、功能及表达等多方面已经明晰,部分基因亦公布了功能标记或连锁标记。这些基因均能影响玉米胚乳中直链淀粉的含量,特别是ae及其修饰基因通过自身调控可使玉米直链淀粉大幅增加[1]。
3.1 淀粉分支酶(starch branching enzyme,SBE)
淀粉分支酶與支链淀粉合成有密切关系[12],它可通过在线性的α-1,4糖苷键连接的葡聚糖中引入α-1,6糖苷键分支点催化支链淀粉的形成。根据酶的结构、底物专一性和免疫反应等特点,可将SBE分为两类:同工型A和同工型B。玉米的SBEⅡa、SBEⅡb属于同工型A,SBEⅠ属于同工型B。同工型A类的SBE作用的底物为支链淀粉,能使较短的糖苷键转移到支链淀粉上;而同工型B对直链淀粉的亲和力更高[13],在玉米中酶SBEⅠ在直链上产生分支的效率是在支链上产生分支效率的10倍以上[14]。在玉米中三种同工酶分别由SbeⅡa、SbeⅡb和SbeⅠ基因编码。
ae突变体是由位于第五染色体长臂上的隐性基因ae控制。ae突变体可导致淀粉分支酶SBEⅡb的缺失,造成SBEⅡb失去活性,但SBEⅡa的活性几乎不受影响[15]。ae突变体的玉米胚乳无光泽,籽粒为玻璃状、透明,虽然籽粒的总淀粉含量大幅度降低,但纯合隐性基因可以把直链淀粉含量由25%~28%提高到55%~65%,甚至达到70%~80%[1,15]。但该突变体的胚乳在不同的遗传背景表现出不同程度的皱缩,其胚乳发育过程中分支酶活力只有正常植株的1/3[15,16]。
sbeⅠ基因是ae基因的关键修饰基因,对直链淀粉含量的贡献率为49%[10]。郭新梅等通过RNAi方法将普通玉米中sbeⅠ基因沉默,使转化植株直链淀粉含量提高9.8%[17]。表明sbeⅠ基因对直链淀粉含量具有显著影响。
3.2 淀粉合成酶(starch synthase,SS)
淀粉合成酶是植物籽粒淀粉合成的关键酶,与淀粉总含量、直链淀粉与支链淀粉比例、支链淀粉链长分布和淀粉粒的结构直接相关。依据在淀粉体中存在状态、酶学特性,可将SS分为束缚态淀粉合成酶(granule-bound starch synthase,GBSS)和可溶性淀粉合成酶(soluble starch synthase,SSS)[18]。
GBSS与淀粉颗粒紧密结合。在玉米籽粒中起主要催化作用的GBSS是指由wx基因编码的GBSSI,它是与直链淀粉合成直接相关的酶。wx突变体的籽粒胚乳无明显总淀粉含量下降,但wx突变体籽粒中的直链淀粉含量显著减少甚至完全消失[19]。高直链淀粉玉米品种籽粒的总淀粉积累量少、直链淀粉含量高是SSS、GBSSI和SBE综合作用的结果[3]。
3.3 淀粉去分支酶(starch debranching enzyme,SDBE)
在玉米中该酶又称为异淀粉酶(isoamylase,ISA),可水解支链淀粉的α-1,6糖苷键。SDBE在支链淀粉的合成及其整合到淀粉颗粒中均有重要的“修饰”,影响支链淀粉簇或树结构的最终形成,并和DBE共同决定支链淀粉的最终分支程度。在玉米中,编码ISA的基因为ISA1、ISA2和ISA3[15]。
4 玉米籽粒直链淀粉的检测方法
玉米籽粒直链淀粉检测有多种方法,除了传统的碘比色法和碘亲和力滴定法外,还有近年来报道较多的近红外光谱分析法、自动分析检测法、伴刀豆球蛋白法、色谱分析法等。各种方法均有优缺点和适用性[7]。碘比色法是现行行业标准方法,近红外光谱分析法是近年报道的新方法,实际工作中可根据不同的测试目的、不同的要求,选择适当的方法。
4.1 碘比色法
碘比色法是测定直链淀粉含量的经典方法。它的基本原理是支链淀粉、直链淀粉与碘形成碘—淀粉复合物,并具有特殊的颜色反应,其中支链淀粉与碘生成棕红色复合物,直链淀粉与碘生成深蓝色复合物。在淀粉总含量不变的前提下,按不同比例将这两种淀粉分散液混合,在特定波长和酸度条件下与碘作用,生成由紫红到深蓝一系列不同颜色,根据朗伯—比尔定律,吸光度与直链淀粉浓度呈线性关系,可用分光光度法测定。
碘比色法是我国玉米籽粒直链淀粉含量测定的行业标准方法(NY/T 55—1987,原GB 7648—1987)[20],其优点是灵敏度高、准确度高,但需要购买或通过提取、纯化等繁琐操作来自行制备直链、支链淀粉标准品,并且需要对样品进行脱脂工作,花费时间较长。
4.2 近红外光谱分析法
近红外光谱分析法基本原理是依据样品中的直链淀粉对近红外光谱在特定波长处有特定吸收,分析过程分为建模和预测步骤。建模时首先要选取一定数量的样品,采用标准化学方法测定组分浓度的化学值(标准值),选用近红外光谱仪扫描获得样品的近红外光谱曲线;运用定性分析方法,把样品分为校正集和预测集,通过校正集的光谱曲线和化学值的关系,利用不同多元校正法建立校正模型;利用校正模型和预测集的光谱曲线预测出组分浓度的化学值来检验校正模型,如果预测误差在允许范围内,就输出校正模型,否则,应重新划分校正集和预测集再次建立校正模型,直到校正模型满足要求为止。预测时在相同条件下多次扫描未知样品的近红外光谱曲线,选择适当的校正模型,并进行模型适应度检验;根据该模型和未知样品的近红外光谱曲线预测未知样品组分的浓度值。
近红外光谱分析具有样品一般不需预处理、分析速度快、分析成本低、无损检测、无污染的优点。但该方法属于一种间接分析技术,需要选取大量有代表性的样品进行化学分析,实测组分,据此建立模型,该过程需要消耗较多的分析费用和时间,还存在测试灵敏度相对较低的缺点。因此,近红外光谱分析结果的准确性依赖于建立的定标模型质量。目前,国内已经建立多个用于玉米单果穗籽粒[21,22]及单籽粒[23]的直链淀粉含量近红外检测方法,为玉米籽粒直链淀粉含量的快速检测奠定了基础。
5 高直链淀粉材料的创制及品种选育
5.1 国外高直链淀粉材料的创制及品种选育
1942年,直链淀粉和支链淀粉分离技术的建立推进了直链淀粉工业应用的研究,为此科学家开始搜集高直链淀粉材料和资源[2]。1953年,Dunn等[24]发现dususu2三隐性基因纯合突变体的直链淀粉含量可高达77%,但总淀粉含量减少。真正的研究突破是在1952年发现了能加倍直链淀粉含量的单隐性基因,并于1958年将ae作为该基因在第五染色体上的永久符号[2],1989年Iowa大学将该基因向欧洲专利局申请了专利保护[25]。ae基因虽可显著提高籽粒直链淀粉的含量,但会造成籽粒总淀粉含量的下降以及含水量的增加。同时,在不同自交系背景下ae纯合基因对直链淀粉的提高程度有很大差异,这表明不同的遗传背景对ae基因有不同修饰作用。Chen等[10]发现sbeⅠ基因是ae基因的关键修饰基因,可提高ae纯合基因下籽粒的直链淀粉含量,对直链淀粉含量的贡献率达到49%。
20世纪70年代,美国选育并推出直链淀粉含量为50%的玉米杂交种C1assⅥ和直链淀粉含量为70%~80%的C1assⅦ;到了80年代,卡斯汤姆种子公司(Custom Farm Seed)推出C1assⅧ和C1assⅨ玉米单交种(直链淀粉含量超过94%)。目前,美国高直链淀粉玉米的推广模式是订单农业,即农民与直链淀粉玉米加工厂或特种玉米出口商签约种植,推广品种的直链淀粉含量基本为100%[2]。国外的高直链淀粉材料绝大多数处于保密状态,目前美国唯一公开的高直链玉米自交系GEMS-0067(注册号:GP-550,PI643420)是由美国种质提升项目选育,系谱为GUAT209:S13× (OH43ae× H99ae)[19,26,27]。
5.2 国内高直链淀粉材料的创制及品种选育
国内高直链淀粉玉米的资源收集、创制及杂交种选育等方面均起步较晚。顾晓红[28]对国家种质资源库保存的1 060份玉米材料进行籽粒品质分析,结果显示玉米直链淀粉含量变异幅度为0.36%~33.14%,平均为28.67%,大部分种质的含量介于25%~31%。由此可見,国内十分缺乏籽粒直链淀粉含量较高的玉米种质资源。
近几年,通过对国外种质的引进及利用,国内学者开展了高直链淀粉材料分类、分子遗传及杂交种选育相关研究。周联东等[29]引进玉米高直链淀粉材料48份,通过SSR标记将这些材料分为6大类群,以Lancaster、Reid类群居多,部分材料与国内五大类群有较大的遗传距离。这些材料和信息为高直链淀粉相关材料的回交转育及杂交种选育提供了基础数据。2006年,中国农业大学国家玉米改良中心选育的中农大401(晋审玉2006038)获得省级审定,其直链淀粉含量约50%,达到商业开发的要求,但与国外的高直链淀粉玉米品种仍有一定差距。
除引进国外现有种质加以利用,国内科研人员也通过基因过表达、基因沉默等分子生物学技术创制高直链淀粉玉米材料。Li[30]、Zhao[31]等成功利用GBSSI基因的过表达获得直链淀粉含量高达41.9%的籽粒,通过SBEⅡ RNAi创建的籽粒直链淀粉含量达55%;郭新梅等[17]通过沉默SBEⅠ基因使玉米转化植株直链淀粉含量提高了9.8%;柴晓杰等[32]利用RNAi技术,抑制玉米淀粉分支酶基因SBEⅡb表达,使支链淀粉的合成受到抑制,在总淀粉含量基本不变的情况下,将转基因玉米直链淀粉含量提高到50%左右。但目前尚未见这些种质应用于高直链淀粉玉米杂交种审定的报道。
6 高直链淀粉玉米选育方法和存在问题
选育高直链淀粉玉米需要有更为丰富的种质,并且选择效果依赖于种质群体的遗传变异和变异类型。高直链淀粉玉米杂交亲本需要具备良好的农艺性状,还需拥有更高的籽粒直链淀粉含量。因此,在选育过程中需要做到ae基因与修饰基因的结合,积累更多的修饰基因,且保持ae位点的纯合以显现修饰基因的修饰效应。
即使ae基因纯合,育种材料不同的遗传背景也会影响ae基因的表达,具体表现为直链淀粉含量及籽粒外形的变化。袁建华等[33]通过将ae基因导入16个常规玉米自交系,得到籽粒直链淀粉含量为22.94%~44.64%的改良材料。另有研究发现,不同改良自交系间直链淀粉含量差异较大,证实在ae基因纯合前提下遗传背景与ae基因间存在明显的互作关系[34]。因此,选择合适的受体自交系十分重要,意味着利用ae基因获得直链淀粉含量更高的改良系具有更高难度。
实际育种时,因ae基因需要纯合才能进行选择,因此一般回交和自交两世代交替进行,回交一般需要三轮以上。如果受体亲本有不利于农艺性状的基因与ae基因连锁,必须增加回交世代以打破连锁,同时针对ae基因和不良农艺性状进行双向选择[1,3,33,34]。另外,如果受体亲本携有ae基因的修饰基因,后代选择到高直链淀粉基因型就比较容易,如果只有供体亲本含有该基因,那么获得所需基因组合就需要更大的育种群体。
育种上一般用轮回选择法解决以上问题。该方法首先需要建立数目较大的亲本群体,亲本之间遗传距离越大,越有利于将更多的有益基因聚合在一起,这可以给育种者提供更多的选择机会。轮回选择需要多轮的混粉、自交、测配过程,这将为直链淀粉相关基因的重组提供机会。卡斯汤姆种子公司通过亲本群体10轮的改良,群体的直链淀粉平均含量超过85%,再对群体做进一步的自交和选择,获得含量达到94%的自交系[1,2,27]。不过,该方法不可避免存在育种群体大、所需周期长、工作量大的弊端。
日益完善的分子生物学技术使快速检测隐性基因成为可能,这不仅可以提高检测目标位点的准确率,而且可以有效缩短育种年限,但需要对相关基因开发连锁标记或功能性标记[10,15,35]。在步骤上,首先需要设计、合成试验群体,利用已知位点或全基因关联分析、QTL定位等技术挖掘与直链淀粉含量相关的位点信息,然后利用分子标记辅助选择或全基因组选择技术将这些位点分别聚合至父母本材料,同时需要在田间进行农艺性状、产量性状等的综合筛选,并考虑杂种优势对直链淀粉含量的影响,这样才有可能较快地获得理想的高直链淀粉玉米杂交种。
参 考 文 献:
[1] 张瑛, 徐晓红, 朱玉芹, 等. 高直链淀粉玉米的选育概况与发展前景[J]. 玉米科学, 2005, 13(1):52-54, 59.
[2] 史振声, 王志斌, 李凤海, 等. 国内外高直链淀粉玉米的研究与利用[J]. 辽宁农业科学, 2002(1):30-33.
[3] 孟令瑞, 孙明茂, 苗锦山, 等. 玉米直链淀粉含量遗传研究进展[J]. 食品安全导刊, 2012(9): 72-74.
[4] 杨光, 杨波, 丁霄霖. 直链淀粉和支链淀粉对抗性淀粉形成的影响[J]. 食品工业科技, 2008, 29(6):165-167.
[5] 智研咨询集團. 2018—2024年中国玉米行业市场前景预测及投资战略研究报告[R].北京:智研咨询集团, 2018.
[6] 钟雨越, 张旭东, 石涵羽, 等. 玉米直链淀粉的分离与鉴定[J]. 中国粮油学报, 2016,31(10):39-44.
[7] 杨有仙, 赵燕, 李建科, 等. 直链淀粉含量测定方法研究进展[J]. 食品科学, 2010, 31(23):417-422.
[8] Lee S K, Mun S H, Shin M S. Effect of heating conditions on the resistant starch formation[J]. Agricultural Chemistry & Biotechnology, 1997, 40(3): 220-224.
[9] Li C, Huang Y, Huang R, et al. The genetic architecture of amylose biosynthesis in maize kernel[J]. Plant Biotechnology Journal, 2018, 16:688-695.
[10] Chen T, Ning L, Liu X, et al. Development of functional molecular markers of SbeⅠ and SbeⅡb for the high amylose maize germplasm line GEMS-0067[J]. Crop Science, 2013, 53(2): 482-490.
[11] 宁丽华, 陈亭亭, 刘怀华, 等. 高直链淀粉玉米amylose-extender基因功能标记的开发及应用[J]. 分子植物育种, 2011,9(2):185-189.
[12] Tanaka N, Fujita N, Nishi A, et al. The structure of starch can be manipulated by changing the expression levels of starch branching enzyme Ⅱb in rice endosperm[J]. Plant Biotechnology Journal, 2004, 2(6): 507-516.
[13] Guan H P , Preiss J. Differentiation of the properties of the branching isozymes from maize (Zea mays) [J]. Plant Physiology, 1993, 102(4): 1269-1273.
[14] Guan H P, Baba T, Preiss J. Expression of branching enzyme Ⅱ of maize endosperm in Escherichia coli[J]. Plant Physiology, 1994, 104(4): 1449-1453.
[15] 王慧. 利用转基因聚合创造高淀粉、高直链淀粉玉米新种质[D]. 济南: 山东大学, 2017.
[16] Yuan Y, Thompson D B, Guiltinan M J. Maize starch-branching enzyme isoforms and amylopectin structure. In the absence of starch-branching enzyme Ⅱb, the further absence of starch-branching enzyme Ⅰa leads to increased branching[J]. Plant Physiology, 2004, 136(3): 3515-3523.
[17] 郭新梅, 宋希云, 张晓东. RNAi沉默淀粉分支酶基因SBEⅠ对玉米直链淀粉合成的影响[J]. 植物学报, 2010, 45(6): 670-678.
[18] Smith A M, Denyer K, Martin C. The synthesis of the starch granule[J]. Annual Review of Plant Physiology & Plant Molecular Biology, 1997, 48: 67-87.
[19] Tsai C Y. The function of the Waxy locus in starch synthesis in maize endosperm[J]. Biochemical Genetics, 1974, 11(2): 83-96.
[20] 中华人民共和国农牧渔业部. 水稻、玉米、谷子籽粒直链淀粉测定法:GB7648—1987[S]. 1987:1-5.
[21] 朱苏文, 何瑰, 李展. 玉米籽粒直链淀粉含量的近红外透射光谱无损检测[J]. 中国粮油学报, 2007, 22(3): 144-148.
[22] 吴晗, 张力, 韩笑,等.玉米直链淀粉近红外模型的建立[J]. 分子植物育种, 2017, 15(6): 2286-2290.
[23] 刘林三, 张宏, 冯娇娇, 等. 玉米单籽粒及单穗籽粒直链淀粉质量分数NIRS模型的建立与验证[J]. 西北农业学报, 2017, 26(11): 1606-1613.
[24] Dunn G M, Kramer H H, Whistler R L. Gene dosage effects on corn endosperm carbohydrate s1[J]. Agronomy Journal, 1953, 45(3): 101-104.
[25] Robertson D S, Stinard P. Dominant amylose-extender mutant of maize: Europe Ep0372358[P].1990-06-13.
[26] Pollak L M. The history and success of the public-private project on germplasm enhancement of maize (GEM)[J]. Advances in Agronomy, 2003, 78(2): 45-87.
[27] Wu Y, Campbell M, Yang Y, et al. Genetic analysis of high amylose content in maize (Zea mays L.) using a triploid endosperm model[J]. Euphytica, 2009, 166(2): 155-164.
[28] 顾晓红. 中国玉米种质资源品质性状的分析与评价[J]. 玉米科学, 1998, 6(1): 14-16.
[29] 周联东, 孙佩, 刘经纬, 等. 利用SSR标记划分48份高直链淀粉玉米种质杂种优势类群[J]. 陕西农业科学, 2015, 61(5): 42-45.
[30] Li N, Zhang S, Zhao Y, et al. Over-expression of AGPase genes enhances seed weight and starch content in transgenic maize[J]. Planta, 2011, 233(2): 241-250.
[31] Zhao Y, Li N, Li B, et al. Reduced expression of starch branching enzyme Ⅱa and Ⅱb in maize endosperm by RNAi constructs greatly increases the amylose content in kernel with nearly normal morphology[J]. Planta, 2015, 241(2): 449-461.
[32] 柴晓杰, 王丕武, 关淑艳,等. 应用RNA干扰技术降低玉米支链淀粉含量[J]. 植物生理与分子生物学学报, 2005, 31(6):625-630.
[33] 袁建華, 陈艳萍, 张跃中, 等. 玉米胚乳突变基因ae的遗传效应[J]. 江苏农业学报, 2005, 21(2): 4-10.
[34] 滕文涛. 近等基因背景下对玉米胚乳突变基因ael的遗传效应研究[D]. 北京:中国农业大学, 2000.
[35] 宁丽华. 高直链淀粉玉米种质的类群分析及sbeⅠ、sbeⅡb基因分子标记的开发[D]. 泰安:山东农业大学, 2011.
