肝癌组织中SIRT5的表达及其临床病理意义
2019-08-15刘义文廖春娇黄顺东
刘义文 廖春娇 黄顺东
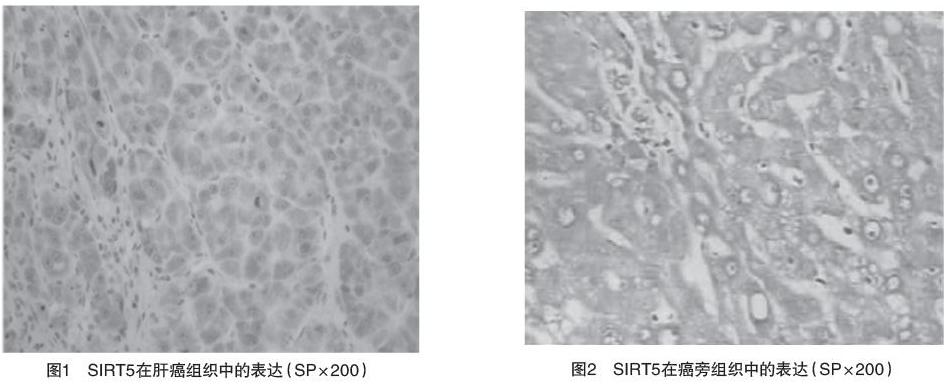
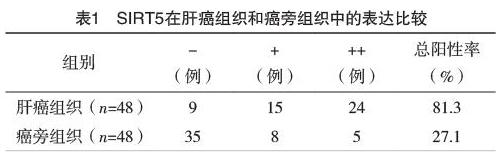

【摘要】 目的:研究沉默调节蛋白5(SIRT5)在肝癌组织中的表达及其临床病理意义,探讨SIRT5在肝癌发生、发展中的作用。方法:应用免疫组织化学SP法检测48例患者肝癌及其癌旁组织中SIRT5的表达情况,分析SIRT5与肝癌的病理特征关系。结果:SIRT5在肝癌组织中的总阳性率高于癌旁组织(P<0.05);肝癌组织中SIRT5的表达与病理分化程度、TNM分期、门脉癌栓或转移、肿瘤大小有关(P<0.05),与年龄、性别、肿瘤数目、AFP、HBsAg、肝硬化程度、肝癌组织类型、包膜完整性等因素无关(P>0.05)。结论:SIRT5的高表达在肝癌的发生及发展中起一定作用,可能在一定程度上反映了肝癌侵袭性强弱。
【关键词】 沉默调节蛋白5; 肝癌; 病理特征
【Abstract】 Objective:To study the expression of SIRT5 in hepatocellular carcinoma and its clinicopathological significance,and to explore the role of SIRT5 in the occurrence and development of hepatocellular carcinoma.Method:The expression of SIRT5 in 48 patients with hepatocellular carcinoma and its adjacent tissues was detected by immunohistochemical SP method.The relationship between SIRT5 and pathological characteristics of hepatocellular carcinoma was analyzed.Result:The total positive rate of SIRT5 in hepatocellular carcinoma was higher than that of adjacent tissues(P<0.05).The expression of SIRT5 in hepatocellular carcinoma tissues was correlated with pathological differentiation,TNM stage,portal vein thrombus or metastasis,tumor size(P<0.05),but not with age,sex,number of tumors,AFP,HBsAg,degree of cirrhosis,type of hepatocellular carcinoma tissues and capsule integrity(P>0.05).Conclusion:The high expression of SIRT5 may play a role in the occurrence and development of hepatocellular carcinoma,which may reflect the invasiveness of hepatocellular carcinoma to a certain extent.
【Key words】 SIRT5; Hepatocellular carcinoma; Pathological characteristics
First-authors address:The Second Peoples Hospital of Jingzhou,Jingzhou 434000,China
doi:10.3969/j.issn.1674-4985.2019.04.035
沉默調节蛋白(Sirtuin,SIRT)是一类NAD+依赖型去乙酰化酶,可通过去乙酰化修饰调控肿瘤细胞的能量代谢及基因的稳定性、改变肿瘤微环境,进而影响肿瘤的发生及发展[1-3]。SIRT5作为SIRT家族一员,其在肺癌的发生及发展中发挥癌基因的作用,但在肝癌中的作用鲜有报道,本研究拟通过免疫组织化学SP法检测SIRT5在肝癌中的表达情况及临床病理意义,分析SIRT5与肝癌的病理特征关系,来探讨SIRT5在肝癌发生、发展中的作用,为肝癌的治疗及预后评估提供一定的理论依据。现报道如下。
1 资料与方法
1.1 一般资料 本研究收集的组织标本来自本院肝胆外科2014年1月-2016年12月行肝癌切除术的患者48例,组织标本为同一患者的原发性肝癌组织及其癌旁组织。纳入标准:所有肝癌患者均经病理证实,且术前均未行任何抗肿瘤治疗。排除标准:排除肝癌切除术后肿瘤复发患者、合并严重心脑血管疾病患者、不愿参加临床研究的患者。本研究通过了本院伦理委员会审核并遵循临床相关伦理研究规定,患者均知情并签署知情同意书。
1.2 方法
1.2.1 试剂 兔抗人SIRT5多克隆抗体(工作浓度为1︰500)为美国Abcam公司产品、免疫组化试剂盒及DAB辣根过氧化物酶显色试剂盒均购自北京中杉金桥生物技术公司。
1.2.2 检测方法 所有组织标本均经l0%甲醛固定后石蜡包埋,4 μm厚连续切片,采用免疫组织化学SP法,严格按照试剂盒说明书进行操作。
1.2.3 阳性标准 SIRT5阳性表达为棕黄色颗粒,染色部位主要集中于细胞核、细胞膜和/或细胞质。免疫组化采用半定量积分法:以染色程度评分、阳性表达细胞百分比评分对SIRT5表达情况进行评估。染色程度评分:无着色为0分;有轻度着色,呈现浅黄色为1分;有中度着色,呈现棕黄色为2分;有重度着色,呈现棕褐色为3分。阳性细胞染色百分比评分:<1/3为1分:1/3~2/3为2分:>2/3为3分。根据二者乘积判断阳性等级:0分为阴性(-),3~6分为阳性(+),>6分为强阳性(++),总阳性=阳性+强阳性。
1.3 观察指标 比较SIRT5在肝癌组织和癌旁组织中的表达,分析肝癌组织中SIRT5的表达与临床病理特征的关系。
1.4 统计学处理 使用SPSS 21.0软件对所得数据进行统计分析,计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 SIRT5在肝癌组织和癌旁组织中的表达比较 SIRT5蛋白颗粒定位于细胞核、细胞膜和/或细胞质,呈棕黄色颗粒,见图1、2;SIRT5在肝癌组织中的总阳性率高于癌旁组织,比较差异有统计学意义(字2=28.364,P=0.000)。见表1。
2.2 肝癌组织中SIRT5的表达与临床病理特征的关系 肝癌组织中SIRT5的表达与病理分化程度、TNM分期、门脉癌栓或转移、腫瘤大小有关(P<0.05),与年龄、性别、肿瘤数目、AFP、HBsAg、肝硬化程度、肝癌组织类型、包膜完整性等因素无关(P>0.05)。见表2。
3 讨论
SIRT家族主要通过影响蛋白的去乙酰化反应参与机体的应激、基因稳定性的调控、能量的代谢、DNA的修复及细胞寿命的调节[4],通过调控细胞黏附及炎症途径干预肿瘤的侵袭转移过程[3]。SIRT家族在人体内有7个成员(SIRT1~SIRT7),SIRT1和SIRT2主要分布于细胞质中,SIRT3、SIRT4、SIRT5主要分布于线粒体中,SIRT6和SIRT7则主要分布于细胞核中[5]。根据研究显示,SIRT家族7个成员均在肿瘤的发生及发展中其重要作用,其中SIRT1、SIRT2、SIRT3、SIRT4、SIRT6发挥抑癌基因的作用[6-15],SIRT7可能发挥癌基因作用[16],而对于SIRT5在肿瘤发生发展中的作用的缺乏明确定论,仅有研究表明其可能在肺癌的发生发展中可能起癌基因的作用[17],但也有研究显示在非小细胞肺癌中,敲除SIRT5后肿瘤细胞增殖能力减弱[18]。在乳腺癌中SIRT5表达改变与肿瘤分化水平以及激素受体阳性有关[19-20]。但在肝癌发生发展中的作用不十分明确,仅有我国学者常亮[20]研究指出SIRT5在肝细胞肝癌组织中呈现高表达。
本研究结果显示,SIRT5在肝癌组织中的总阳性率高于癌旁组织(P<0.05),说明肝癌组织中SIRT5的过度表达在一定程度上可以反映肝细胞的恶变程度,这与常亮[20]研究报道基本一致,且他的研究发现,SIRT5在肝细胞肝癌组织中的表达与肿瘤的直径、肿瘤的数目及TNM分期有关,而与性别、年龄、病理分级、门脉癌栓、AFP、肝硬化均不相关,并通过动物实验及体外实验发现SIRT5通过调控细胞周期和EMT相关蛋白的表达进而促进肝癌细胞的增殖和转移。本研究结果显示,肝癌组织中SIRT5的表达与病理分化程度、TNM分期、门脉癌栓或转移、肿瘤大小有关(P<0.05),与年龄、性别、肿瘤数目、AFP、HBsAg、肝硬化程度、肝癌组织类型、包膜完整性等因素无关(P>0.05),具体表现为在有门脉癌栓或转移、肿瘤直径>5cm、病理分化程度为低分化及未分化、TNM分期为Ⅲ+Ⅳ中的SIRT5阳性表达高于无门脉癌栓或转移、肿瘤直径≤5 cm、病理分化程度为中分化及高分化、TNM分期为Ⅰ+Ⅱ期,即在发生门脉癌栓或转移、肿瘤体积大、病理分化程度低及TNM分期较差组中SIRT5的阳性表达明显增加,提示SIRT5与肝癌的侵袭性有一定关系。可以看出,本组研究对于SIRT5在肝癌组织中的表达与肿瘤的数目、门脉癌栓及组织分化程度的相关性,与常亮[20]研究有一定的出入,可能与入组的标本量少有关。但可以明确的是SIRT5在肝癌的发生发展中起重要的作用。
综上所述,SIRT5在肝癌组织中呈现高表达,在肝癌的发生及发展中发挥癌基因作用,一定程度上反映了肝癌侵袭性强弱,但其在肝癌形成及进展中所发挥的具体分子作用机制有待于进一步研究。
参考文献
[1] Guarente L.Calorie restriction and sirtuins revisited[J].Genes Dev,2013,27(19):2072-2085.
[2] Guarente L.Hpstein Lecture:Sirtuins,aging,and medicine[J].N Engl J Med,2011,364(23):2235-2244.
[3] Hanahan D,Weinberg R A.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[4] Finkel T,Deng C X,Mostoslavsky R.Recent progress in the biology and physiology of sirtuins[J].Nature,2009,460(7255):587-591.
[5] Morris B J.Seven sirtuins for seven deadly diseases of aging[J].Free Radic Biol Med,2013,56:133-171.
[6] Firestein R,Blander G,Michan S,et al.The SIRT1 deacetylase suppresses intestinal tumorigenesis and colon cancer growth[J].PLoS One,2008,3(4):e2020.
[7] Oberdoerffer P,Michan S,McVay M,et al.SIRT1 redistribution on chromatin promotes fenomic stability but alter gene expression during aging[J].Cell,2008,135(5):907-918.
[8] Kim H S,Vassilopoulos A Wang R H,et al.SIRT2 Maintains Genome Integrity and Suppresses Tumorigenesis through Regulation APC/C Activity[J].Cancer Cell,2014,20(4):487-499.
[9] Serrano L,Martínez-Redondo P,Marazuela-Duque A,et al.The tumor suppressor SIRT2 regulates cell cycle progression and genome stability by modulating the mitotic deposition of H4K20 methylation[J].Genes Dev,2013,27(6):639-653.
[10] Kim H S,Patel K,Muldoon-Jacobs K,et al.SIRT3 Is a Mitochondria-Localized Tumor Suppressor Required for Maintenance of Mitochondrial Integrity and Metabolism during Stress[J].Cancer Cell,2010,17(1):41-52.
[11] Hirschey M D,Shimazu T,Goetzman E,et al.SIRT3 regulates mitochondrial fatty-acid oxidation by reversible enzyme dacetylation[J].Nature,2010,464(7285):121-125.
[12] Jeong S M,Xiao C,Finley L W,et al.SIRT4 Has Tumor-Suppressive Activity and Regulates the Cellular Metabolic Response to DNA Damage by Inhibiting Mitochondrial Glutamine Metabolism[J].Cancer Cell,2013,23(4):450-463.
[13] Wang Q,Wen Y G,Li D P,et al.Upregulated INHBA expression is associated with poor survival in gastric cancer[J].Med Oncol,2012,29(1):77-83.
[14] Marquardt J U,Fischer K,Baus K,et al.SIrtuin-6-dependent genetic and epigenetic alterations are associated with poor clinical outcome in hepatocellular carcinoma patients[J].Hepatology,2013,58(3):1054-1064.
[15] Khongkow M,Olmos Y,Gong C,et al.SIRT6 modulates paclitaxel and epirubicin resistance and survival in breast cancer[J].Carcinogenesis,2013,34(7):1476-1486.
[16] Barber M F,Michishita-Kioi E,Xi Y,et al.SIRT7 links H3K18 deacetylation to maintenance of oncogenic transformation[J].Nature,2012,487(7405):114-118.
[17] Lu W,Zuo Y,Feng Y,et al.SIRT5 facilitates cancer cell growth and drug resistance in non-small cell lung cancer[J].Tumour Biol,2014,35(11):10699-10705.
[18] Igci M,Kalender M E,Borazan E,et al.High-througput Screening of Sirtuin family of genes in breast cancer[J].Gene,2016,586(1):123-128.
[19] Makhoul I,Todorova V K,Siegel E R,et al.Germline Genetic Variants in TEK,ANGPT1,ANGPT2,MMP9,FGF2 and VEGFA Are Associated with Pathologic Complete Response to Bevacizumab in Breast Cancer Patients[J].PloS One,2017,12(1):e0168550.
[20]常亮.SIRT5在肝細胞肝癌发生发展中的作用研究[D].广州:南方医科大学,2017.
(收稿日期:2018-07-03) (本文编辑:董悦)
