健脾补血方对化疗药物引起骨髓抑制的临床与实验研究
2019-08-15冯立志何伟平叶小卫詹少锋黄慧婷刘小虹
冯立志,何伟平,叶小卫,詹少锋,黄慧婷,刘小虹,
1.广州中医药大学第一附属医院,广东 广州 510405;2.广州中医药大学,广东 广州 510405
目前许多化疗药物对肿瘤细胞缺乏靶向性,抑制或杀死肿瘤细胞的同时累及正常细胞,从而引起严重的副作用,其中骨髓抑制是化疗后严重副作用之一,导致白细胞减少,进一步出现免疫力下降,严重影响患者的生活质量。现代临床及药理研究提示,中医药可减轻化疗后骨髓抑制,改善临床症状,提高化疗患者的生活质量[1-3]。在前期临床观察中发现健脾补血方能够有效防治化疗患者白细胞、中性粒细胞、血小板下降,在实验研究的基础上,我们验证了健脾补血方能下调肺癌小鼠化疗后血清红细胞生成素(EPO)浓度,同时上调血清血小板生成素(TPO)、重组集落刺激因子(GM-CSF)浓度,动态调节机体化疗后血清EPO、TPO、GM-CSF浓度的失衡状态,从而促进机体造血功能的恢复[4]。因此,本实验旨在通过研究健脾补血方对C57/BL6小鼠化疗后血液中红细胞(Red Blood Cell,RBC)、白细胞(White Blood Cell,WBC)、血小板(Platelet,PLT)数量的影响,以期观察健脾补血方对C57/BL6小鼠血液细胞的影响,为临床优化选用健脾补血方治疗骨髓抑制提供一定的理论支持和客观依据。
1 临床研究
1.1 研究对象
1.1.1 一般资料
广州中医药大学第一附属医院肿瘤中心、广州军区广州总医院肿瘤科,2015年1月份至2016年5月份收治的非小细胞肺癌化疗患者60例。
1.1.2 纳入标准
符合《中国常见恶性肿瘤诊治规范》中原发性肺癌诊断标准,经组织学或细胞学确诊的非小细胞肺癌患者;基因检测无突变者,或拒绝行基因检测者,因各种原因拒服靶向药物者;年龄为18-75岁;Karnofsky评分≥60分,预计生存期超过3个月;各项检查指标符合化疗适应证,无严重的心、肝、肾及骨髓功能障碍;化疗前24小时内无明显恶心呕吐症状及使用止呕药物者;病人同意并愿意接受本方案治疗、依从性好者。
1.1.3 排除标准
不符合纳入标准;合并肝肾、心血管、造血系统等严重原发性疾病及精神病患者;入组前有明显消化道反应者,无法服用或拒服中药汤剂者;入组前24小时内使用造血细胞集落刺激因子者;妊娠或哺乳期妇女;主要研究者或研究者判断不适宜该项临床试验的患者。
1.1.4 脱落标准
出现严重不良事件,根据医生判断应停止试验者;试验过程中,患者发生其他严重并发症,影响疗效评价和安全性判断者;受试者依从性差(试验用药依从性<80%);各种原因的中途破盲病例。
1.2 治疗方案
治疗组:化疗+自拟健脾补血方口服
对照组:单纯化疗
根据兼证加减:恶心呕吐甚者:偏寒者,加旋覆花10 g(包煎)、干姜8 g;偏热者,加竹茹10 g、黄芩15 g。腹胀便秘者:加枳实15 g,火麻仁30 g。腹泻者:加茯苓30 g,肉豆蔻10 g。咳嗽咯痰甚者:偏寒者,加紫菀15 g,桔梗15 g;偏热者,加黄芩15 g,鱼腥草30 g。
中药服法:每日1剂,水煎至200ml,饭后温服。于化疗前1天开始,连服21天。
1.3 两组均采用GP或TP、DP方案化疗
化疗方案:GP:吉西他滨+顺铂;TP:紫杉醇+顺铂;DP:多西他赛+顺铂
化疗药物用法用量:吉西他滨:1 000 mg/m2,静脉滴注1天、8天;紫杉醇:175 mg/m2静脉滴注1天;多西他赛:75 mg/m2静脉滴注1天;顺铂:30 mg/m2静脉滴注,每天一次,共3天。
1.4 两组化疗期间均配合一般对症治疗
1.止呕:盐酸昂丹司琼注射液4 mg IV每天两次(化疗前、后)。
2.护胃:奥美拉唑钠40mg静脉滴注,每日一次。
1.5 造血细胞集落刺激因子的使用及输血
当中性粒细胞<1.0×109/L,予欣粒升(300 μg,皮下注射,隔日一次),当中性粒细胞绝对值连续两次>10×109/L后停药。当血红蛋白<80 g/L,予益比奥(100 00 U,皮下注射,每日一次),当血红蛋白>80 g/L或红细胞压积>40%后停药;当血红蛋白<80 g/L伴明显乏力、气短、心动过速等贫血症状时,应予输注红细胞。当血小板<50×109/L,予巨和粒(50 μg/kg,皮下注射,每日一次),当血小板>50×109/L后停药;当血小板<50×109/L且有出血倾向时,应输注血小板。
1.6 观察指标及时点
《白细胞减少症症状分级量化表》:连续观察21天。血分析(WBC、NEU、RBC、HGB、PLT):化疗前1周、第8天、第21天。
1.7 疗效评价
血分析(WBC、NEU、RBC、HGB、PLT)评价参照《WHO临床试验常见毒副反应分级标准》。
白细胞:0度≥4.0×109/L,Ⅰ度3.0~3.9×109/L,Ⅱ度2.0~2.9×109/L,Ⅲ度1.0~1.9×109/L,Ⅳ度<1.0×109/L;粒细胞:0度≥2.0×109/L,Ⅰ度1.5~1.9×109/L,Ⅱ度1.0~1.4×109/L,Ⅲ度0.5~0.9×109/L,Ⅳ度<0.5×109/L;血红蛋白:0度≥110 g/L,Ⅰ度95~109g/L,Ⅱ度80~94 g/L,Ⅲ度65~79 g/L,Ⅳ度<65 g/L;血小板:0度≥100×109/L,Ⅰ度75~99×109/L,Ⅱ度50~74×109/L,Ⅲ度25~49×109/L,Ⅳ度<25×109/L。
2 实验研究
2.1 材料动物选用C57/BL6小鼠36只,雌性,体质量18~22 g。动物购自广州中医药大学实验动物中心,合格证号:SCXK(粤)2013-0034。
2.2 药品及试剂环磷酰胺,江苏恒瑞医药股份有限公司;小鼠集落刺激因子,美国R&D公司;健脾补血方包括五指毛桃30 g,黄芪30 g,党参20 g,白术15 g,当归6 g,熟地黄10 g,陈皮10 g,法半夏10 g,广藿香10 g(后下),生姜6 g,大枣10 g,炙甘草10 g,诸药相合,具有六君子汤合八珍汤之义,共奏健脾补血之效。饮片购自广州中医药大学第一附属医院,将健脾补血方饮片加10倍的双蒸水浸泡30 min后,煮至沸腾后加入广藿香,再煮30 min,过滤,提取滤液A;滤渣再加5倍的双蒸水,煮沸腾后再煮30 min,过滤,提取滤液B,弃去残渣。后将滤液A、B混合,过滤,以100℃水浴加热滤液,并浓缩至2.5 g/mL,1.25 g/mL,0.625 g/mL三个浓度,分装,置于4℃冰箱保存备用。
2.3 仪器全自动血液分析仪,型号:KX-21,SYSMEX公司。
2.4 方法
2.4.1 骨髓抑制模型的建立及动物分组 将C57/BL6小鼠适应性饲养7天后,随机分成正常组、模型组、阳性药物组、健脾补血方高、中、低剂量组,每组6只。除正常组外,其余各组均腹腔注射环磷酰胺(200 mg/kg)[5],复制小鼠骨髓抑制模型。
2.4.2 给药 完成化疗后给药,健脾补血方高、中、低剂量组分别给予健脾补血方(25 g/kg,12.5 g/kg,6.25 g/kg,分别相当于健脾补血方生药量)。以上中药剂量根据每日成人用量换算得出[6],12.5 g/kg为中剂量组,相当于成人临床的等效剂量,25 g/kg为高剂量组,6.25 g/kg为低剂量组。给药体积为10 mL/kg,连续7 d。阳性药物组予皮下注射小鼠集落刺激因子0.1 ml,正常组与模型组给予等容积的生理盐水,禁食24 h后采血检测。
2.4.3 指标检测 眼眶取血约0.5 ml,收集于肝素管中,-4℃保存备测。
2.5 统计学处理方法实验数据以均数±标准差(±s)表示,采用SPSS 19.0统计软件,多组间比较用单因素方差分析方法,两两比较用LSD检验,P<0.05为差异有统计学意义。
3 结果
3.1 健脾补血方对患者白细胞减少症状的影响
临床上,白细胞下降多发生于化疗后第7~14天,多数于第7~10天后开始回升,至第21天基本恢复正常水平。本研究采用《白细胞减少症症状分级量化表》,连续观察患者化疗后白细胞减少症状21天,其症状积分变化与白细胞下降趋势基本一致(如图1示)。
结果如表1、图1示,D2(化疗第1天),两组积分比较,差别无统计学意义(P>0.05);之后两组积分逐渐上升,对照组上升幅度大于治疗组(P<0.05)。D8(化疗第7天),两组积分达到最高值,对照组积分明显高于治疗组,具有统计学差异(P<0.05);之后两组积分逐渐下降,治疗组下降幅度大于对照组(P<0.05)。至D15(化疗第14天),两组积分比较仍有统计学差异(P<0.05);至D21(化疗第20天),患者白细胞基本恢复正常,症状基本消失,两组积分比较无统计学差异(P>0.05)。
表1 《白细胞减少症症状分级量化表》积分的比较(分,±s)Table 1 Comparisons of Scores of Leukopenia Symptom Classification Quantitative Table(Scores,±s)

表1 《白细胞减少症症状分级量化表》积分的比较(分,±s)Table 1 Comparisons of Scores of Leukopenia Symptom Classification Quantitative Table(Scores,±s)
注:采用重复测量方差分析,比较两组不同时点积分变化情况(D2、D8、D15、D21)。结果示:资料不满足Mauchly球形检验,不同时点积分有统计学差异(F=2 758.007,P<0.05);治疗组及对照组不同时点积分均有统计学差异(F值分别为749.260、3415.352,P<0.05);时间和分组因素存在交互作用,说明随着时间推移,组间积分变化趋势不一致(F=93.380,P<0.05)。采用独立样本t检验,比较同一时点两组积分。结果示:D8、D15两组积分比较,具有统计学差异(t值分别为13.449、13.456,P<0.05);D2、D21两组积分比较,均无统计学差异(t值分别为1.499、1.892,P>0.05)。
组别治疗组对照组F P D2(化疗第1天)25.73±3.75 27.30±4.32 1.499 0.139 D8(化疗第7天)28.30±3.89 39.10±2.06 13.449 0.000 D15(化疗第14天)5.60±4.80 24.37±5.94 13.456 0.000 D21(化疗第20天)2.17±1.39 2.77±1.04 1.892 0.064 749.260 3415.352<0.05<0.05 t P
白细胞下降多发生于化疗后第7~14天,故以D8(化疗第7天)、D15(化疗第14天)作为评价时点,对两组《白细胞减少症症状分级量化表》中的证候疗效进行比较。结果如表2、图2示,总有效率方面,治疗组为96.7%,对照组为73.3%,差别具有统计学意义(P<0.05);疗效分布方面,两组差别具有统计学差异(P<0.05)。
3.2 健脾补血方对患者血液分析的影响
参照《WHO临床试验常见毒副反应分级标准》,选择4个时点(治疗前、D8、D15、D21),观察比较两组白细胞(WBC)、中性粒细胞(NEU)、红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)变化。统计分析结果如下:

表2 《白细胞减少症症状分级量化表》疗效的比较(n,%)Table 2 Comparisons of the efficacy of the Quantitative Scale of Leukopenia Symptoms(n,%)

图1 《白细胞减少症症状分级量化表》积分变化趋势Fig.1 Trend of Integral Change of Leukopenia Symptom Grading Quantitative Table

图2 《白细胞减少症症状分级量化表》疗效分布Fig.2 The therapeutic effect distribution of Leukopenia Symptom Grading Quantitative Table
WBC:采用重复测量方差分析,比较两组不同时点WBC变化情况(治疗前、D8、D15、D21)。结果示:资料服从球形检验,表明不同时点WBC变化无关联关系;不同时点WBC有统计学差异(F=24.369,P<0.05);治疗组及对照组不同时点WBC均有统计学差异(F值分别为7.270、19.289,P<0.05);时间和分组因素无交互作用,说明随着时间推移,组间变化趋势一致(F=2.162,P<0.05)。采用独立样本t检验,比较同一时点两组WBC。结果示:D8、D15两组WBC比较,均具有统计学差异(t值分别为2.361、2.957,P<0.05);治疗前、D21两组WBC比较,均无统计学差异(t值分别为0.204、0.502,P>0.05)。
NEU:采用重复测量方差分析,比较两组不同时点NEU变化情况(治疗前、D8、D15、D21)。结果示:资料服从球形检验,表明不同时点NEU变化无关联关系;不同时点NEU有统计学差异(F=16.986,P<0.05);治疗组及对照组不同时点NEU均有统计学差异(F值分别为4.818、15.028,P<0.05);时间和分组因素无交互作用,说明随着时间推移,组间变化趋势一致(F=1.943,P>0.05)。采用独立样本t检验,比较同一时点两组NEU。结果示:D8、D15两组NEU比较,均具有统计学差异(t值分别为2.285、3.320,P< 0.05);治疗前、D21两组NEU比较,均无统计学差异(t值分别为0.593、0.152,P>0.05)。
RBC:采用重复测量方差分析,比较两组不同时点RBC变化情况(治疗前、D8、D15、D21)。结果示:资料服从球形检验,表明不同时间的RBC变化无关联关系;不同时点RBC无统计学差异(F=0.311,P>0.05);治疗组及对照组不同时点RBC均无统计学差异(F值分别为0.104、0.219,P>0.05);时间和分组因素无交互作用,说明随着时间推移,组间变化趋势一致(F=0.013,P>0.05)。采用独立样本t检验,比较同一时点两组RBC。结果示:任一时点(治疗前、D8、D15、D21)治疗组和对照组间均无统计学差异(t值分别为0.391、0.221、0.140、0.223,P>0.05)。
HGB:采用重复测量方差分析,比较两组不同时点HGB变化情况(治疗前、D8、D15、D21)。结果示:资料服从球形检验,表明不同时点HGB变化无关联关系;不同时点HGB无统计学差异(F=0.743,P>0.05);治疗组及对照组不同时点HGB均无统计学差异(F值分别为1.777、0.095,P>0.05);时间和分组因素无交互作用,说明随着时间推移,组间变化趋势一致(F=1.080,P>0.05)。采用独立样本t检验,比较同一时点两组HGB。结果示:任一时点(治疗前、D8、D15、D21)治疗组和对照组间均无统计学差异(t值分别为0.990、1.002、1.265、0.485,P>0.05)。
PLT:采用重复测量方差分析,比较两组不同时点PLT变化情况(治疗前、D8、D15、D21)。结果示:资料服从球形检验,表明不同时点PLT变化无关联关系;不同时点PLT无统计学差异(F=22.869,P>0.05);治疗组及对照组不同时点PLT均有统计学差异(F值分别为6.624、20.617,P<0.05);时间和分组因无交互作用,说明随着时间推移,组间变化趋势一致(F=2.598,P>0.05)。采用独立样本t检验,比较同一时点两组PLT计数。结果示:D8、D15两组PLT比较,差别均具有统计学差异(t值分别为2.137、4.046,P< 0.05);治疗前、D21两组PLT比较,无统计学差异(t值分别为0.208、1.336,P>0.05)。
结果如表3示,治疗前两组外周血白细胞、中性粒细胞、红细胞、血红蛋白、血小板比较,无统计学差异(P>0.05),组间具有可比性。
D8(化疗第7天),两组白细胞、中性粒细胞、血小板均较治疗前下降,对照组下降更为明显,与治疗组比较具有统计学差异(P<0.05)。
D15(化疗第14天),两组白细胞、中性粒细胞、血小板均明显回升,而治疗组计数明显高于对照组,具有统计学差异(P<0.05)。
D21天(化疗第20天),两组白细胞、中性粒细胞、血小板均恢复至正常范围,两组对比无统计学差异(P>0.05)。
两组红细胞、血红蛋白在观察期间均无明显变化;同一时点(D8、D15、D21)进行组间比较,无统计学意差异(P>0.05)。
3.3 C57/BL6小鼠化疗后一般状态模型组小鼠精神状态差,行动迟缓,活动较前明显减少,皮毛干枯、蓬松、无光泽。
3.4 各组C57/BL6小鼠给药前后体重的变化治疗前各组小鼠体重大致相同,无明显统计学差异(P>0.05)。给药后各组小鼠体重有明显变化,与正常组比较,模型组和低剂量组显著降低(P<0.05),阳性药物组和中剂量组明显降低(P<0.05);与模型组比较,阳性药物组和健脾补血方高、中剂量组显著升高(P<0.05);与阳性药物组比较,健脾补血方低剂量显著降低(P<0.05);与高、中剂量组比较,低剂量显著降低(P<0.05),说明健脾补血方能改善化疗后导致体重的异常下降,其中以健脾补血方高、中剂量组的作用最为显著,见表4。
表3 血液分析变化比较(±s)Table 3 Comparison of changes in blood analysis(±s)

表3 血液分析变化比较(±s)Table 3 Comparison of changes in blood analysis(±s)
注:采用重复测量方差分析,比较两组不同时点WBC、NEU、RBC、HGB、PLT变化情况(治疗前、D8、D15、D21);采用独立样本t检验,比较同一时点的组间差异,*P<0.05。
变量WBC(109/L)t P F P<0.05*<0.05*治疗组(30例)6.44±1.69 4.73±1.52 5.90±1.32 6.09±1.42 3.33±1.45 2.04±1.53 3.00±1.23 3.13±1.32 3.85±1.43 3.77±1.23 3.65±1.44 3.80±1.45 124.00±1.77 116.00±1.84 115.00±1.22 118.00±1.64 211.30±82.05 142.80±65.66 180.30±66.50 208.80±78.54 4.818 15.028对照组(30例)6.53±1.73 3.80±1.53 4.80±1.55 5.89±1.66 3.11±1.42 1.23±1.20 1.90±1.33 3.08±1.22 4.00±1.55 3.85±1.56 3.70±1.33 3.88±1.33 119.00±2.13 121.00±2.00 119.00±1.23 120.00±1.56 207.30±66.04 110.30±51.33 112.30±63.65 183.80±65.82 NEU(109/L)0.004<0.05*0.204 2.361 2.957 0.502 0.593 2.285 3.320 0.152 0.391 0.221 0.140 0.223 0.990 1.002 1.265 0.485 0.208 2.137 4.046 1.336 0.104 0.219 0.839 0.020 0.004 0.618 0.556 0.026 0.002 0.880 0.697 0.826 0.889 0.825 0.326 0.321 0.211 0.630 0.836 0.037 0.000 0.187 RBC(1012/L)0.957 0.883 7.270 19.289 HGB(g/L)1.777 0.095 0.158 0.963 PLT(109/L)时点治疗前D8 D15 D21治疗前D8 D15 D21治疗前D8 D15 D21治疗前D8 D15 D21治疗前D8 D15 D21 6.624 20.617<0.05*<0.05*
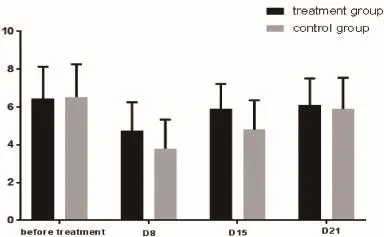
图3 白细胞计数Fig 3 WBC count

图4 中性粒细胞计数Fig 4 NEU count
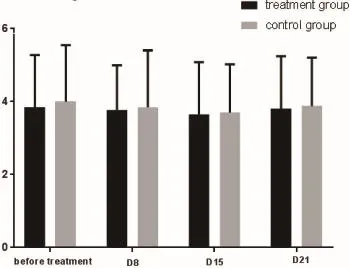
图5 红细胞计数Fig 5 RBC count

图6 血红蛋白计量Fig 6 HGB count

图7 血小板计数Fig 7 PLT count
3.5 健脾补血方对C57/BL6小鼠血液中红细胞数的影响与正常组比较,模型组、阳性药物组、健脾补血方各剂量组均显著下降(P均<0.05);与模型组比较,阳性药物组和健脾补血方高、中剂量组均显著升高(P<0.05);与阳性药物组比较,健脾补血方的高剂量组显著升高(P<0.05),低剂量组明显下降(P<0.05)。与高剂量组比较,中、低剂量组明显降低(P<0.05),说明健脾补血方能改善化疗后均导致血液中红细胞的异常下降,其中以高剂量组的作用最为显著,见表5。
表4 各组C57/BL6小鼠给药前后体重的变化(±s,n=6)Table 4 Change of the weight of the Jianpibuxue Decoction in C57/BL6 Mice(±s,n=6)

表4 各组C57/BL6小鼠给药前后体重的变化(±s,n=6)Table 4 Change of the weight of the Jianpibuxue Decoction in C57/BL6 Mice(±s,n=6)
注:与正常组比较,①P<0.05;与模型组比较,②P<0.05;与阳性药物组比较,③P<0.05;与高剂量组比较,④P<0.05;与中剂量组比较,⑤P<0.05。
给药后(g)22.37±0.48 20.27±0.44①21.62± 0.56①②22.15±0.30②21.63± 0.62①②20.48 ± 0.49①③④⑤组别正常组模型组阳性药物组高剂量组中剂量组低剂量组剂量/g·kg-1---2 5 12.5 6.25给药前(g)22.35±0.48 22.37±0.49 22.70±0.46 22.58±0.31 22.75±0.48 22.58±0.31
表5 健脾补血方对C57/BL6小鼠血液中红细胞数的影响(±s,n=6)Table 5 Effects of the number of RBC in blood cells of the Jianpibuxue Decoction in C57/BL6 Mice(±s,n=6)

表5 健脾补血方对C57/BL6小鼠血液中红细胞数的影响(±s,n=6)Table 5 Effects of the number of RBC in blood cells of the Jianpibuxue Decoction in C57/BL6 Mice(±s,n=6)
注:与正常组比较,①P<0.05;与模型组比较,②P<0.05;与阳性药物组比较,③P<0.05;与高剂量组比较,④P<0.05;与中剂量组比较,⑤P<0.05。
RBC×1012/L 9.05±0.76 3.43±0.58①4.53± 0.68①②5.87 ± 0.83①②③4.83 ± 0.62①②④3.63 ± 0.48①③④⑤组别正常组模型组阳性药物组高剂量组中剂量组低剂量组剂量g·kg-1---2 5 12.5 6.25
3.6 健脾补血方对C57/BL6小鼠化疗后血液中白细胞数的影响与正常组比较,模型组和健脾补血方各剂量组均显著降低(P<0.05);与模型组比较,阳性药物组和健脾补血方高、中剂量组均显著升高(P<0.05);与阳性药物组比较,健脾补血方各剂量组均明显降低(P<0.05),与低剂量组比较,高、中剂量组均显著升高(P<0.05),说明健脾补血方能改善化疗后血液中白细胞的数量,其中以高、中剂量组作用显著,见表6。
表6 健脾补血方对C57/BL6小鼠血液中白细胞数的影响(±s,n=6)Table 6 Effects of the number of WBC in blood cells of the Jianpibuxue Decoction in Mice(±s,n=6)
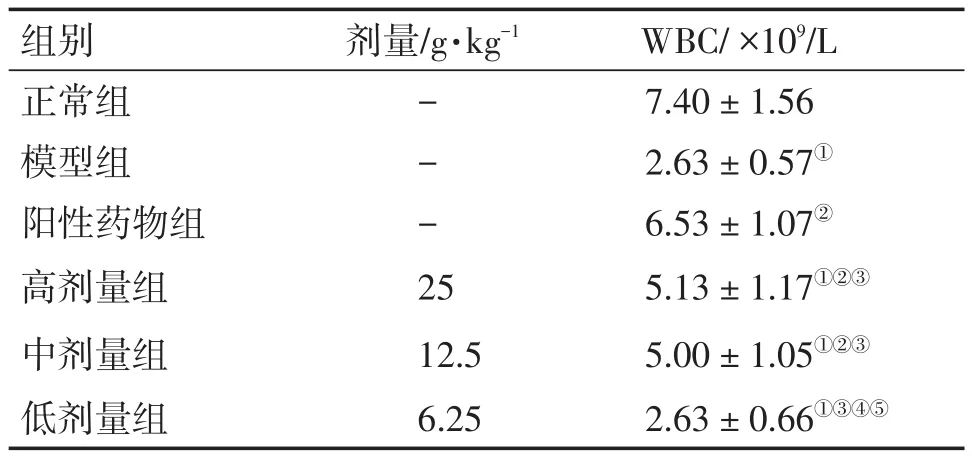
表6 健脾补血方对C57/BL6小鼠血液中白细胞数的影响(±s,n=6)Table 6 Effects of the number of WBC in blood cells of the Jianpibuxue Decoction in Mice(±s,n=6)
注:与正常组比较,①P<0.05;与模型组比较,②P<0.05;与阳性药物组比较,③P<0.05;与高剂量组比较,④P<0.05;与中剂量组比较,⑤P<0.05。
WBC/×109/L 7.40±1.56 2.63±0.57①6.53±1.07②5.13 ± 1.17①②③5.00 ± 1.05①②③2.63 ± 0.66①③④⑤组别正常组模型组阳性药物组高剂量组中剂量组低剂量组剂量/g·kg-1---2 5 12.5 6.25
3.7 健脾补血方对C57/BL6小鼠化疗后血液中血小板数的影响与正常组比较,模型组、阳性药物组和健脾补血方各剂量组均显著降低(P<0.05);与模型组比较,阳性药物组和健脾补血方高、中剂量组均显著升高(P<0.05);与阳性药物组比较,健脾补血方高、中剂量组显著升高(P<0.05),低剂量组显著降低(P<0.05);与低剂量组比较,健脾补血方高、中剂量组显著升高(P<0.05),说明健脾补血方可以提高小鼠化疗后血小板的数量,减轻骨髓抑制程度,其中以高、中剂量组作用非常显著,见表7。
表7 健脾补血方对C57/BL6小鼠血液中血小板数的影响(±s,n=6)Table 7 Effects of the number of PLT in serum of the Jianpibuxue Decoction in Mice(±s,n=6)

表7 健脾补血方对C57/BL6小鼠血液中血小板数的影响(±s,n=6)Table 7 Effects of the number of PLT in serum of the Jianpibuxue Decoction in Mice(±s,n=6)
注:与正常组比较,①P<0.05;与模型组比较,②P<0.05;与阳性药物组比较,③P<0.05;与高剂量组比较,④P<0.05;与中剂量组比较,⑤P<0.05。
PLT/×109/L 1312.67±79.42 402.83±57.53①601.00± 59.38①②1145.00 ± 71.55①②③766.50 ± 33.19①②③④414.00 ± 60.19①③④⑤组别正常组模型组阳性药物组高剂量组中剂量组低剂量组剂量/g·kg-1---2 5 12.5 6.25
3.8 健脾补血方对C57/BL6小鼠血液的中性粒细胞数的影响与正常组比较,模型组和健脾补血方各剂量组均显著降低(P<0.05);与模型组比较,阳性药物组和健脾补血方高剂量组均显著升高(P<0.05);与阳性药物组比较,健脾补血方高、中、低剂量组均明显下降(P<0.05);与中、低剂量组比较,高剂量组显著升高(P<0.05)。说明健脾补血方可以提高小鼠化疗后中性粒细胞的数量,其中以高剂量组作用非常显著,见表8。
表8 健脾补血方对C57/BL6小鼠血液的中性粒细胞数的影响(±s,n=6)Table 8 Effects of the number of PMN in serum of the Jianpibuxue Decoction in Mice(±s,n=6)

表8 健脾补血方对C57/BL6小鼠血液的中性粒细胞数的影响(±s,n=6)Table 8 Effects of the number of PMN in serum of the Jianpibuxue Decoction in Mice(±s,n=6)
注:与正常组比较,①P<0.05;与模型组比较,②P<0.05;与阳性药物组比较,③P<0.05;与高剂量组比较,④P<0.05;与中剂量组比较,⑤P<0.05。
PMN/×109/L 3.70±0.78 1.32±0.29①3.27±0.54②2.57 ± 0.59①②③1.83 ± 0.28①③④1.32 ± 0.33①③④组别正常组模型组阳性药物组高剂量组中剂量组低剂量组剂量/g·kg-1---2 5 12.5 6.25
4 讨论
本临床研究结果表1,表2,图1,图2显示,治疗组患者白细胞减少症状较对照组轻,症状恢复较对照组快,提示健脾补血方改善白细胞减少症症状的疗效优于对照组。从表3,图3-7结果提示,健脾补血方能有效防治化疗患者白细胞、中性粒细胞、血小板下降,而对红细胞、血红蛋白作用不明显,考虑与血细胞生存周期不同有关。粒细胞生存周期最短,约6~8小时;其次是血小板,约7~10天;红细胞平均生存周期最长,约120天。因此,化疗后骨髓抑制以白细胞、粒细胞及血小板的下降较为多见,而红细胞受化疗药物的影响较小,下降不明显。因此,临床观察健脾补血方具有改善化疗患者白细胞下降的不良反应。
动物实验研究结果显示,与正常组相比,模型组、阳性药物组和中药各剂量组的体重、白细胞、红细胞、血小板、中性粒细胞均明显下降,提示环磷酰胺对外周血细胞具有明显的破坏性。相关研究表明,乙酰苯肼和环磷酰胺联合给药不仅可以造成血细胞的大量破坏,同时可能对骨髓造血功能有明显的抑制作用[7]。经环磷酰胺诱导后,模型组小鼠血液细胞中红细胞、白细胞、血小板、中性粒细胞均显著降低,采用小鼠集落刺激因子作为阳性药物和健脾补血方高、中、低剂量组干预后,对其产生明显的调节作用。首先从表4可知,与模型组比较,阳性药物组和健脾补血方高、中、低剂量组的体重均有不同程度的上升,以高、中剂量组的作用最为显著,提示集落刺激因子与健脾补血方能明显改善环磷酰胺引起的营养不良,减少体重下降的发生,对机体产生保护作用,减少环磷酰胺对机体的损伤。
同时,健脾补血方对C57/BL6小鼠外周血细胞中的红细胞、白细胞、血小板、中性粒细胞数量同样起着重要的调节作用。从表5,表6,表7,表8可知,与模型组比较,阳性药物组和健脾补血方高、中、低剂量组血细胞中的红细胞、白细胞、血小板、中性粒细胞数有不同程度的升高,与健脾补血方各剂量组比较,高、中剂量组的改善作用较为显著。提示小鼠集落刺激因子和健脾补血方能够上调外周血细胞数,改善环磷酰胺诱导后的骨髓抑制,说明健脾补血方具有调节血细胞数量的作用,对机体具有一定的保护作用,减少化疗后骨髓抑制的作用。
我们前期研究发现[4],健脾补血方能下调肺癌小鼠化疗后血清EPO浓度,同时上调血清TPO、GM-CSF浓度,动态调节机体化疗后血清EPO、TPO、GM-CSF浓度的失衡状态。其中以中剂量组的作用最为突出,提示健脾补血方具有改善化疗后骨髓抑制的作用,对机体产生一定的保护作用。其作用机制可能与调节血清EPO、TPO、GM-CSF的浓度有关,从而促进机体造血功能的恢复。相关研究提示,中药能下调血清中造血因子异常升高的水平,达到自稳状态,从而促进骨髓抑制小鼠造血功能的恢复[8]。
本实验研究的自拟健脾补血方中含黄芪、五指毛桃、党参、当归、大枣等12味中药,均具有刺激造血机能,增加外周血细胞数,减轻化疗后骨髓抑制,保护骨髓造血功能的作用。近代药理研究显示,黄芪多糖能改善外周血象,提高化疗后小鼠的骨髓细胞数,提示黄芪多糖能修复环磷酰胺诱导的骨髓抑制[9,10]。黄芪多糖、党参皂甙可扶正固本,减轻化疗后骨髓抑制,能刺激造血机能,增强粒系造血。当归多糖能增加外周血红细胞、白细胞、血红蛋白及骨髓有核细胞数[10]。研究提示,大枣含多种氨基酸对骨髓造血功能有保护作用,对白细胞、血小板数、网织红细胞数和巨核细胞数下降有明显的回升作用[11]。其中大枣多糖能够升高骨髓中红系比例,促进骨髓有核增生,具有促进造血的功能。中药药理研究表明,中医药具有刺激造血机能,提升外周血细胞数,保护骨髓造血功能,改善骨髓抑制[12,13]。因此,本方具有健脾生髓功能,减少环磷酰胺对骨髓生血的破坏作用。
综合上述,通过临床观察和动物实验观察健脾补血方对肺癌化疗患者的症状评分及对C57/BL6小鼠化疗后的体重和外周血细胞中红细胞、白细胞、血小板、中性粒细胞数的影响,验证了健脾补血方能改善肿瘤患者化疗后白细胞下降的症状及血液细胞的减少;而且健脾补血方能上调环磷酰胺诱导的血液细胞下降,动态调节机体化疗后血液细胞中红细胞、白细胞、血小板、中性粒细胞数的失衡状态。其中以高、中剂量组的作用最为突出,进一步提示健脾补血方具有改善化疗后骨髓抑制的作用,对机体产生一定的保护作用。其作用机制可能与刺激骨髓造血干细胞的增殖分化,调节外周血细胞数,从而促进机体造血功能恢复有关。因此,本研究为健脾补血方进一步探索改善骨髓抑制可能的作用机制和临床推广应用提供科学依据。
