高效液相色谱-串联质谱法测定人血浆中色氨酸及其代谢物浓度
2019-08-14刘仪滨赖伟华钟诗龙
刘仪滨,陈 慧,朱 茜,赖伟华,杨 敏,钟诗龙*
0 引言
色氨酸(Tryptophan,TRP)是一种人体必需氨基酸,参与蛋白质合成,是多种重要生物活性分子的前体物质。色氨酸代谢保持稳态平衡对机体健康有重要意义。色氨酸在体内主要有3条代谢途径[1]:①犬尿氨酸途径产生犬尿氨酸(Kynurenine,KYN)及犬尿喹啉酸(Kynurenic acid,KYNA)等;②5-羟色胺途径;③肠道细菌降解途径生成吲哚以及含吲哚环的化合物如吲哚丙酸(Indole-3-propionic acid,IPA)[2]。研究表明,在心血管疾病患者中,色氨酸代谢出现失衡,如KYN代谢途径的增强会增加心血管疾病发生风险[3],血浆中低浓度的TRP、高浓度的KYN、KYNA与患者死亡和心血管事件风险增加显著相关[4-6]。犬尿氨酸类代谢物参与患者的免疫调节和血管扩张,是心血管疾病发生发展中关键的病理机制之一[7]。此外,色氨酸经生孢梭菌(Clostridium sporogenes)作用所生成的IPA是一种抗氧化剂和氢氧自由基清除剂,血浆中IPA降低与糖尿病和晚期动脉粥样硬化的发生有关[8-9]。此外,研究表明,IPA可减少神经元细胞的DNA损害和脂质过氧化,具有神经保护作用[10]。可见,色氨酸代谢途径在冠心病的发生发展中可能有着重要作用,而对色氨酸及其代谢物进行准确定量分析是对其深入研究的必要前提。
目前,国内外有多种同时测定血浆中色氨酸及其代谢物的报道,多用色谱方法与质谱分析联用,这是由于色谱具有强大的分离能力和对物质结构的解析鉴定能力。然而,一些已报道的方法存在一定局限性:①分析生物样品中内源性物质时,难以找到与之相对应的空白基质,使内源性化合物难以准确定量;采用有机溶剂[11]、含4%BSA的PBS缓冲盐溶液作为替代基质[12],均与血清等复杂生物基质存在一定的偏差。②测定基质效应时采用背景扣除法[11],不适用于样本中内源性代谢物本底值很高的情况。
基于此,本研究在以往研究的基础上,建立了同时准确定量人体血浆中色氨酸及其代谢物犬尿氨酸、犬尿喹啉酸和吲哚丙酸的方法,并将其应用于检测冠心病患者血浆中色氨酸及其代谢物水平。
1 材料与方法
1.1 药品与仪器 L-色氨酸,纯度:99%,百灵威科技有限公司。L-犬尿氨酸水合物,纯度:>98.0%(T),Aladdin。犬尿喹啉酸,纯度:99%,美国Sigma-Aldrich。3-吲哚丙酸,纯度:98%,百灵威科技有限公司。色氨酸-d5,纯度:98%,Toronto Research Chemicals。活性炭,100目,美国Sigma-Aldrich。甲醇,色谱纯,德国Merck公司。二甲基亚砜,分析纯,天津市北联化工品开发有限公司。甲酸:分析纯,美国Sigma-Aldrich。醋酸铵,色谱纯,美国Sigma-Aldrich。实验用水经超纯水仪(EMD Millipore,Billerica,美国)处理所得。API4000 QTrap 三重四极杆质谱仪(AB Sciex,美国),LC-20A高效液相色谱仪(Shimadzu,日本)。
1.2 受试者选择 本方案经广东省人民医院伦理委员会批准。所有受试者均签署知情同意书。共入选90例冠心病患者,男77例,女13例,年龄(61.30±10.57)岁。入选标准:经冠脉造影诊断狭窄程度大于50%;并行PCI术的患者。排除标准:年龄>80岁,肝功能异常(丙氨酸氨基转移酶>120 U/L),肾功能异常(血清肌酸酐>345 μmol/L)。
1.3 血浆样本采集 于清晨空腹下采集研究对象的静脉血5 ml于EDTA抗凝管中,于4 ℃ 低温,以3 000 r/min离心10 min,收集上层血浆,置于-80 ℃冰箱中保存。
1.4 测定方法
1.4.1 色谱条件 流动相为含0.2%甲酸和5 mmol/L醋酸铵的超纯水与甲醇(v/v,45/55);洗脱方式为等度洗脱;流速为0.3 ml/min;柱温为40 ℃;色谱柱采用Ultimate XB-C18HPLC柱(2.1 mm×100 mm,3 μm);进样量为4 μl;分析时间共3 min。
1.4.2 质谱条件 采用正离子电喷雾电离(ESI)模式,多反应监测(MRM)模式监测,电喷雾电压(IS)为5 500 V;气帘气压力(CUR)为25 psi;雾化气压力(GS1)为50 psi;辅助气压力(GS2)为50 psi;离子源温度(TEM)为550 ℃。多反应监测(MRM)模式监测反应质荷比(m/z):色氨酸(205.1→146.1),犬尿氨酸(209.1→94.1),犬尿喹啉酸(190.1→144.1),吲哚丙酸(190.4→129.7),色氨酸-d5(210.3→192.2)。色氨酸、犬尿氨酸、犬尿喹啉酸、吲哚丙酸及内标色氨酸-d5的去簇电压(DP)和碰撞能(CE)参数见表1。
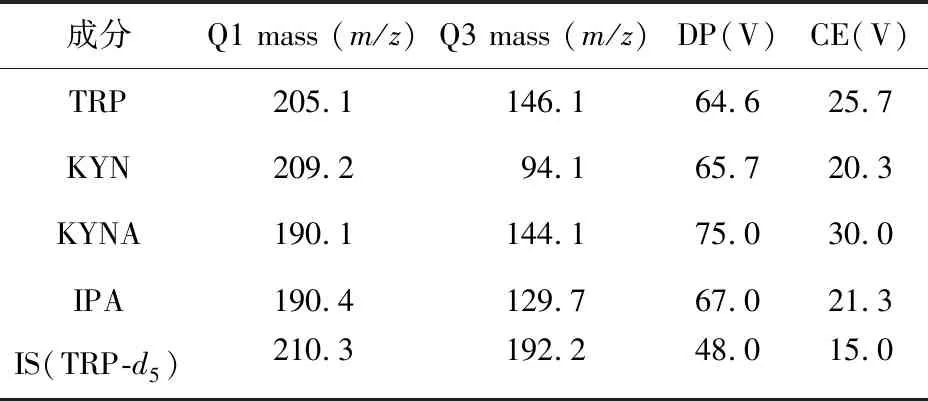
表1 色氨酸及其代谢物及内标的最佳质谱参数
注:DP,Declustering Potential;CE,Collison Energy;TRP,L-tryptophan;KYN,L-kynurenine;KYNA,kynurenic acid;IPA,3-indolepropionic acid;IS,internal standard;TRP-d5,tryptophan-d5。下同
1.4.3 标准溶液与内标溶液的制备 取色氨酸、犬尿氨酸、吲哚丙酸对照品适量,精密称定后分别加甲醇配制成1 mg/ml的储备液。取犬尿喹啉酸对照品适量,精密称定后加甲醇/DMSO(v/v,90/10),配制成20 μg/ml储备液。取色氨酸-d5对照品适量,精密称定后加甲醇配制成200 μg/ml的储备液作为内标物,使用时用甲醇进行稀释,配制色氨酸-d5质量浓度为20 μg/ml的内标溶液。所有溶液避光保存于-20 ℃下。
1.4.4 血浆样品预处理 取50 μl的血浆,置于1.5 ml EP管中,加入20 μg/ml色氨酸-d5内标溶液10 μl,再加入150 μl冰冷的甲醇/乙腈(v/v,50/50)沉淀蛋白,涡旋混合5 min后,于-20 ℃下放置20 min使蛋白沉淀完全。于4 ℃,14 000 r/min下离心15 min,取上清液100 μl到96孔板中,进行LC-MS/MS分析。
1.4.5 空白血浆的制备 取10 ml血浆加入1.0 g活性炭,冰浴条件下用磁力搅拌器搅拌6 h后,低温4 ℃下,14 000 r/min离心15 min后取上清液,再经由0.22 μm微孔滤膜过滤2次,得到空白血浆。血浆样本来自于健康志愿者。
1.5 方法学验证
1.5.1 专属性 分别取50 μl空白血浆,按“血浆样本预处理”项操作,得空白血浆色谱图。取空白血浆40 μl加入含4个物质的混合对照品溶液10 μl,涡旋后,按“1.4.4”项操作处理血浆,得分析物色谱图。
1.5.2 标准曲线和定量下限 取空白血浆40 μl,分别加入色氨酸、犬尿氨酸、犬尿喹啉酸、吲哚丙酸的混合对照品工作液10 μl,配制成色氨酸质量浓度分别为100、200、500、1 000、2 000、5 000、10 000、20 000 ng/ml,犬尿氨酸质量浓度分别为25、50、125、250、500、1 250、2 500、5 000 ng/ml,犬尿喹啉酸质量浓度分别为5、10、25、50、100、250、500、100 ng/ml,吲哚丙酸质量浓度分别为10、20、50、100、200、500、1 000、2 000 ng/ml的含药血浆样品,按“1.4.4”项操作。分别以待测物的质量浓度为横坐标x,以药物与内标峰面积的比值为纵坐标y,用加权最小二乘法进行线性回归分析(权重系数为1/x2)。
1.5.3 精密度和准确度 取空白血浆40 μl,分别加入含4个待测物的最低定量限(LLOQ)、低、中、高4个浓度的对照品工作液各10 μl,制成色氨酸质量浓度分别为100、200、2 000、15 000 ng/ml,犬尿氨酸质量浓度分别为25、50、500、3 750 ng/ml,犬尿喹啉酸质量浓度分别为5、10、100、750 ng/ml,吲哚丙酸质量浓度分别为10、20、200、1 500 ng/ml的质控血浆样品,按“1.4.4”项操作。每种质量浓度各平行6次,连续测定3 d。根据当日的标准曲线,计算质控样品的测定浓度。精密度通过测量值的相对标准偏差(RSD)来判定;准确度通过相对误差(RE)=(测量值-真实值/真实值)×100%来判定。
1.5.4 提取回收率和基质效应 分别考察低、中、高3种浓度质控血浆样品的回收率和基质效应,每种浓度平行制备6份样本,且每份样本所用的空白血浆分别来自6个不同健康志愿者。分别配制含色氨酸、犬尿氨酸、犬尿喹啉酸、吲哚丙酸的低、中、高3种质量浓度的质控血浆样品,按“1.4.4”项操作,得到峰面积A;将空白血浆按“1.4.4”项进行前处理,取上清液,分别加入色氨酸、犬尿氨酸、犬尿喹啉酸、吲哚丙酸的混合对照品溶液配制成低、中、高3种浓度的质控样品,加入内标工作液,涡旋混匀后,进样分析得峰面积B;色氨酸、犬尿氨酸、犬尿喹啉酸、吲哚丙酸的混合对照品溶液用纯溶液甲醇/水(v/v,50/50)配制成低、中、高3种浓度的质控样品,加入内标工作液,进样分析得到峰面积C。提取回收率=A/B×100%,绝对基质效应=B/C×100%,IS-校正基质效应=分析物-绝对基质效应/IS-绝对基质效应。
1.5.5 稳定性 分别考察低、中、高3种浓度的含药血浆样品,分别考察在室温放置8、24 h内,于-80 ℃反复冻融3次和进样器中放置19 h条件下的稳定性。每种浓度样品平行6次。
2 结果
2.1 方法学评价
2.1.1 专属性 色氨酸及其代谢物在正离子模式下的信号强于负离子模式下的信号,故采用正离子模式扫描。在全扫描模式下,将[M+H]+确定为母离子,根据强的丰度和基质对其干扰小的原则选择定量子离子,采用多反应检测(MRM)模式同时定性检测5种物质的母离子和子离子,经过多次扫描,选定定量离子对205.1→146.1(TRP),209.1→94.1(KYN),190.1→144.1(KYNA),190.4→129.7(IPA),210.3→192.2(TRP-d5),其二级扫描质谱图如图1所示。在该条件下,分别得空白血浆、空白血浆+对照品溶液的色谱图,如图2所示。TRP、KYN、KYNA、IPA以及内标TRP-d5保留时间分别为1.07、1.03、1.24、2.39、1.06 min,峰形良好,目标化合物和内标物出峰处不受杂质或血浆中内源性物质干扰,显示出该方法条件下5种分析物的特异性好。
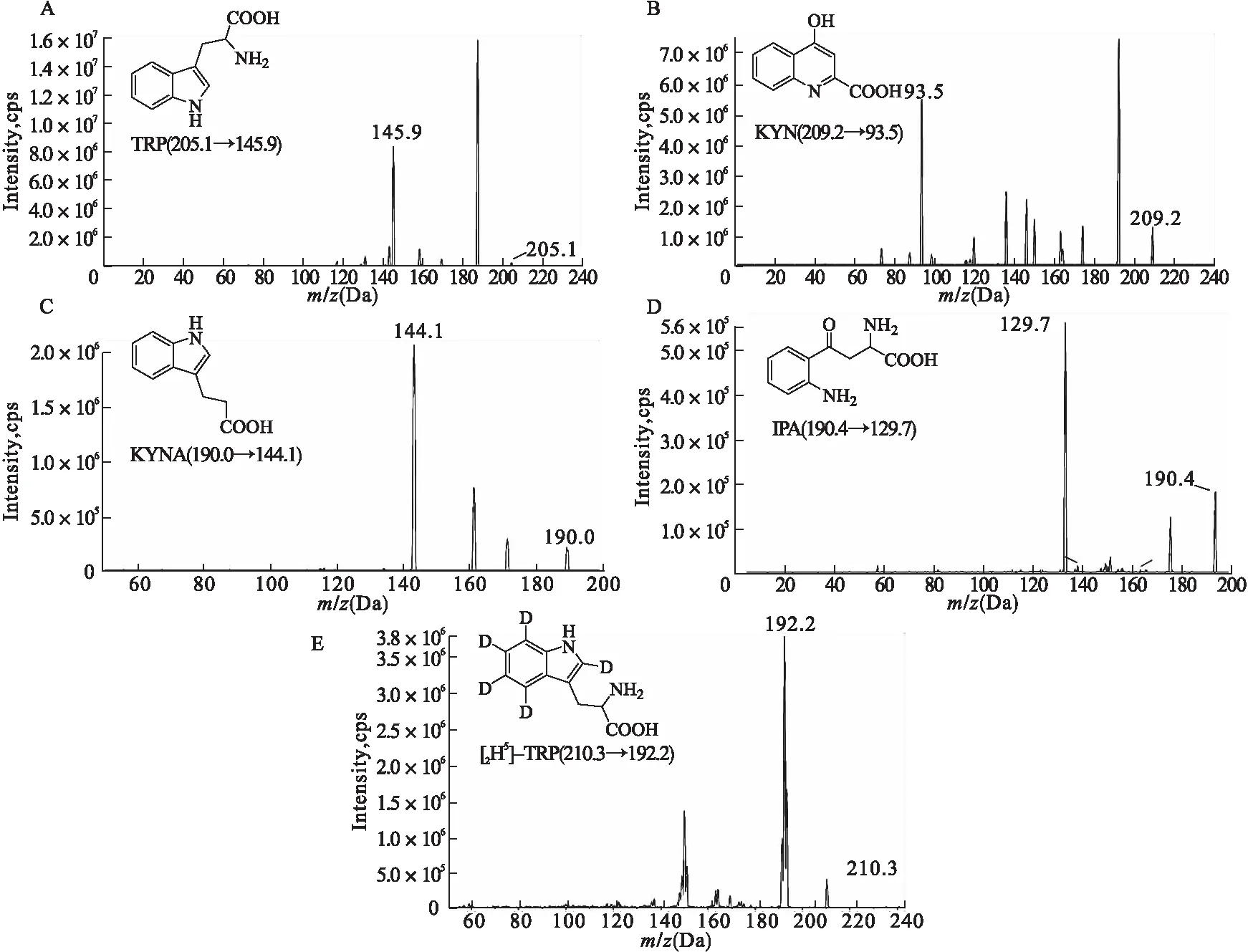
图1 各化合物结构式及其二级全扫描质谱图
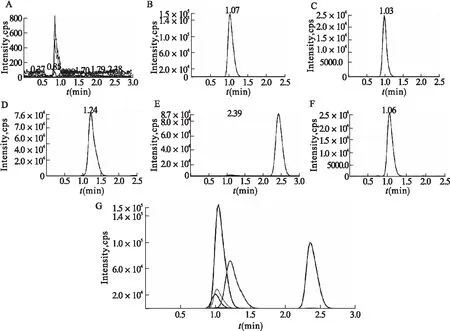
图2 各化合物色谱图
2.1.2 标准曲线和定量下限 色氨酸的标准曲线为y=1.18×10-3x-1.83×10-2(r=0.998 9),线性范围为100~20 000 ng/ml;犬尿氨酸y=5.54×10-4x-1.7×10-3(r=0.999 0),线性范围为25~5 000 ng/ml;犬尿喹啉酸y=2.37×10-2x+4.52×10-2(r=0.998 4),线性范围为5~1 000 ng/ml;吲哚丙酸y=1.52×10-2x-5.12×10-3(r=0.999 5),线性范围为10~2 000 ng/ml。
2.1.3 精密度和准确度 LLOQ的色氨酸、犬尿氨酸、犬尿喹啉酸、吲哚丙酸质控样品的日内、日间精密度(RSD)均小于20%,准确度(RE)满足±20%的要求;低、中、高3种浓度的色氨酸、犬尿氨酸、犬尿喹啉酸、吲哚丙酸 质控样品的日内、日间精密度(RSD)均小于15%,表明重复性良好,相对误差(RE)满足±15%的要求,表明准确度良好。结果见表2。
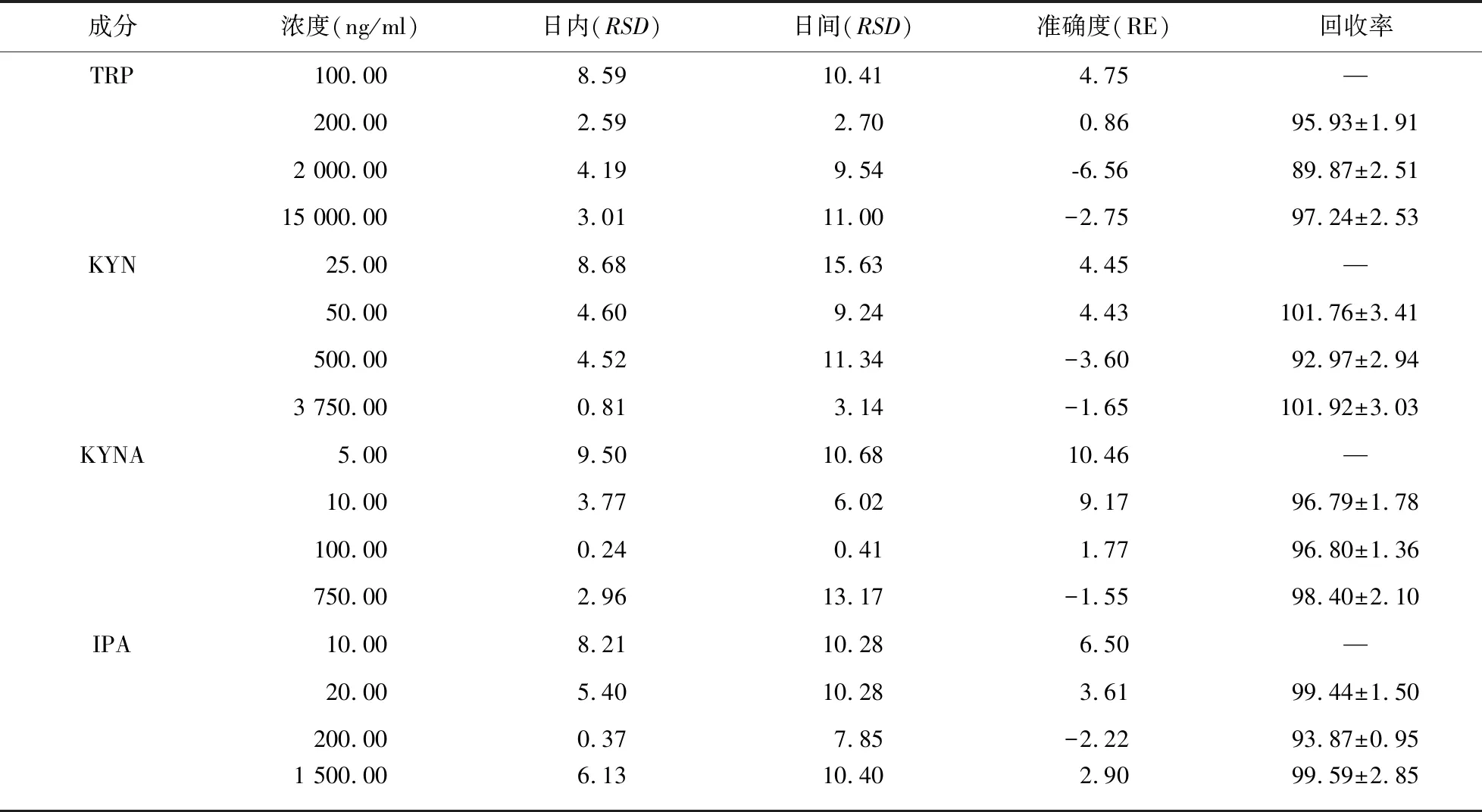
表2 定量分析血浆色氨酸及其代谢物犬尿氨酸、犬尿喹啉酸、吲哚丙酸的精密度、准确度和提取回收率(%)
2.1.4 提取回收率和基质效应 分别考察4种分析物低、中、高3种浓度质控样品和内标物的提取回收率和基质效应。结果显示,TRP、KYN、KYNA、IPA的平均提取回收率分别为94.35%、98.88%、97.33%、97.64%,回收率均>90%。6份不同来源样本之间低、中、高3个浓度的TRP、KYN、KYNA和IPA的平均绝对基质效应分别为88.19%±4.97%、79.85%±7.93%、798.93%±82.58%、106.23%±4.09%,CV均<15;6份不同来源样本之间IS-校正基质效应平均值分别为105.56%±4.69%、95.45%±4.33%、953.87%±60.48%%、127.43%±9.05%,CV均<15%。内标色氨酸-d5的平均回收率108.40%,CV为1.08%;平均基质效应83.55%,CV为6.39%。提取回收率结果见表2,基质效应结果见表3。
2.1.5 稳定性 结果表明,低、中、高3种浓度的色氨酸、犬尿氨酸、犬尿喹啉酸、吲哚丙酸质控样品在室温放置8 h,RSD在2.49%~11.77%;24 h内反复冻融3次,RSD在2.23%~8.41%;在自动进样器内放置19 h,RSD在1.17%~11.47%,稳定性良好。结果见表4。
2.2 方法学的应用 用本文建立的LC-MS/MS方法测定90例冠心病患者于清晨空腹下采集得血浆样本中色氨酸、犬尿氨酸、犬尿喹啉酸和吲哚丙酸的浓度。测得血浆中色氨酸浓度为(9 466.64±1 947.95) ng/ml,犬尿氨酸浓度为(427.03±127.86) ng/ml,犬尿喹啉酸浓度为(11.50±3.44) ng/ml,吲哚丙酸浓度为(439.88±375.69) ng/ml。色氨酸、犬尿氨酸、犬尿喹啉酸以及吲哚丙酸在血浆中的浓度分布情况,见图3。
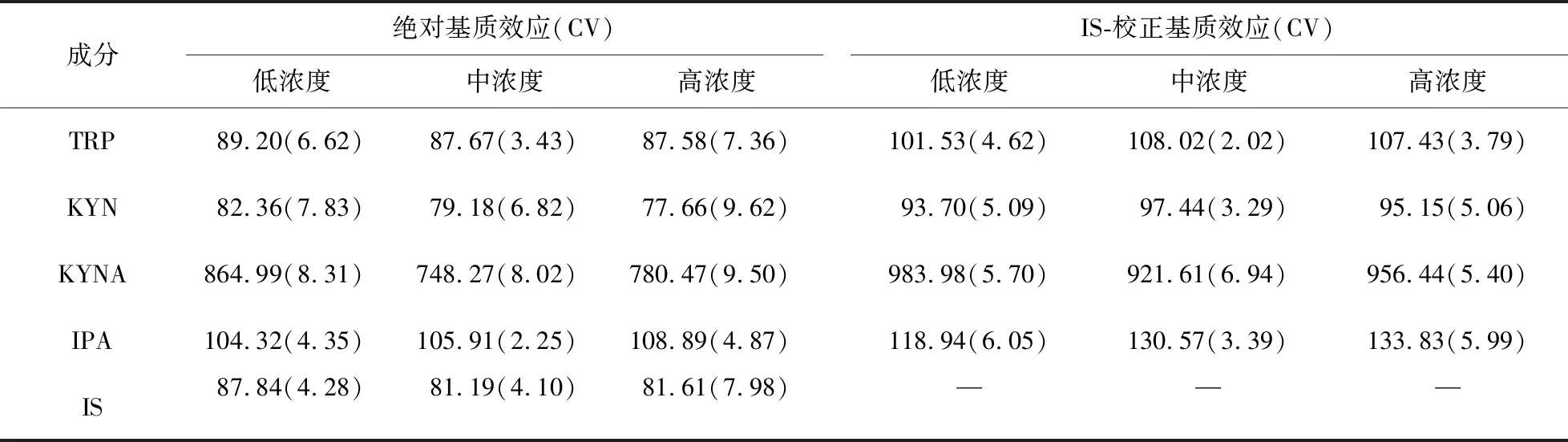
表3 血浆中色氨酸及其代谢物犬尿氨酸、犬尿喹啉酸、吲哚丙酸的基质效应

表4 血浆中色氨酸及其代谢物犬尿氨酸、犬尿喹啉酸、吲哚丙酸的稳定性(%)

图3 90例冠心病患者血浆浓度分布图
3 讨论
本研究采用高效液相色谱-串联质谱法建立了一种简单、快速、灵敏、血浆消耗量少的准确定量测定色氨酸及其代谢产物犬尿氨酸、犬尿喹啉酸和吲哚丙酸的方法,该方法成功应用于测定90例冠心病患者血浆中色氨酸其代谢物的血浆浓度。
3.1 生物样本前处理及分析时间 本研究样品前处理操作简便,分析时间短,具有高通量的优势,有利于大样本量的测定。使用甲醇/乙腈(v/v,50/50)沉淀血浆中的蛋白,并在-20 ℃放置一定时间使蛋白沉淀更为完全,样品处理步骤简便,效率高,灵敏度满足分析要求,重现性好。色氨酸及其3种代谢物全部出峰时间仅为3 min,峰形良好且无内源性杂质干扰,特异性良好。在4个待测物中,吲哚丙酸在人血浆中的分析方法及应用目前报道较少。
3.2 内标物的选择 本研究选用氘代色氨酸作为内标物,一定程度上校正基质效应,以提高定量分析的准确性和重现性。与其他和待分析物结构相似的内标物相比,同位素标记的内标物有着和待分析物相同的化学性质,干扰基质对它们的离子化影响相近,能够最小化稳定性、提取回收率或离子化效率所带来的问题[13]。然而,这种方法的主要缺点是同位素标记的内标成本高昂和最合适的同位素标记的内标物难以获得。因为色氨酸及其代谢物在化学结构上具有一定的相似性,故使用氘代色氨酸作为内标物,可在一定程度上减少样品前处理以及离子化过程造成的误差。
3.3 色谱条件的选择 在水-甲醇的流动相中加甲酸和醋酸铵,以维持体系处于酸性条件下,可获得良好的峰形,并增加待测物的离子化从而提高响应。选择流动相时,以乙腈和水作为流动相时,各分析物的响应不如以甲醇和水为流动相好,且峰形较宽。色氨酸及其代谢物虽然有着不同的物理化学性质(不同的亲水性或亲脂性),但相同之处在于所有的分子都是相对疏水的结构,都包含吲哚环或是苯环结构,不同的官能团(羧基、羟基、氨基)改善了分子的亲水性,并且有助于其离子化,使得质谱响应提高[14]。因此,流动相的pH值对于分子的保留行为是一个很重要的因素。基于此,采用在水-甲醇的流动相中加甲酸(0.2%)和醋酸铵(5 mmol/L)以维持体系处于酸性条件下(pH值为2~3),峰型良好。甲酸的加入使得各物质保留时间稍延长,且各物质分离效果更好,并在一定程度上增加离子化。
3.4 空白基质的选择及基质效应 采用“活性炭吸附法”,吸附除去血浆中内源性的色氨酸及其代谢物,使基质更接近原生物基质,使其成为替代基质用于构建标准曲线,提高定量分析结果的准确性。因为色氨酸及其代谢物属于血浆中的内源性物质,难以找到与之相对应的空白基质。文献报道的血浆的替代基质有纯水、有机溶剂、含4%BSA的10 mmol/L磷酸盐缓冲溶液、活性炭吸附处理后的基质等[15]。犬尿喹啉酸在本实验条件下有基质增强效应,但是在6份来自不同健康志愿者的血浆样本中基质效应结果均显示增大(CV<15%),且低、中、高3种浓度之间的绝对基质效应和内标归一化基质效应的CV均小于15%,符合《生物样品分析方法验证指南》和《中国药典》2015版第4部通则9012生物样品定量分析方法验证指导原则所规定的6批基质计算的内标归一化的基质因子的变异系数不得大于15%的要求[16],因而该方法能够应用于血浆样本中犬尿喹啉酸的浓度水平的分析。
3.5 色氨酸及其代谢物的血浆浓度测定 与文献报道的测定值相比[17-18],色氨酸和犬尿氨酸的测定结果与报道值接近;犬尿喹啉酸测定结果则偏高,一方面可能是实验条件的不同(空白基质和内标物的选用、样品的前处理、标准曲线的构建等),另一方面可能是受试者疾病状态和总样本量的不同,导致测定结果的差异。在冠心病患者群体中,吲哚丙酸的血浆浓度水平分布离散,个体差异性较大。
本方法可用于人血浆中色氨酸及其代谢物犬尿氨酸、犬尿喹啉酸和吲哚丙酸的定量分析,探究色氨酸及其代谢物的动态变化规律与生物过程的联系,对于有效靶点标志物的寻找、相关疾病的诊断、病情监测等方面具有重要意义。
