HA纳米颗粒对HepG2细胞冷冻干燥效果的影响
2019-08-14李维杰刘宝林周新丽
袁 俊, 李维杰, 刘宝林, 周新丽, 宋 萍
(上海理工大学 医疗器械与食品学院 上海 200093)
近年来,随着细胞移植、组织工程和遗传技术的发展,活细胞正成为临床医疗中重要的治疗手段[1-2],如何实现细胞的长期保存成为当下的热门话题。细胞经冷冻干燥后可在常温下长期保存,受周围环境的影响较小,且在运输过程中不需要特殊的储藏设备。因此,将细胞冻干保存成为一种新的保存方法,这种方法也得到了各国研究人员的关注。
当材料达到纳米尺寸时,其物理化学性质相较于宏观物质具有很大的不同。将纳米颗粒添加到冷冻保护剂中,提高细胞存活率,这方面的研究已取得一些成果。纳米颗粒作为一种新型材料在生物医药领域已被广泛使用,并因其具有一些特殊的性质,在低温生物领域被大量研究。根据纳米颗粒的小尺寸效应,颗粒尺寸越小,表面能越大,其强大的表面能会与溶液物质相互作用,从而影响溶液的稳定性及溶质的分散性,间接地影响溶液的黏度[3]和导热效果。根据纳米颗粒对溶液性质的影响,唐临利等[4]将SiO2纳米颗粒加入到丙三醇溶液中,发现随着溶液中纳米颗粒浓度的增加,丙三醇溶液的导热系数也随之提高。另外,降温过程中纳米颗粒具有辅助成核、降低过冷、改变玻璃化和反玻璃化温度等性质。Han等[5]通过DSC来研究不同纳米颗粒对多元醇的过冷度及反玻璃化温度的影响,发现溶液中添加纳米颗粒后,溶液成核时的过冷度显著降低,且在溶液的复温过程中反玻璃化温度也有所下降。他们的结论与高志新等[6]的研究结果相似,在PVP低温保护剂中添加HA纳米颗粒后,溶液的玻璃化温度和反玻璃化温度都随着纳米颗粒浓度的增加而降低。根据以上研究结果显示,纳米颗粒在生物样本的低温保存中能够起到积极的作用。李维杰等[7]将不同浓度、不同粒径的HA纳米颗粒添加到冷冻保护剂中,探索低温保存对猪卵母细胞的影响,结果发现,质量浓度为0.5 g/L的60 nm的HA纳米颗粒可以减少复温过程中的再结晶,提高猪卵母细胞的低温保存效果。
冻干过程比低温保存更加复杂,需要经历冷冻、升华干燥和复水3个过程,其中每个过程都会对细胞的存活率造成影响。目前,冻干保护剂对细胞的作用机理主要有两种:“玻璃态”假说[8]和“水替代”假说[9]。这两种假说的作用基础是溶液实现部分或完全玻璃化。纳米颗粒可以提高溶液黏度[3],纳米冻干保护剂有可能增强溶液的玻璃化程度,从而提高冷冻干燥过程中细胞的存活率。另外,界面层效应可以显著增强纳米流体的有效热导率[10],缩短溶液的相变时间,减轻冷冻和干燥过程对细胞的伤害。本文尝试将HA纳米颗粒添加到冻干保护剂中,研究在静置、冷冻、干燥和复水各个阶段纳米冻干保护剂对HepG2细胞回收率、存活率和24 h贴壁率的影响。
1 材料和方法
1.1 实验设备与材料
1.1.1 主要仪器和设备
真空冷冻干燥机,Advantage 2.0 Benchtop Freeze Dryer(美国SP Industries公司);二氧化碳培养箱(日本松下MCO 18AC);低速台式离心机(上海安亭科学仪器厂);低温台(BCS196 Biological Cyro-stage);BX51TRF 显微镜(Olympus,日本)。
1.1.2 主要材料与试剂
实验材料:人肝癌细胞HepG2(购于中科院)
主要试剂:胎牛血清(FBS)(上海博升生物科技有限公司);胰蛋白酶(上海励瑞生物科技有限公 司 ) ; Dulbecco’s Modified Eagle Medium(DMEM)培养基、青霉素和链霉素(双抗)、D-hank’s(上海靳弘生物科技有限公司);台盼蓝染色液(2X)(碧云天生物技术公司);等渗磷酸盐缓冲液(PBS,pH 7.4)、聚乙烯吡咯烷酮(PVP)、海藻糖、丙三醇(国药集团化学试剂有限公司);羟基磷灰石(HA)纳米颗粒(南京埃普瑞纳米材料有限公司)
1.2 实验方法与步骤
1.2.1 HepG2细胞的收集
取7个长满细胞的培养瓶,用移液枪吸掉培养瓶中的培养基,加2 mL的D-hank’s清洗液清洗2遍,再在培养瓶中加入1 mL的胰蛋白酶消化3 min左右,放在显微镜下观察,当细胞呈现光亮的圆粒状且在溶液中漂浮时,加入2 mL的培养基终止消化,用移液枪吹打培养瓶上的细胞,并将所有的细胞液转移到离心管中离心(转速为1 000 r/min,离心4 min),倒掉上清液,收集细胞备用。
1.2.2 纳米冻干保护剂的配置
通过前期对HepG2细胞冻干实验的探索,选用胎牛血清(FBS)、聚乙烯吡咯烷酮(PVP)、海藻糖和丙三醇作为冻干保护剂的主要成分,其中保护剂中含体积分数为15%的FBS,体积分数为10%的丙三醇,质量浓度为400 g/L的PVP,质量浓度为200 g/L的海藻糖,其余为DMEM培养液。称取一定质量的HA纳米颗粒于配置好的保护剂中,搅拌均匀,最终使得保护剂中纳米颗粒的质量浓度分别为 0,0.1,0.3,0.5,0.7,1,5 g/L。
1.2.3 冻干悬浮液的配置
在收集的细胞中加入一定量的DMEM培养基,吹打1 min,使细胞在培养基中均匀分散,每组按照1∶4的比例,吸取0.2 mL细胞悬液于0.8 mL的纳米低温保护剂中,混合均匀,转移到5 mL的西林瓶中准备冻干。
1.2.4 纳米颗粒对细胞的毒性实验
为了验证HA纳米颗粒对HepG2细胞活性的影响,进行了以下的毒理实验:在7组含有细胞的培养基中添加不同浓度的HA纳米颗粒并培养24 h,然后对细胞的贴壁率进行检测。
1.2.5 纳米冻干保护剂对细胞活性实验
保护剂在一定程度上都会对细胞产生影响,在细胞进行冷冻之前必须先研究纳米冻干保护剂对细胞的损伤情况。将不同质量浓度的纳米冻干保护剂与细胞液均匀混合后静置1 h,然后测其回收率、存活率和24 h贴壁率。
1.2.6 HepG2细胞的冷冻实验
降温阶段纳米颗粒会对冰晶形成产生影响,将不同质量浓度的纳米冻干保护剂与细胞的混合液置于-80 ℃的冰箱中4 h,然后取出,再在37 ℃的水浴锅中快速复温,测其回收率、存活率和24 h贴壁率。
1.2.7 HepG2细胞的冻干流程
样品冻结时,隔板温度设置为-70 ℃,停留4 h;一次干燥温度设置为-45 ℃,持续24 h,压力为5 Pa;二次干燥温度设置为20 ℃,持续时间10 h,压力为5 Pa。
1.2.8 纳米颗粒复水液复水冻干细胞
细胞与无纳米颗粒的冻干保护剂混合均匀后分成相同的7组于冻干机中冻干,将2 mL含不同质量浓度的纳米颗粒等渗磷酸盐缓冲溶液(PBS)加入到冻干的样品中,在37℃的水浴锅内轻轻晃动,直至冻干样品全部溶解。
1.2.9 冻干细胞回收率的检测
冻干细胞复水后使用血球计数板计算细胞数,冻干细胞回收率按式(1)计算:

1.2.10 冻干细胞存活率的检测
取10 μL复水后的细胞液与10 μL的台盼蓝混合均匀,滴在血球计数板上,在显微镜上分别对活细胞和死细胞计数,活细胞无色透明,死细胞会被染成蓝色,细胞的存活率按式(2)计算:

1.2.11 贴壁率的检测
将复水后的细胞转移到离心管中离心(转速为1 000 r/min,离心4 min),倒掉上清液,加入4 mL的DMEM培养基吹打均匀,转移到培养皿中,于37 ℃、体积分数为5%的CO2培养箱中培养24 h。24 h后,收集培养基和D-hank’s清洗液于离心管中,并对液体中的细胞计数,为未贴壁细胞。接着在培养皿中加入0.5 mL左右的胰蛋白酶消化,加入2 mL的DMEM培养基,吹打均匀并对溶液中的细胞计数,为贴壁细胞。细胞的贴壁率按式(3)计算:

2 结果与讨论
2.1 培养过程中HA纳米颗粒对细胞24 h贴壁率的影响
将不同质量浓度的纳米颗粒同细胞一起培养24 h后发现,随着纳米颗粒质量浓度的增加,贴壁率逐渐下降,当质量浓度低于0.5 g/L时,纳米颗粒对细胞的影响较小。当质量浓度高于0.5 g/L时,细胞的贴壁率显著下降,其结果如图1所示(柱状图中各组之间含有不同字母,则说明相互具有显著性差异(P<0.05);如果含有相同字母,则相互没有显著性差异(P>0.05))。高质量浓度的纳米颗粒会影响细胞的生长和传代,这是由于颗粒的小体积效应能够吸附培养基中的化学成分,影响培养基的营养组成和pH,从而阻碍细胞的正常生长。纳米颗粒进入细胞内部时会与细胞器、染色体等相结合,影响细胞的发育[11],而且大量的纳米颗粒会嵌入细胞膜内,从而改变膜的结构和生理功能[12],导致细胞的死亡。
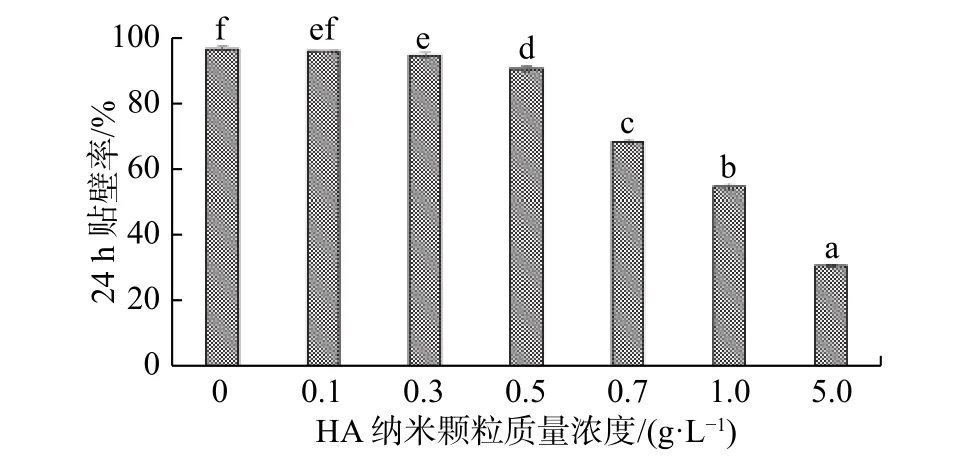
图 1 含不同质量浓度纳米颗粒的细胞培养24 h后其贴壁率Fig.1 Adherence rate of cells with different mass concentrations of nanoparticles after 24 h culture
2.2 冷冻之前纳米颗粒对细胞的影响
细胞置于纳米冻干保护剂中1 h后细胞的活性发生很大变化,细胞的回收率(81.3%)和存活率(85.63%)都有所降低,将回收后的细胞进行24 h培养,结果发现细胞的贴壁率(71.06%)显著下降,正如图2显示。当保护剂与细胞液混合后,由于高浓度保护剂渗透压较大,使得细胞严重脱水,造成细胞膜的损伤和细胞内某些蛋白质的变性,最终导致细胞的死亡[13]。当冻干保护剂中纳米颗粒的质量浓度低于0.5 g/L时,各组之间的回收率和24 h贴壁率都没有显著性差异。但随着保护剂中纳米颗粒质量浓度的增加,细胞的回收率、存活率和24 h贴壁率都显著下降,其中可能的原因为:a. 纳米颗粒具有杀死细胞的作用,保护剂中纳米颗粒的浓度越高,细胞表面吸附的纳米颗粒也越多,在一定程度上改变或破环细胞膜原有的结构,使得细胞不能进行正常的生理代谢,从而造成细胞的死亡;b. 由于纳米颗粒具有较强的表面活性,当纳米颗粒黏附在细胞膜表面时,可能发生强的氧化作用,改变组成细胞膜的脂质分子[14]和蛋白质[15],对细胞活性造成损伤。
2.3 冷冻过程中纳米颗粒对细胞的影响
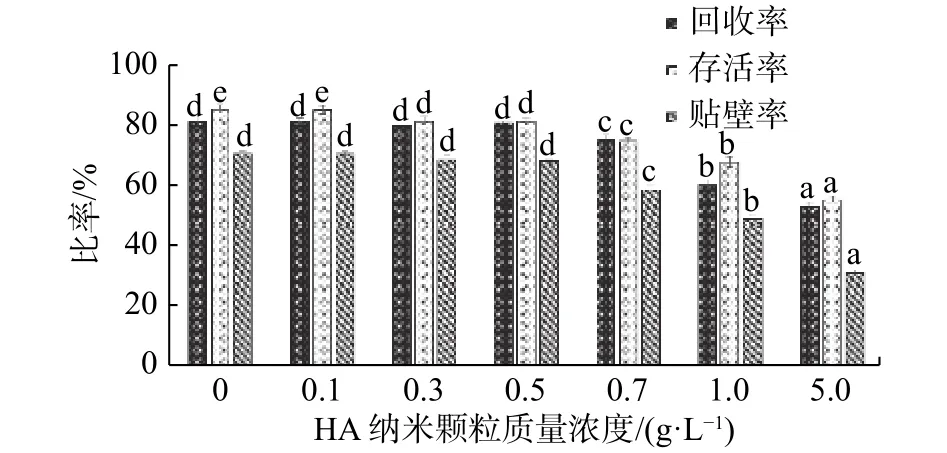
图 2 细胞在含有不同质量浓度纳米冻干保护剂中1 h后其回收率、存活率和24 h贴壁率Fig. 2 Recovery rate, survival rate and 24 h adherence rate of cells after 1 h in protective agent containing different mass concentrations of nanoparticles
将细胞与纳米冻干保护剂均匀混合,于-80℃冰箱中冷冻4 h,然后取出在37 ℃的环境下复温。结果发现,随着保护剂中纳米颗粒浓度的增加,细胞的回收率和存活率都有所提高,当纳米颗粒质量浓度为0.5 g/L时,细胞的回收率(70.13%)和存活率(72.37%)达到最大值,与其他组之间都有显著性差异。由图3显示,随着浓度的继续增加,细胞的回收率和存活率都显著下降。在降温过程中,保护剂中的纳米颗粒具有辅助成核的作用,能够促进冰晶的形成,降低过冷度,防止胞内冰的形成,减小冰晶对细胞的物理损伤[16]。冻干保护剂中的海藻糖、甘油、PVP等物质能够增加其黏度,在降温阶段实现部分玻璃化,但不能完全避免冰晶的形成,冰晶损伤仍然是造成细胞死亡的主要原因[17]。
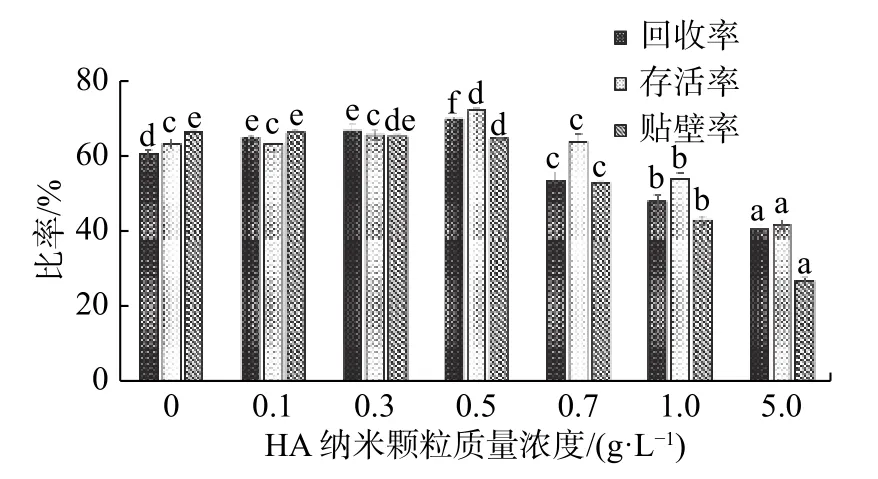
图 3 将细胞与纳米冻干保护剂的混合液于-80 ℃冰箱中4 h后其回收率、存活率和24 h贴壁率Fig.3 Recovery rate, survival rate and 24 h adherence rate of the mixture of cells and nanoprotectants in a refrigerator at -80 °C for 4 h
纳米颗粒的质量浓度较低时,其辅助成核的效果不明显,对细胞存活率没有显著影响。纳米颗粒质量浓度较高时,因其具有较强的表面能,在溶液中难分散且容易以团聚的形式存在[18],在降温过程中虽然能够避免胞内冰的形成,但会形成较大的胞外冰而使溶液离子浓度升高,对细胞造成渗透损伤。另外,纳米颗粒本身对细胞就有很大的毒性,在细胞的冷冻之前,保护剂中大量的纳米颗粒已经对细胞活性产生了损伤,从而导致存活率的下降。
2.4 冻干过程中纳米颗粒对细胞的影响
冻干过程中,细胞水分的去除会破环大分子物质周围的水膜,使物质的空间结构发生不可逆的变化,如蛋白质空间结构的改变,会造成大分子物质的变性而使细胞死亡[19],所以相较于图3的结果,冻干后细胞的回收率、存活率和24 h贴壁率都大幅度下降。
冻干后细胞的回收率和存活率随着保护剂中纳米颗粒质量浓度的增加而提高,当纳米颗粒质量浓度为0.5 g/L时,回收率(37.39%)和存活率(62.02%)都是所有组中最高的,与其他各组之间有显著性差异。继续增加纳米颗粒质量浓度,回收率和存活率却逐渐下降,如图4所示。其保护细胞的机理为以下3点:a. HA纳米颗粒的强表面能能够将周围的水分子吸附在周围而影响溶液性质,提高溶液的黏度并减缓冰晶的生长,因而加强溶液玻璃化的趋势[20];b. HA纳米颗粒与水分子之间有较强的氢键作用[21],减少了溶液中自由水的份额,这时细胞完全被一层保护剂溶液包围,这有利于在干燥时维持细胞膜结构的完整,充分达到保护细胞的效果;c. 在升华干燥中,纳米颗粒能够替代去除的水分而维持细胞原有结构的不变,稳定细胞内活性物质和细胞膜的正常功能,避免脱水而导致细胞的损伤。冻干后细胞的24 h贴壁率都较低,在冻干过程中虽然没有对细胞造成直接的损伤,但是随着细胞中结合水的去除,物质结构的改变会引起细胞原有性质的不同和一些功能的丧失,导致细胞无法正常生长而死亡。

图 4 含不同质量浓度纳米颗粒的保护剂与细胞混合冻干后其回收率、存活率和24 h贴壁率Fig.4 Recovery rate, survival rate and 24 h adherence rate of cells after lyophilization with different mass concentrations of nanoparticles
2.5 复水过程中纳米颗粒对细胞的影响
当固体物质溶于液体时会放出热量,所以在复水过程中,当冻干细胞溶于复水液时会产生强烈的复水热,导致细胞的解体死亡。
如果要检测冻干细胞的活性,必须将细胞进行复水。为了研究纳米颗粒在复水过程中是否会对细胞的活性产生影响,使用不同质量浓度的纳米颗粒复水液复水冻干后的细胞(冻干细胞为同一批次,且细胞冻干时保护剂中均无纳米颗粒),质量浓度低于0.5 g/L时各组之间的回收率和存活率都没有显著性差异,这说明纳米颗粒的加入不能在复水环节提高细胞存活率,其真正起作用是在冷冻和干燥阶段。当质量浓度高于0.5 g/L时,回收率和存活率都有所下降,其结果如图5所示。纳米颗粒质量浓度的增加提高了溶液的导热系数,使得溶液中物质之间的传热加快,产生的复水热对细胞造成更大的损伤。结果表明,添加过多的纳米颗粒不仅对细胞本身造成直接的损伤,也会间接地改变溶液或其他物质的性质而伤害细胞。

图 5 含不同质量浓度纳米颗粒的复水液复水冻干细胞后其回收率、存活率和24 h贴壁率Fig.5 Recovery rate, survival rate and 24 h adherence rate of cells in rehydration solutions with different mass concentrations of nanoparticles
3 结 论
在冻干保护剂中添加适当质量浓度的HA纳米颗粒有助于提高冻干后HepG2细胞的回收率和存活率,当质量浓度为0.5 g/L时保护效果最好,复水后细胞的回收率为37.39%,存活率为62.02%,与各组之间都具有显著差异。当保护剂中纳米颗粒质量浓度高于0.5 g/L时,纳米颗粒对细胞具有很强的毒性,使得回收率和存活率显著下降。适当质量浓度的HA纳米颗粒对HepG2细胞的冷冻干燥的确起到了一定的作用,其机理为在冷冻阶段能够降低过冷,辅助成核,减小冰晶对细胞的损伤;在干燥阶段有助于维持细胞结构,避免脱水而导致细胞膜的破环,而对于复水过程不起作用。以上研究对纳米颗粒应用于生物材料的冻干保存提供了一些新的思路和方法,但更深层次的机理还需进一步的探索。
